扩展功能
文章信息
- 饶烽, 崔钢华, 王琰, 刘伟, 曹薇薇, 史晨辉, 王维山
- RAO Feng, CUI Ganghua, WANG Yan, LIU Wei, CAO Weiwei, SHI Chenhui, WANG Weishan
- 基于FRET技术MMP3生物传感器载体的构建和鉴定
- Construction and identification of FRET-based MMP3 biosensor
- 吉林大学学报(医学版), 2016, 42(02): 210-214
- Journal of Jilin University (Medicine Edition), 2016, 42(02): 210-214
- 10.13481/j.1671-587x.20160204
-
文章历史
- 收稿日期: 2015-07-21
- 网络出版时间: 2016-03-08 12:52:12
2. 新疆民族与地方病教育部重点实验室, 新疆石河子 832000
2. Key Laboratory of Xinjiang Endemic Diseases, Ministry of Education, Shihezi 832000, China
骨关节炎(osteoarthritis,OA)是临床最为常见的关节病变,以软骨渐进性退变和关节功能障碍为主要特征,严重影响中老年人的生活质量。研究[1]表明:多种因素诸如年龄、性别、免疫反应、骨内压升高、细胞因子、基因多态性等均与OA病变有关,但是其具体的病理机制仍然不明。蛋白水解酶对软骨的降解可能是OA病变的主要机制,在众多蛋白水解酶中,以基质金属蛋白酶(matrix metalloproteinase,MMPs)[2]、尿激酶型纤溶酶原激活物(urokinase type plasminogen activator,uPA)[3]的病理作用最为显著,但是蛋白水解酶通过何种途径调控软骨组织的降解、其在体内的表达受到何种信号通路的调控均需要深入研究。
MMPs是一类普遍存在于结缔组织且结构类似、酶活性依赖于Zn2+的蛋白酶超家族,其中基质金属蛋白酶13(MMP13)、基质金属蛋白酶3(MMP3)和基质金属蛋白酶9(MMP9)对软骨组织的降解作用最为显著。MMPs家族的MMP3是最强的裂解胶原的蛋白酶,其作用底物主要是基质中的蛋白多糖和糖蛋白;MMP3可以降低激活纤溶酶原从而下调与细胞相关的纤溶酶活性; MMP3也能水解抗纤溶酶,从而促进纤溶酶介导的蛋白酶解,在OA软骨、滑膜和关节液中的表达均明显升高[4, 5]。
荧光共振能量转移(flurorescence resonance energy transfer,FRET)技术能够在不损伤活细胞的前提下,实时定量定位检测蛋白质相互作用。一般研究细胞表达蛋白的变化量通常采用RT-PCR法和Western blotting法等传统实验方法,然而这些方法会破坏细胞完整性,不能持续动态观察蛋白表达的时空信息,目前在活细胞中观察MMP3的时空信息未见相关报道。为了能动态观察MMP3在活细胞生理状态中的时空信息,本实验采用基因工程方法构建MMP3的生物传感器 ,转染进入人胚肾上皮293T细胞中,运用FRET在显微镜下实时动态观察uPA刺激293T细胞前后MMP3的表达。
1 材料与方法 1.1 细胞、主要试剂和仪器人胚肾上皮293T细胞由石河子大学医学院黄瑾教授惠赠,大肠杆菌DH5α为新疆地方民族与地方病教育部重点实验室保存,Src生物传感器载体由美国约翰霍普金斯大学曹旭教授惠赠。DNA凝胶回收试剂盒、质粒小量制备试剂盒购自TianGen生物科技有限公司,PMD18-T Vector、 Hind Ⅲ限制性内切酶、EcoR Ⅰ限制性内切酶、SphⅠ限制性内切酶等购自日本Takara公司,uPA、T4 DNA连接酶、核酸分子量Marker、Taq酶等购自美国ThermoFisher Scientific公司,细胞转染试剂Lipofectamine 2000购自美国Invitrogen公司,DMEM和胎牛血清购自美国Gibco公司。Zeiss Axiovert 200 M型倒置荧光显微镜购自德国Zeiss公司。
1.2 MMP3-substrate引物的设计合成 搜索NCBI数据库MMP3基因序列,新疆地方民族与地方病教育部重点实验室刘伟老师采用Primer Premier 5.0设计引物并送上海生工公司合成。
引物序列:上游引物,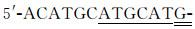
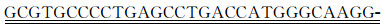
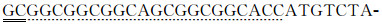 AAGGTGAAGAATTATTC-3′;下游引物,5′- GAATTC TTACTATTTGTACAATTCATTC-3′。 上游引物中虚线处为Linker,单下划线处为SphⅠ酶切位点,双下划线处为MMP3-substrate;下游引物中单下划线处为 EcoRⅠ酶切位点。以Src质粒为模板,PCR反应克隆MMP3-substrate-YPet融合蛋白表达载体的全长序列,MMP3-substrate-YPet约780bp。PCR反应采用25μL体系:ddH2O 10 μL,上游引物和下游引物各0.5 μL,模板Src质粒2 μL,PCR master12.5 μL。反应条件: 预变性 95℃、5 min;变性95℃、30s,退火55℃、30s,延伸72℃、45s,共35个循环;最后延伸72℃、10 min。
AAGGTGAAGAATTATTC-3′;下游引物,5′- GAATTC TTACTATTTGTACAATTCATTC-3′。 上游引物中虚线处为Linker,单下划线处为SphⅠ酶切位点,双下划线处为MMP3-substrate;下游引物中单下划线处为 EcoRⅠ酶切位点。以Src质粒为模板,PCR反应克隆MMP3-substrate-YPet融合蛋白表达载体的全长序列,MMP3-substrate-YPet约780bp。PCR反应采用25μL体系:ddH2O 10 μL,上游引物和下游引物各0.5 μL,模板Src质粒2 μL,PCR master12.5 μL。反应条件: 预变性 95℃、5 min;变性95℃、30s,退火55℃、30s,延伸72℃、45s,共35个循环;最后延伸72℃、10 min。
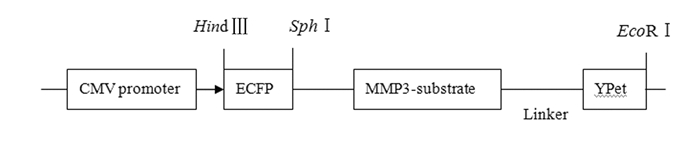
图 1是本实验构建MMP3生物传感器重组质粒的主要部分结构示意图。以PMD18-T Vector为中间载体,在PCR仪中分别对Src和PMD18-T行Hind Ⅲ和EcoRⅠ双酶切,回收大小片段产物,将小片段的酶切产物ECFP-Src-substrate-YPet插入PMD18-T Vector相应的位点,获得了中间重组子Src-PMD18-T(约4500 bp)。再用SphⅠ和EcoRⅠ双酶切Src-PMD18-T,凝胶电泳获得1个大片段和1个小片段,回收大片段产物后,用T4连接酶将大片段产物和MMP3-substrate-Ypet的 PCR产物连接,从而得到MMP3-substrate-PMD18-T(约4200 bp)。通过HindⅢ和EcoRⅠ双酶切处理MMP3-3-substrate -PMD18-T(约4200 bp),最后利用HindⅢ和EcoRⅠ双酶切处理MMP3-substrate-PMD18-T,回收小片段ECFP-MMP3-substrate-YPet(1480 bp)插入pcDNA3.1载体中,获得MMP3生物传感器载体质粒(MMP3-pcDNA3.1,约6873bp)。
1.4 细胞培养和转染人胚肾上皮293T细胞在37℃、5%CO2的培养箱培养,每2d更换含10%胎牛血清的DMEM培养基。在倒置显微镜下观察293T细胞,根据细胞形态学和黏附情况记录细胞图像和观察结果。当细胞贴壁生长覆盖培养皿85%~90%时,0.25%胰蛋白酶消化293T细胞,充分消化后铺入培养皿中用于转染。设置实验组和对照组各6皿,实验组采用6 μL Lipofectamine 2000转染试剂,对照组采用6 μL生理盐水,分别与4 μL MMP3 生物传感器载体质粒转染293T细胞,转染后继续培养24 h,观察MMP3 生物传感器在293T细胞中的表达。
1.5 荧光成像校正分别选定CFP、YFP、CFP-YFP-FRET 3个通道的滤光片作为供体、受体和FRET的滤光片,供体和受体的校正因子A和B分别采用独自表达增强的青色荧光蛋白(ECFP)和独自表达增强的黄色荧光蛋白(YPet)的细胞来检测计算,供体和受体的串色常数用MetaFlour FRET 4.6软件计算[6, 7]。
1.6 FRET监测先选择CFP通道滤光片作为曝光参照,将待监测细胞放置于视野中,采集CFP、YFP和FRET 3个通道的图像,然后选择FRET通道滤光片,圈定数个感兴趣区,并选取1个背景区域扣除背景信号,把供体校正因子、受体校正因子输入MetaFlour FRET 4.6 软件,FRET效率=YFP值/CFP值,采用校正的方法计算FRET值,用伪彩标记的FRET图来表示FRET效率[6, 7]。当CFP、YFP、YFP/CFP比值3条基线平稳后,实验组加入终浓度为2μg·L-1 的uPA,对照组加入等量的PBS,动态监测FRET的变化,设置实验组和对照组各5皿,实验组和对照组分别重复3次。
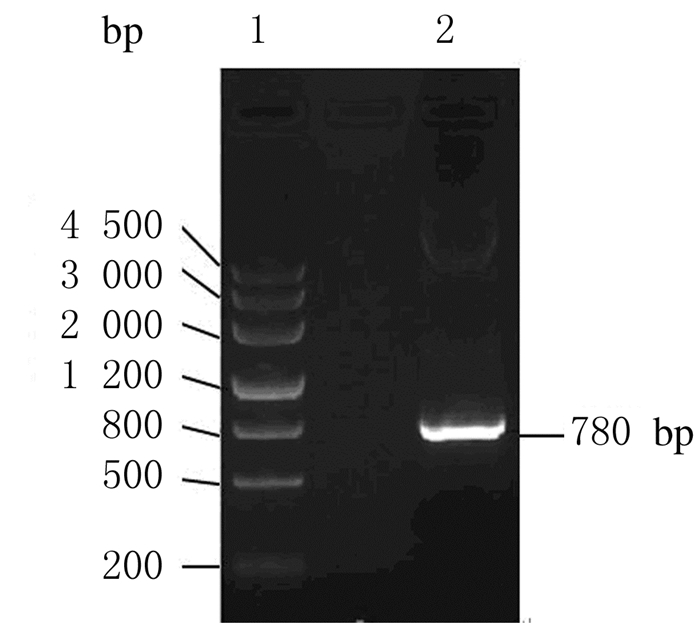
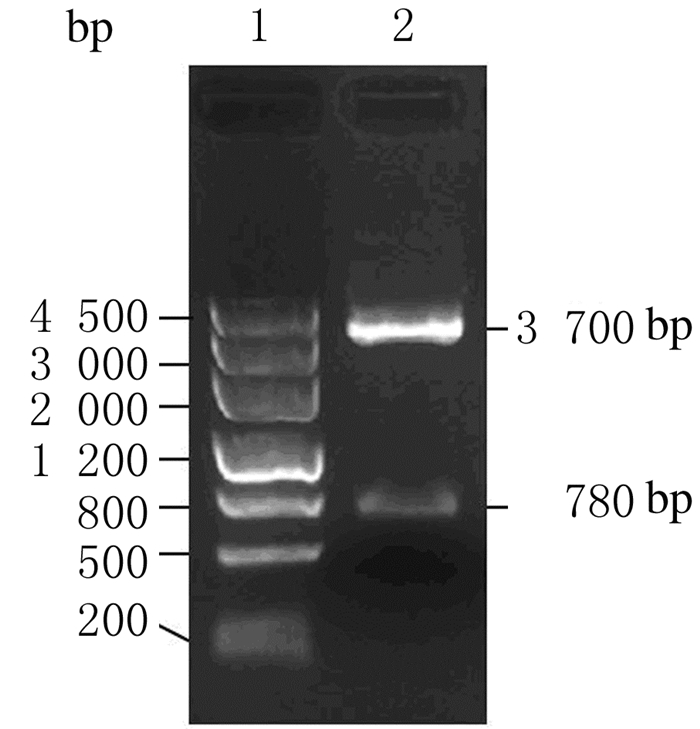
2 结 果 2.1 MMP3生物传感器载体的构建和鉴定以PMD18-T Vector为中间载体,对Src生物传感器载体质粒改造。主要部分结构示意图见图 1。PCR和双酶切鉴定凝胶电泳结果显示:PMD18-T-ECFP载体约3700bp,MMP3-YPet约780 bp(图 2和3),测序验证。
|
| 图1 MMP3生物传感器主要部分结构示意图 Fig.1 Schematic representation of main structure of MMP3 biosensor |
|
| Lane1:DL 4500 marker;Lane2:PCR of MMP3 substrate. 图2 MMP3生物传感器的PCR凝胶电泳图 Fig.2 Gel electrophoregram of MMP3 biosensor detected by PCR |
|
| Lane 1:DL 4 500 marker; Lane 2:Double digestion product of MMP3 biosensor by Sph Ⅰ and EcoR Ⅰ. 图3 MMP3生物传感器的双酶切凝胶电泳图 Fig.3 Gel electrophoregram of MMP3 biosensor digested by double restriction enzyme |
实验组细胞在转染后继续培养24h,通过GFP通道可以观察到很强的绿色荧光,而且MMP3生物传感器于293T细胞中较均匀地分布,转染效率约40%。见图 4(插页二)。

|
| A: Green fluorescence image;B: Bright field image;C: Negative control 图4 MMP3 生物传感器转染293T细胞后的表达 Fig.4 Expression of MMP3 biosensor in 293 T cells after transfection |
通过CFP通道可以看到较弱的青色荧光,在YFP通道可以看到较强的黄色荧光,通过FRET通道未看到明显的黄色荧光,所以未观察到FRET现象。见图 5(插页二)。

|
| A:CFP channel;B: YFP channel;C: FRET channel. 图5 MMP3生物传感器转染293T细胞后的荧光图 Fig.5 Images of MMP3 biosensor in 293T cells after transfection |
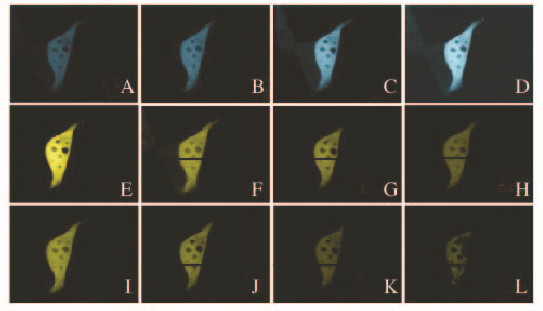
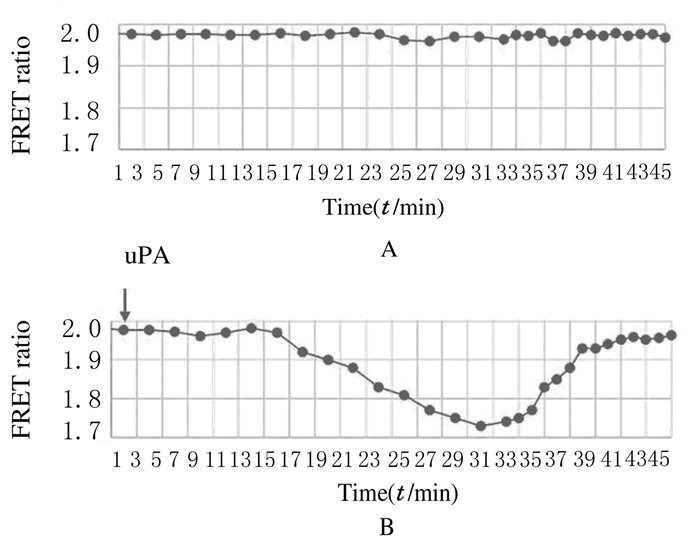
为了能在293T细胞中实时动态观察uPA激活MMP3的生理过程,本研究采用MMP3生物传感器质粒转染293T细胞,细胞分为实验组和对照组,实验组加入uPA,对照组加入PBS,镜下分别观察2组细胞的FRET变化。在对照组中,FRET基本无变化;在实验组中,外源性uPA刺激后大约14min,FRET逐渐降低,再经过15min后降到最低,随后逐渐恢复,约10min恢复至uPA刺激前水平。见图 6(插页二)和图 7。本实验结果表明:通过实时动态FRET分析对照组和实验组的荧光变化比率,可直接验证活细胞下MMP3的时空效应,也直观证实uPA刺激细胞后MMP3表达水平。
|
| A-D:ECFP;E-H:YPet ;I-L :FRET;A,E,I;5 min before transfection; B,F,J: 15 min before transfection; C, G, K: 20 min before transfection; D,H-L: 30 min before transfection. 图6 uPA刺激转染MMP3生物传感器的293T细胞荧光图 Fig.6 Fluorescence images of 293T cells transfected with MMP3 biosensor stimulated by uPA |
|
| A: PBS group; B: uPA stimulation group. 图7 2组MMP3生物传感器的FRET现象 Fig.7 FRET of MMP3 biosensor in two groups |
有学者[8]研究不同退变程度OA软骨组织中MMP3表达发现:早期软骨组织中MMP3高表达,并且与软骨退变程度呈正相关关系。本文作者前期研究[9, 10]发现:外源性uPA可以导致OA的发生,在早期OA患者血清和关节液中MMP3与uPA水平均较正常人群升高,二者呈正相关关系,并且其水平与软骨退变程度相关。因此深入研究MMP3的生物学特性有助于进一步揭示OA的病因学。
FRET是2种荧光分子在电子激发状态产生的距离依赖性的相互作用,其中激发是以一种非辐射的方式从供体分子转移到受体分子上。这种能量转移机制会导致供体荧光减弱和受体荧光发射的增加,当供体和受体分子距离非常接近时(1~10 nm)会产生FRET效应,供体的发射光谱部分与受体吸收光谱重叠。FRET可以用于检测各种生物分子相互作用,尤其是DNA杂交或各种酶反应[11, 12, 13, 14]。
自从绿色荧光蛋白(GFP)和其他不同颜色的荧光蛋白(FPs)成功构建以来,基因编码的探针和生物传感器已被广泛地应用于监察活细胞中分子的定位和活动,特别是基于FRET构建的生物传感器显著地提高了在亚细胞水平对动态分子层次的理解,这些生物传感器也在近几年被广泛应用于研究细胞如何感知力学环境和转入细胞内的分子信号[15]。
Lim等[16]分别构建了MMP12和MMP13 2种FRET探针用来观察活体动物中MMP12和MMP13的活性。Stawarski等[17]构建了基于FRET定位于胞膜的MMP9生物传感器,更好地阐明了MMP9在生理和病理过程中蛋白水解活性的作用。Liao等[18, 19]基于FRET构建了FAK 和 Src2种生物传感器,定位于人间充质干细胞胞膜,并发现在人间充质干细胞分化过程中FAK和 Src分别由不同的分化诱导因子调控。在活细胞中,MMPs由活细胞分泌转运到胞外,因此Yang等[20]基于FRET将MMP2识别序列MSS通过酶切连入CFP和YFP荧光蛋白之间,并将其定位于细胞膜表面,成功地观测到MMP2的激活过程。
本实验根据FRET原理,参照Yang等[20] 使用的方法在MMP3识别底物两端分别连接融合蛋白ECFP和YPet,定位于细胞膜表面,通过检测FRET变化数据跟踪观察MMP3底物被激活的时间和空间信息。本实验构建含有ECFP、MMP3作用底物和YPet融合蛋白的MMP3生物传感器载体,通过PCR和双酶切凝胶电泳及测序鉴定,证实了本实验所构建的MMP3生物传感器。共聚焦显微镜下观察MMP3生物传感器转染率达40%,表明转染293T细胞成功。加入uPA刺激293T细胞后,实验组在13min左右能检测到胞浆的FRET的变化,对照组无明显变化,即uPA能激活MMP3大量表达,从而应用FRET技术证实了本课题组前期研究结果,即uPA可以激活MMP3的表达。近年来很多研究表明:MicroRNA在OA中起到很重要的调控作用,所以后期对于OA软骨细胞,本课题组可以通过生物信息学的方法预测MMP3和uPA的靶基因,选择合适的MicroRNA特异性抑制OA软骨细胞中MMP3和uPA的表达,为治疗OA提供新的方法。
| [1] | Schroeppel JP,Crist JD,Anderson HC,et al.Molecular regulation of articular chondrocyte function and its significance in osteoarthritis[J].Histol Histopathol,2011,26(3):377-394. |
| [2] | Hashimoto M,Nakasa T,Hikata T,et al.Molecular network of cartilage homeostasis and osteoarthritis[J].Med Res Rev,2008,28(3):464-481. |
| [3] | Burrage PS,Mix KS,Brinckerhoff CE.Matrix metalloproteinases:role in arthritis[J].Front Biosci,2006,11:529-543. |
| [4] | Gondi CS,Rao JS.Therapeutic potential of siRNA-mediated targeting of urokinase plasminogen activator,its receptor,and matrix metalloproteinases[J].Methods Mol Biol,2009,487:267-281. |
| [5] | Uchida K,Satoh M,Inoue G,et al.CD11c(+) macrophages and levels of TNF-α and MMP-3 are increased in synovial and adipose tissues of osteoarthritic mice with hyperlipidaemia[J].Clin Exp Immunol,2015,180(3):551-559. |
| [6] | 曹薇薇,刘伟,高原,等.利用荧光生物感受器研究p38MAPK的生物活性[J].生物技术,2014,24(6):86-90. |
| [7] | 曹薇薇,刘伟,王维山,等.利用荧光共振能量转移技术研究TGF-β/Smad3信号转导通路[J].生物医学工程学杂志,2014,31(5):1080-1084. |
| [8] | Chen JJ,Huang JF,Du WX,et al.Expression and significance of MMP3 in synovium of knee joint at different stage in osteoarthritis patients[J].Asian Pac J Trop Med,2014,7(4):297-300. |
| [9] | 王维山,史晨辉,周卓浩,等.一侧兔膝关节注射外源性尿激酶型纤溶酶原激活物引起双侧膝关节软骨降解的实验[J].中国组织工程研究与临床康复,2007,11(19):3738-3741. |
| [10] | 王维山,董金波,何斌,等.OA患者血液及关节液中MMP-3、uPA水平检测及临床意义[J].山东医药,2011,51(3):63-64. |
| [11] | Didenko VV.DNA probes using fluorescence resonance energy transfer (FRET):designs andapplications[J].Biotechniques,2001,31(5):1106-1116. |
| [12] | Orpana AK.Fluorescence resonance energy transfer (FRET) using ssDNA binding fluorescent dye[J].Biomol Eng,2004,21(2):45-50. |
| [13] | Tan W,Wang K,Drake TJ.Molecular beacons[J].Curr Opin Chem Biol,2004,8(5):547-553. |
| [14] | Schäferling M,Nagl S.Optical technologies for the read out and quality control of DNA andprotein microarrays[J].Anal Bioanal Chem,2006,385(3):500-517. |
| [15] | Wang Y,Wang N.FRET and mechanobiology[J].Integr Biol (Camb),2009,1(10):565-573. |
| [16] | Lim NH,Meinjohanns E,Bou-Gharios G,et al.In vivo imaging of matrix metalloprotease12 and matrix metalloprotease 13 activities in the mouse model of collagen-induced arthritis[J].Arthritis Rheumatol,2014,66(3):589-598. |
| [17] | Stawarski M,Rutkowska-Wlodarczyk I,Zeug A,et al.Genetically encoded FRET-based biosensor for imaging MMP-9activity[J].Biomaterials,2014,35(5):1402-1410. |
| [18] | Liao X,Lu S,Zhuo Y,et al.Visualization of Src and FAK activity during the differentiation process from HMSCs to osteoblasts activity[J].PLoS One,2012,7(8):e42709. |
| [19] | Liao X,Lu S,Wu Y,et al.The effect of differentiation induction on FAK and Src activity in live HMSCs visualized by FRET[J].PLoS One,2013,8(8):e72233 |
| [20] | Yang J,Zhang Z,Lin J,et al.Detection of MMP activity in living cells by a genetically encoded surface displayed FRET sensor[J].Biochim Biophys Acta,2007,1773(3):400-407. |
 2016, Vol. 42
2016, Vol. 42


