扩展功能
文章信息
- 郝兴霞, 张东泽, 于泊洋, 张岩, 周圆圆, 邱雪迎, 周好乐, 刘陶迪
- HAO Xingxia, ZHANG Dongze, YU Boyang, ZHANG Yan, ZHOU Yuanyuan, QIU Xueying, ZHOU Haole, LIU Taodi
- 双酚A对成年雄性小鼠的生殖毒性及其作用机制
- Reproductive toxicity of bisphenol A in adult male mice and mechanism
- 吉林大学学报(医学版), 2016, 42(02): 195-199
- Journal of Jilin University (Medicine Edition), 2016, 42(02): 195-199
- 10.13481/j.1671-587x.20160201
-
文章历史
- 收稿日期: 2015-06-08
2. 内蒙古医科大学心身医学实验室, 内蒙古呼和浩特 010110;
3. 内蒙古医科大学遗传学教研室, 内蒙古呼和浩特 010110;
*内蒙古医科大学2012级法医专业;
Δ内蒙古医科大学2012级临床医学专业
2. Psychosomatic Medicine Laboratory, Inner Mongolia Medical University, Hohhot 010110, China;
3. Department of Genetics, Inner Mongolia Medical University, Hohhot 010110, China
双酚A(bisphenol A,BPA)已被证实是一种环境内分泌干扰物(endocrine disrupting chemicals,EDCs)。据统计,世界范围内每年产出超过360万吨,其中约100吨释放入大气中[1]。同时,生活中人们每天都可以接触到 BPA,如电子产品、运动器材、汽车、CD 光盘、DVD和复写纸等,这些聚碳酸酯塑料和环氧树脂产物在暴露于高温、酸、碱等环境中时,会释放溶出BPA,通过皮肤、消化道、呼吸道等途径进入人体[2, 3]。国内外研究[4, 5]已证明:BPA对动物机体有着潜在性、长期性的破坏作用,与很多系统疾病的发生有关。最新研究[6, 7, 8, 9]显示: BPA暴露能引起子代小鼠雄性比例增加;低剂量BPA会导致斑马鱼性早熟;胚胎发育过程中BPA会影响睾丸的发育;BPA易致胎儿先天发育缺陷。国内外有关BPA的生殖毒性研究大多集中在围产期BPA暴露对子代的影响及性激素的改变,而对于雄性成年期BPA暴露造成的睾丸组织内细胞的损伤研究较少。本研究利用不同剂量BPA染毒成年小鼠,探讨其对小鼠睾丸组织内细胞造成的损伤及其分子机制,从而为BPA的生殖毒性提供理论研究基础。
1 材料与方法 1.1 实验动物、主要试剂和仪器雄性清洁级昆明(KM)小鼠40只,8周龄,体质量 30~33 g,由内蒙古大学实验动物中心提供,动物合格证号:SCXK(蒙)2002-0001,实验前适应性喂养 1 周。Annexin Ⅴ-FITC/PI 凋亡检测试剂盒购于美国Sigma公司;自杀相关因子(factor associated suicide,Fas)和Fas相关死亡域蛋白(Fas-associated death domain,FADD)免疫组织化学试剂盒购于北京博奥森生物技术有限公司。石蜡切片机为莱卡医疗仪器有限公司产品;FACSCaUbur流式细胞仪为美国BD公司产品。
1.2 动物分组和染毒小鼠随机分为对照组和低、中、高剂量BPA组,每组 10只。低、中、高剂量BPA组小鼠分别给予100 、200和400 mg·kg-1BPA灌胃染毒(BPA以玉米油为溶剂溶解);对照组小鼠按体质量比例玉米油灌胃;每日晨8:00灌胃染毒,持续4周。最后一次灌胃 24 h 后,颈椎脱臼处死小鼠,取睾丸组织样品。
1.3 流式细胞术检测睾丸组织内的细胞凋亡分别取各组小鼠左侧睾丸,剥除粘连脂肪等组织。制备单细胞悬液,将细胞浓度调整至5×105 mL-1。各组取100 μL细胞悬液,严格按照AnnexinⅤ-FITC/PI凋亡试剂盒说明书完成操作,经FACSCaUbur流式细胞仪检测细胞凋亡率。
1.4 免疫组织化学法检测Fas和FADD 表达 取小鼠右侧睾丸,制作5μm睾丸组织石蜡切片,严格按照Fas和FADD免疫组织化学试剂盒说明书操作。阳性表达为细胞内呈现棕黄色颗粒。400倍或1000倍光学显微镜下随机选取10个生精小管,分别观察并计算Fas和FADD阳性细胞表达率,Fas(FADD)阳性细胞表达率=表达Fas(FADD)的阳性细胞/生精小管内所有细胞×100%。
1.5 统计学分析采用 SPSS20.0 统计软件进行统计学分析。各组小鼠睾丸组织中细胞凋亡率、FAS和FADD阳性细胞表达率以x±s表示,多组间样本均数比较采用单因素方差分析,两两比较采用Student-Neuman-Keuls法。以P<0.05 表示差异有统计学意义。
2 结 果 2.1 流式细胞术检测各组小鼠睾丸组织中细胞凋亡率对照组和低、中、高剂量BPA组小鼠睾丸组织中细胞凋亡率分别 为(7.52±1.78)%、(8.79± 1.14)%、(22.87±2.60)%和(58.67±1.57)%。与对照组比较,低剂量BPA组小鼠睾丸组织中细胞凋亡率无明显变化(P>0.05);中和高剂量BPA组小鼠睾丸组织中细胞凋亡率升高(P<0.05)。与低剂量BPA组比较,中和高剂量BPA组细胞凋亡率均升高 (P<0.05)。见图 1和表 1。
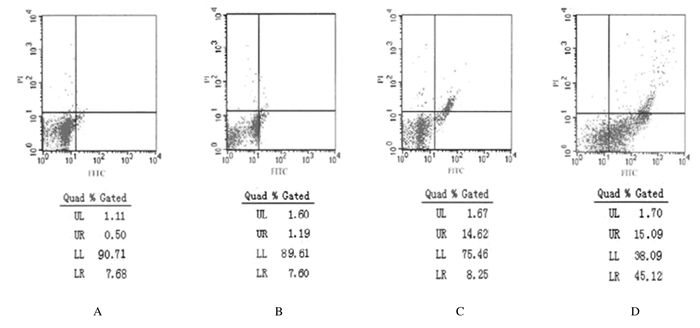
|
| A: Control group; B: Lowdose of BPA group; C; Moderatedose of BPA group; D: Highdose of BPA group. 图1 流式细胞术检测各组小鼠睾丸组织中细胞凋亡率 Fig.1 Apoptotic rates of cells in testis tissue of mice in various groups detected by flow cytometry |
| (x±s,η/%) | ||||
| Group | n | Apoptotic rate | Expression rate of Fas | Expressionrate of FADD |
| *P<0.05 compared with control group; △P<0.05 compared with low dose of BPA group; # P<0.05 compared with moderate dose of BPA group. | ||||
| Control | 10 | 7.52±1.78 | 7.91±1.26 | 6.01±1.53 |
| Low dose of BPA | 10 | 8.79±1.14 | 8.86±1.31 | 5.50±0.72 |
| Moderate dose of BPA | 9 | 22.87±2.60*△ | 15.21±0.91*△ | 12.87±0.91*△ |
| High dose of BPA | 9 | 58.67±1.57*△# | 20.05±1.05*△# | 16.44±1.23*△# |
在对照组可见Fas少量表达;与对照组比较,低剂量BPA组Fas阳性细胞表达率无明显变化(P>0.05);中剂量组Fas阳性细胞着色的细胞层数比例较对照组增多,Fas阳性细胞表达率升高(P<0.05);高剂量BPA组Fas阳性细胞表达率明显升高(P<0.05)。 与低剂量BPA组比较,中和高剂量BPA组Fas阳性细胞表达率升高(P<0.05)。见图 2(插页一)和表 1。
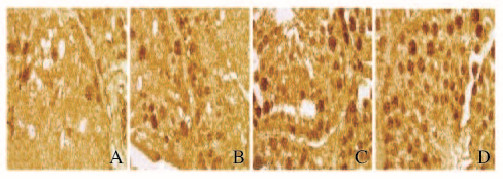
|
| A: Control group; B: Lowdose of BPA group; C; Moderate dose of BPA group; D: High dose of BPA group. 图2 免疫组织化学法检测各组小鼠睾丸组织中Fas表达(×100) Fig.2 Fas expression in testis tissue of mice in various groups detected by immunohistochenistry (×100) |
在对照组可见FADD少量表达。与对照组比较,低剂量BPA组FADD阳性细胞表达率无明显变化(P>0.05);中和高剂量BPA组FADD阳性细胞表达率明显升高(P<0.05);与低剂量BPA组比较,中和高剂量BPA组FADD阳性细胞表达率明显升高(P<0.05)。见图 3(插页一)和表 1。

|
| A: Control group; B: Lowdose of BPA group; C; Moderate dose of BPA group; D: High dose of BPA group. 图3 免疫组织化学法检测各组小鼠睾丸组织中FADD表达(×100) Fig.3 FADD expression in testis tissue of mice in various groups detected by immunohistochenistry (×100) |
中和高剂量BPA组小鼠睾丸组织中细胞凋亡率与Fas、FADD阳性细胞表达率呈正相关关系(r=0.430,r=0.238,P<0.05;r=0.637,r=0.359,P<0.05)。见表 2。
| Group | Expression rate of Fas | Expression rate of FADD | ||
| r | P | r | P | |
| Moderate dose of BPA | 0.430 | 0.002 | 0.238 | 0.000 |
| High dose of BPA | 0.637 | 0.000 | 0.359 | 0.000 |
近几年,人们对BPA的安全性及其对健康的影响研究越来越广泛,主要从免疫系统、神经系统、生殖系统及代谢、肿瘤的发生等[10]方面展开研究,尤其对生殖系统影响的研究已成为国际性热点。有研究[4, 11, 12]报道:低剂量与高剂量BPA对机体细胞造成不同程度损伤;而不同剂量BPA对雄性生殖系统的影响机制目前尚无明确的结论,需不断地完善。
本研究采用BPA灌胃染毒成年期(最佳生育期)小鼠,模拟最常见的人类及动物与BPA的接触方式。在前期研究的基础上(不同剂量BPA会造成小鼠睾丸组织损伤),为进一步证实BPA对生殖系统的损伤作用,本课题组采用流式细胞术检测生殖细胞凋亡发现:中和高剂量BPA可造成睾丸组织中细胞凋亡率升高。细胞凋亡在精子正常发生中起重要作用,精子细胞数量的多少主要取决于细胞增殖和凋亡的动态平衡,一旦动态平衡被打破,精子细胞的数量、质量就会受到威胁,从而降低生育功能。有研究[13, 14]报道:邻苯二甲酸二辛酯和邻苯二甲酸等环境内分泌干扰物可导致睾丸组织中细胞凋亡率升高。本研究中BPA作为EDCs的一种,对睾丸组织中细胞的损伤与文献报道[13, 14]基本一致。
体内众多的基因参与正常自发性睾丸内细胞凋亡,并精准调控细胞增殖与凋亡的动态平衡,而受外源因素诱导的细胞过度凋亡其发生机制又是什么?鲍爱梅[15]在研究小鼠精子发生障碍的初步机制时发现:睾丸中有FADD基因表达,认为FADD磷酸化使染色体DNA断裂,使生精细胞凋亡率升高,造成精子生成障碍。
本研究采用免疫组织化学法检测睾丸组织中Fas和FADD表达结果显示:中和高剂量BPA组Fas和FADD阳性细胞表达上调,与对照组比较差异有统计学意义;并且与同组别睾丸组织中细胞凋亡率呈正相关关系。Fas基因属于TNF/NGF受体超家族成员,胞内含有1个由145个氨基酸组成的死亡结构域(death domain,DD),起传导凋亡信号的作用;跨膜区由21个氨基酸组成,决定其跨膜特性;胞外区由157个氨基酸组组成,称为死亡激发域。FADD又名Fas相关死亡结构域蛋白,在细胞周期、细胞增殖、细胞凋亡等众多过程中发挥重要功能,能在细胞核和细胞质之间穿梭。FADD由羧基末端的DD和氨基末端的死亡效应域(death effect domain,DED)两部分组成;BPA引起的睾丸组织中细胞凋亡很有可能是激活了FADD的DD,使其直接与Fas的DD结合,二者相互作用后,暴露FADD的DED,通过激活caspase-8酶原,引起caspase级联反应,从而激活Fas凋亡受体信号通路,引起睾丸组织中细胞凋亡。
综上所述,BPA作为一种环境内分泌激素,能够诱导小鼠睾丸组织内细胞凋亡,此凋亡受体信号通路的激活与调控基因FADD和Fas有关。通过抑制FADD表达,可阻断Fas凋亡受体诱导的细胞凋亡信号通路,解救细胞过渡凋亡,从而提高雄性动物精液质量,改善不良生育功能。本研究进一步揭示了BPA的生殖毒性及机制,提醒育龄期男性尽可能避免接触BPA。本研究结果为解决男性不育渐成为困扰全球的重大科学问题提供更加直接的理论证据。当然,BPA也可能通过其他信号通路促发细胞凋亡,本课题组将在今后的研究工作中更深入探讨。
| [1] | Vandenberg LN,Chahoud I,Heindel JJ,et al.Urinary,circulating and tissue biomonitoring studies indicate wide-spread exposure to bisphenol A[J].Environ Health Perspect,2010,118(8):1055-1070. |
| [2] | Zalko D,Jacques C,Duplan H,et al.Viable skin efficiently absorbs and metabolizes bisphenol A[J].Chemosphere,2011,82(3):424-430. |
| [3] | 黄伯贤,覃莲菊,崔毓桂,等.双酚A在日常生活中的接触及其对人类生殖内分泌的干扰[J].生殖与避孕,2013,33(10):696-700. |
| [4] | Rezg R,El-Fazaa S,Gharbi N,et al.Bisphenol A and human chronic diseases:current evidences,possible mechanisms,and future perspectives[J].Environ Int,2014,64(3):83-90. |
| [5] | 王晓梅,洪燕,陈锋.中低剂量双酚A对小鼠肝、肾氧化损伤作用的实验研究[J].实用预防医学,2013,20(3):280-282. |
| [6] | 李玉华,段斐,杨芬,等.青春期雄鼠BPA暴露对生殖功能及子代性别比的影响[J].生殖与避孕,2015,35(3):141-145. |
| [7] | Kinch CD,Ibhazehiebo K,Jeong JH,et al.Low-dose exposure to bisphenol A and replacement bisphenol S induces precocious hypothalamic neurogenesis in embryonic zebrafish[J].Proc Natl Acad Sci USA,2015,112(5):1475-1480. |
| [8] | Chevalier N,Brucker-Davis F,Lahlou N,et al.A negative correlation between insulin-like peptide 3 and bisphenol A in human cord blood suggests an effect of endocrine disruptors on testicular descent during fetal development[J].Hum Reprod,2015,30(2):447-453. |
| [9] | Guida M,Troisi J,Ciccone C,et al.Bisphenol A and congenital developmental defects in humans[J].Mutat Res,2015,774(8):33-39. |
| [10] | Sharpe RM.Bisphenol A exposure and sexual dysfunction in men:editorial commentary on the article ‘Occupational exposure to bisphenol-A (BPA) and the risk of self-reported male sexual dysfunction,Li et al.,2009’[J].Hum Reprod,2010,25(2):292-294. |
| [11] | Vandenberg LN,Colborn T,Hayes TB,et al.Hormones and endocrine-disrupting chemicals:low-dose effects and nonmonotonic dose responses[J].Endo Rev,2012,33(3):378-455. |
| [12] | Bondesson M,Jonsson J,Pongratz I,et al.A CASCADE of effects of bisphenol A[J].Reprod Toxicol,2009,28(4):563-567. |
| [13] | Sobarzo CM,Lustig L,Ponzio R,et al.Effect of di-(2-ethylhexyl) phthalate on N-cadherin and catenin protein expression in rat testis[J].Reprod Toxicol,2006,22(1):77-86. |
| [14] | McClusky LM,de Jager C,Bornman MS.Stage-related increase in the proportion of apoptotic germ cells and altered frequencies of stages in the spermatogenic cycle following gestational,lactational,and direct exposure of male rats to p-nonylphenol[J].Toxicol Sci,2007,95(1):249-256. |
| [15] | 鲍爱梅.FADD磷酸化对雄性小鼠精子发生影响的研究[D].南京:南京医科大学,2011:1-74. |
 2016, Vol. 42
2016, Vol. 42


