扩展功能
文章信息
- 邢志文, 董奕君, 孙伟霞, 孙韬, 远航
- XING Zhiwen, DONG Yijun, SUN Weixia, SUN Tao, YUAN Hang
- 主动脉瓣感染性心内膜炎致肾脏损害1例报告并文献复习
- A case report of renal damage caused by aortic value infective endocarditis and literature review
- 吉林大学学报(医学版), 2016, 42(01): 149-151
- Journal of Jilin University (Medicine Edition), 2016, 42(01): 149-151
- 10.13481/j.1671-587x.20160130
-
文章历史
- 收稿日期: 2015-09-26
2. 郑州大学附属郑州中心医院肾病科, 河南郑州 450007
2. Department of Nephrology, Affiliated Zhengzhou Central Hospital, Zhengzhou University, Zhengzhou 450007, China
感染性心内膜炎(infective endocarditis,IE)是细菌等病原微生物经血流定植于心内膜所致的严重感染性疾病,抗生素使用前约36%的急性IE患者并发肾小球肾炎,抗生素应用后仍有22.4%的IE并发肾小球肾炎,而国外报道IE相关肾损害发生率<15%[1]。IE致肾损害临床表现为急进性肾炎综合征,起病急,病情重、进展快,一般经肾脏病理学诊断后可做出明确诊断;若仅有蛋白尿、镜下血尿,而IE的表现不典型时,通常因未引起足够重视而未及时行肾脏病理学检查,易误诊为原发性肾小球疾病。本文作者针对1例以蛋白尿、镜下血尿为主要临床表现的IE并发肾脏损害的患者,结合文献资料对该病的诊治过程进行总结回顾。
1 临床资料患者,男性,28岁,因发现蛋白尿及镜下血尿1年于2014年4月22日就诊于吉林大学第一医院肾病内科。患者1年前体检时发现镜下血尿及蛋白尿(具体情况不详),未进行系统治疗。6个月前因发热,伴咳嗽、胸痛,入本院呼吸科诊治。实验室检查尿常规:潜血3+,蛋白2+;血生化:尿素氮(BUN)11.29mmol·L-1,肌酐(CRE)279μmol·L-1,白蛋白(ALB)29.9 g·L-1。诊断为肺炎,经抗感染治疗后热退,肾功能恢复正常出院。此后仍有间断发热,体温最高达38.5℃,可自行缓解。因持续尿蛋白阳性入吉林大学第一医院肾病内科治疗。既往史:出生5个月发现先天性心脏病(室间隔膜部未闭),未治疗。入院查体:体温36.5℃,脉搏90min-1,呼吸18 min-1,血压129/80 mmHg,慢性病容,全身皮肤无皮疹、淤点、淤斑,未见Osler结节。双肺听诊呼吸音清,未闻及干湿啰音和胸膜摩擦音。心率90 min-1,节律整。主动脉瓣第一听诊区可闻及3/6级舒张期杂音。腹平软,双下肢轻度水肿。辅助检查:尿常规,潜血3+,蛋白3+,红细胞21.7/高倍镜视野(HPF);尿蛋白定量2.06g/24h(尿量1650 mL·d-1);血常规,Hb 76 g·L-1,WBC 6.32×109 L-1,网织红细胞百分比2.14%;C反应蛋白(CRP)78.80 mg·L-1;血液生化,ALB32.1 g·L-1,BUN 5.34 mmol·L-1,CRE110 μmol·L-1。抗中性粒细胞胞浆(ANA)、抗核抗体(ANCA)、抗磷脂抗体、抗GBM抗体和冷球蛋白检测均无异常。心脏超声提示:先天性心脏病室间隔缺损(膜周部),考虑主动脉瓣赘生物形成,心包腔少量积液。于4月23日行肾活检术,病理检测结果回报:14个肾小球中,系膜细胞和系膜基质弥漫轻度增生,肾小球基底膜未见明显增厚,肾小球内未见明确嗜复红蛋白沉积;1个肾小球球囊腔内见多量渗出性纤维素和炎细胞破坏少部分毛细血管袢(图 1A,见插页四),1个肾小球见小细胞纤维素性新月体形成(图 1B,见插页四);肾小管上皮细胞空泡变性,部分小管扩张,偶见小灶状小管炎伴管腔内均质粉染物质沉积;肾间质灶状淋巴、巨噬细胞浸润伴轻度纤维化,偶见少量均质粉染物质。刚果红染色及还原实验阴性。免疫荧光检测:IgA(-),IgM(+),IgG(-),C3(++),C4(-),C1q(+),F(-),节段性沿毛细血管壁、系膜区沉积。病理诊断:局灶性肾小球肾炎。电镜观察提示:符合系膜增生性肾炎。给予金水宝0.99g,每日3次口服;代文80 mg,每日1次口服。4月28日患者无明显诱因出现高热,最高达40℃,伴有寒战,反复血培养结果为革兰阳性菌,根据药敏结果使用美罗培南治疗2d后体温下降,此后间断发热,体温最高38.2℃。于5月14日转入心脏外科行室间隔缺损修补术、双腔右心室畸形矫治术、主动脉瓣置换术和瓣膜赘生物清除术,术后患者恢复良好,无发热,出院时尿蛋白降至1+。8月25日随访:尿常规蛋白2+,尿蛋白定量1.09g/24h,血常规及肝肾功能正常。
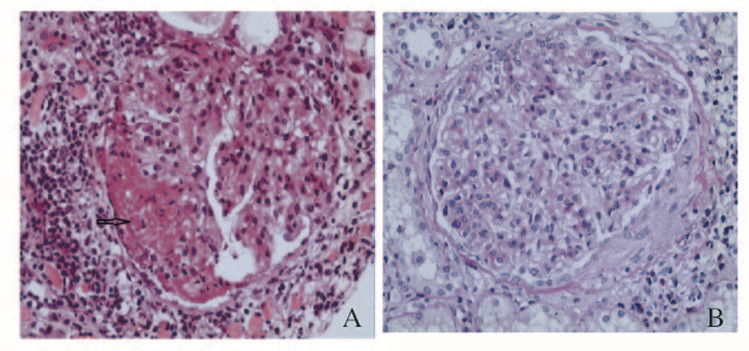
|
| A:HE staining; B:PAS staining. 图 1 IE 并发肾损害患者肾组织病理学检测结果(×40) Fig.1 Results of pathological of kidney tissue in patients with IE complicated with renal damage(×40) |
IE典型表现包括心脏杂音、皮肤瘀斑、脾大和杵状指等。由IE激发的免疫机制和栓塞亦可造成其他脏器的病变,如栓塞性肾小球肾炎、弥漫性肾小球肾炎以及心肌炎和脑膜炎等。 IE相关肾损害发病机制至今仍不完全清楚。有文献[2, 3]报道:肾脏洗脱液中既可以检测到金黄色葡萄球菌和溶血性链球菌的抗原[3],也可检测到其特异性抗体,提出IE肾损害为免疫复合物致病。金黄色葡萄球菌产生的肠毒素(staphylococcal enterotoxin,SE)很稳定,不易被破坏,可经肾小球自由滤过,并被近端肾小管细胞完全重吸收,因此肾脏在肠毒素清除中的作用可能尤为重要。Satoskar等[4]进一步揭示了SE可与抗原提呈细胞表面的主要组织相容性复合物Ⅱ类分子结合形成复合物,其结合部位位于抗原结合槽以外的区域,因此可不经加工直接与T淋巴细胞抗原受体的β链V区(TCR Vβ)结合,发挥超抗原作用,并提出上述过程可致T淋巴细胞大量活化、促炎细胞因子显著增加,进而激活B细胞分泌多克隆抗体,导致免疫复合物的形成。
复习国内外文献报道及相关病例后,本文作者认为IE相关性肾损害的诊断要点如下:①IE病史。IE是IE相关性肾损害的原发疾病,IE病史是诊断的关键点。根据感染性心内膜炎诊治指南[5, 6],IE的诊断标准包括临床主要标准(阳性血培养、超声心动图阳性发现即心内膜受累证据和次要标准(易感因素、发热、血管现象及免疫现象等)。该患者间断发热、血培养阳性、超声心动图提示主动脉瓣膜赘生物形成,有先天性心脏病病史,虽既往未明确诊断为IE,但考虑患者IE病史较长。②临床表现。IE相关性肾炎患者表现为血尿(肉眼血尿或镜下血尿)、蛋白尿,伴或不伴肾功能受损,少数可以表现为急进性肾炎综合征。该例患者存在镜下血尿及蛋白尿,无肾功能下降。③病理表现。IE肾损害病理表现多样,光镜下典型表现为局灶节段增生性肾小球肾炎伴局灶新月体形成,可有弥漫毛细血管内增生性病变、肾局灶梗死、急性间质性肾炎和急性肾小管坏死等[7, 8]。该例患者肾脏穿刺病理诊断为局灶性系膜增生性肾小球肾炎,并有局灶性小管间质病变。④经抗感染或手术清除感染灶后,肾功能得以恢复。该例患者经抗感染治疗及瓣膜赘生物清除术后,定期随访,尿蛋白趋于正常,肾功能及肾小球滤过率始终正常。
一般认为,在IE相关性肾损害的治疗中,积极有效的抗感染治疗或瓣膜置换清除感染灶最为重要。李敏侠等[9]报道1例IE相关性肾损害患者,肾脏病理检查可见细胞性新月体形成,在抗感染治疗的同时加用强的松治疗,随访2年半后患者CRE水平恢复正常。但也有学者[10, 11]认为:使用激素和免疫抑制剂不安全,单用抗生素即可使新月体性肾炎恢复正常。目前对于在抗感染治疗的同时是否加用激素和免疫抑制剂仍存在争议。本病例仅行抗感染治疗,未使用激素及免疫抑制剂,在患者手术治疗恢复后的定期随访中,尿蛋白水平始终维持在0.4~1.0g/24h,肾功能及肾小球滤过率始终正常,说明在清除了感染灶及抗感染治疗后,IE相关性肾损害也得到了有效的控制,肾功能逐渐恢复。
| [1] | Povoas D,de Figueiredo M,Murinello A,et al. Acute bivalvular left-sided methicillin-resistant Staphylococcus aureusendocarditis with cardiac,cerebral,renal and septic complications[J]. Rev Port Cardiol,2011,30 (6):611-620. |
| [2] | Yum M,Wheat LJ,Maxwell D,et al.Immunofluorescent localization of Staphylococcos aureus antigen in acute bacterial endocarditis nephritis[J].Am J Clin Pathol,1978,70(5):832-835. |
| [3] | Perez GO,Rothfield N,Williams RC.Immune-complex nephritis in bacterial endocarditis[J].Arch Intern Med,1976,136(3):334-336. |
| [4] | Satoskar AA,Nadasdy G,Plaza JA,et al.Staphylococcus infection-associated glomerulonephritis mimicking IgA nephropathy[J].Clin J Am Soc Nephrol,2006,1(6):1179-1186. |
| [5] | Prendergast B D.Diagnostic criteria and problems in infective endocarditis[J].Heart,2004,90(6):611-613. |
| [6] | Westphal N,Pliht B,Naber C.Infective endocarditis-prophylaxis,diagnostic-criteria and treatment[J].Dtsch Arztebl Int,2009,106(28/29):481-490. |
| [7] | Mantan M,Sethi GR,Batra VV.Post-infectious glomerulonephritis following infective endocarditis:amenable to immuosuppression[J].Indian J Nephrol,2013,23(5):368. |
| [8] | Khalighi MA,Nguyen S,Wiedeman JA,et al.Bartonella endocarditis-associated glomerulonephritis:a case report and review of the literature[J].Am J Kidney Dis,2014,63(6):1060-1065. |
| [9] | 李敏侠,邱 强,魏日胞,等.感染性心内膜炎合并新月体肾炎2例及文献复习[J].军医进修学院学报,2012,33(9):974-976,978. |
| [10] | Reza Ardalan M,Trillini M.Infective endocarditis mimics ANCA associated glomerulonephritis[J].Caspian J Intern Med,2012,3(3):496-499. |
| [11] | Wong V,Adams J,Jones MI,et al.Pneumococcal endoprosthetic pulmonary valve endocarditis with crescentic glomerulonephritis and acute renal failure[J].Clin Nephrol,2009,71(3):318-320. |
| [12] | 梁丽芬,李 哲,雷 宇,等.肝硬化合并红斑丹毒丝菌性心内膜炎1例报告[J].中国实用内科杂志,2015,35(9):801-803. |
 2016, Vol. 42
2016, Vol. 42


