扩展功能
文章信息
- 魏静波, 刘辉, 朱小茼, 刘聪慧, 曲银娥
- WEI Jinbo, LIU Hui, ZHU Xiaotong, LIU Conghui, QU Yine
- 药物流产后蜕膜组织中IL-10和IL-12表达水平及其对异常子宫出血的影响
- Expression levels of IL-10 and IL-12 in decidua tissue and their influence in abnormal uterine bleeding after abortion
- 吉林大学学报(医学版), 2016, 42(01): 134-138
- Journal of Jilin University (Medicine Edition), 2016, 42(01): 134-138
- 10.13481/j.1671-587x.20160127
-
文章历史
- 收稿日期: 2015-01-29
2. 华北理工大学办公室, 河北唐山 063000;
3. 华北理工大学心理学院, 河北唐山 063000;
4. 华北理工大学附属医院妇产科, 河北唐山 063000
2. Office of North China University of Science and Technology, Tangshan 063000, China;
3. School of Psychology, North China University of Science and Technology, Tangshan 063000, China;
4. Department of Obstetrics and Gynecology, Affiliated Hospital, North China University of Science and Technology, Tangshan 063000, China
药物流产(简称药流)方便简单,痛苦小,临床常广泛应用于终止早期妊娠,但药流后子宫出血量多、出血时间长是其常见并发症。有报道[1]显示:6%~10%的药流患者存在异常子宫出血,严重影响患者身体健康,其发病机制尚未完全阐明。随着生殖免疫学研究逐渐深入,免疫因素在药流后子宫出血发生中的作用日益受到关注。白细胞介素10(interleukin-10,IL-10)和白细胞介素12(interleukin-12,IL-12)作为体内有代表性的免疫抑制因子和免疫促进因子,在炎症及肿瘤发生中的作用受到广泛关注[2],但其在药流后异常子宫出血中是否发挥重要作用还鲜有报道。本研究应用免疫组织化学法和Western blotting法检测IL-10和IL-12在药物流产后蜕膜组织中的表达情况,旨在探讨IL-10和IL-12在蜕膜组织局部的表达水平与药物流产后异常子宫出血的相关性。
1 资料与方法 1.1 研究对象收集华北理工大学附属医院妇产科2011年9月—2013年9月要求终止妊娠的健康孕妇60例,年龄18~40岁,平均年龄(23.0±4.5)岁。所有患者停经8周以内,经临床检查、B超及血、尿HCG和孕酮检查证实为早期宫内妊娠,并排除孕酮和/或人绒毛膜促性腺激素(HCG)水平低引起的先兆流产及稽留流产患者。所有受试者按意愿自行选择药物流产或吸宫流产终止妊娠。流产前采集病史,包括年龄、孕产次、停经天数,并进行妇科检查及血常规、B超检查。2组受试者一般情况比较差异无统计学意义(P>0.05),均无内科及手术禁忌证,无药物过敏史。药流方法为空腹口服米非司酮,晨50mg,晚25mg,共2d,总量150mg,于第3天晨口服米索前列醇0.6mg,并随诊。
1.2 标本采集处理①人工流产组20例,常规负压吸引人工流产,留取吸出物中的蜕膜组织;②药物流产完全组20例,收集服用米索前列醇后当天及2d内排出的胎囊及蜕膜组织,经随诊月经正常来潮;③药物流产不全组20例,药物流产后阴道出血持续超过2周以上,临床及B超示宫腔残留,行清宫术,留取手术刮除标本。以上标本取材后立即用20倍体积10%缓冲甲醛固定液固定。常规梯度酒精脱水、透明、浸蜡、石蜡包埋,切片厚度约5μm,40℃水浴展片,用粘片剂(蛋白甘油)处理过的载玻片捞片,置于60℃烤箱烘烤2~3h,置切片盒中4℃冰箱保存备用,待进行HE及免疫组织化学检测;同时另取部分组织迅速放入-180℃的液氮中30min,然后放置-80℃的低温冰箱中保存,待进行Western blotting检测。
1.3 主要试剂IL-10兔抗人多克隆抗体和IL-12兔抗人多克隆抗体(美国Epitomics公司)。
1.4 HE染色观察蜕膜组织的组织病理学选取组织切片脱蜡至水,苏木精复染细胞核,盐酸酒精分色,伊红染胞质,脱水透明封片,应用BX-63型光学显微镜(日本Olympus公司)对HE染色标本进行组织病理学观察,包括上皮、腺体、间质和血管等的变化情况。
1.5 免疫组织化学法检测IL-10和IL-12表达水平严格按照SABC试剂盒说明进行染色。组织切片常规脱蜡至水,3%H2O2溶液室温封闭内源性过氧化物酶;组织抗原行热修复(0.01 mol·L-1枸橼酸盐缓冲液中煮沸10 min),正常山羊血清封闭;滴加一抗(1∶500兔抗人IL-10多克隆抗体、1∶300兔抗人IL-12多克隆抗体),4℃冰箱中过夜,PBS冲洗3次,每次5min;加生物素化二抗,室温孵育30min,PBS冲洗3次,每次5min;加辣根过氧化物酶标记的链酶卵白素室温孵育20min,PBS冲洗4次,每次5min;DAB显色10min后进行苏木素核复染、脱水、透明、封片。用PBS代替一抗作为阴性对照。阳性结果判定标准:染色结束后在阴性对照片无特异性着色的情况下对切片进行判读:IL-10和IL-12在200倍光镜下,以细胞膜或胞浆染成黄色、棕色或棕褐色,染色强度高于背景的非特异染色者为阳性细胞;每一标本取10个视野,每个视野中的阳性反应强度采用麦克奥迪数码医学分析系统测定积分光密度(IA)值,以IA值表示蛋白表达水平。
1.6 Western blotting法检测IL-10和IL-12蛋白表达水平提取蛋白质并采用微孔酶标仪法检测蛋白浓度。制备10%十二基甲酸钠-聚丙烯酰胺凝胶(SDS-PAGE)进行Western blotting检测(10%分离胶、5%浓缩胶),每孔加入50 μg蛋白质,恒压120V电泳至胶的底部,转移到硝酸纤维素膜上;5%脱脂奶粉封闭2h后,分别加入1∶1000兔抗人IL-10一抗和1∶500兔抗人IL-12一抗,4℃冰箱中过夜;TBST漂洗3次,每次10 min,然后加入TBST稀释的二抗(稀释度1∶5000),37℃摇床2h,TBST漂洗4次,每次10 min;化学发光底物A液与B液1∶1混合,室温反应5 min后,吸干反应液,Bio-rad生物分子成像仪扫描图像,图像分析软件 (ImageJ)行灰度扫描分析,以目的蛋白产物条带灰度值与β-actin蛋白产物条带灰度值的比值作为蛋白相对表达水平。
1.7 统计学分析采用SPSS11.5统计软件进行统计学分析。IL-10和IL-12蛋白表达水平以 x±s 表示,多组间样本均数比较采用单因素方差分析,两两组间比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结 果 2.1 蜕膜组织的组织病理学观察人工流产组蜕膜组织正常、较完整;蜕膜细胞呈多边形,胞浆丰富,核卵圆形、染色质致密(图 1A,见插页三)。药流完全组蜕膜组织形态不正常,有大量坏死组织存在;蜕膜细胞数量减少,分散;大蜕膜细胞变形坏死,核固缩,胞质空泡化,细胞之间互不相连,呈片状;蜕膜间质毛细血管扩张,血管内可见淤血(图 1B,见插页三)。药流不全组蜕膜组织形态介于正常蜕膜和药流完全组坏死的组织形态之间,蜕膜细胞多呈梭形或不规则形,数量较少、分散;蜕膜组织有不同程度的炎性细胞浸润,可见大片弥散性出血(图 1C,见插页三)。
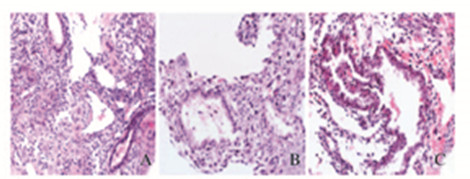
|
| A:Suergical abortion group; B:Incomplete abortion mifepristone group; C:Complete abortion mifepristone group. 图 1 各组蜕变组织 HE 染色结果(×200) Fig.1 Results of HE staining of deciduas tissue in various groups(×200) |
IL-10和IL-12阳性细胞主要分布在子宫蜕膜表面上皮、腺上皮和基质细胞;阳性颗粒位于细胞膜及细胞浆,呈棕黄色(图 2和3,见插页四)。药流组IL-10蛋白的表达水平低于人工流产组(P<0.01);药流完全组IL-10蛋白表达水平低于药流不全组(P<0.01)。药流组IL-12蛋白表达水平高于人工流产组(P<0.01);药流完全组IL-12蛋白表达水平高于药流不全组(P<0.01)。见表 1。
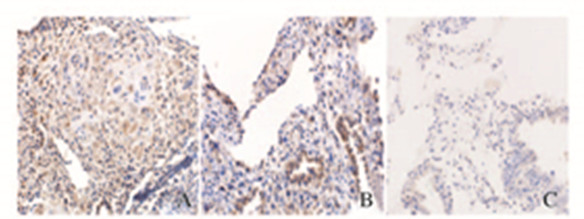
|
| A:Suergical abortion group; B:Incomplete abortion mifepristone group; C:Complete abortion mifepristone group. 图 2 各组蜕膜组织中IL-10 免疫组织化学染色结果(×200) Fig.2 Results of immunohistochemistry staining of IL-10 in deciduas tissue in various groups(×200) |
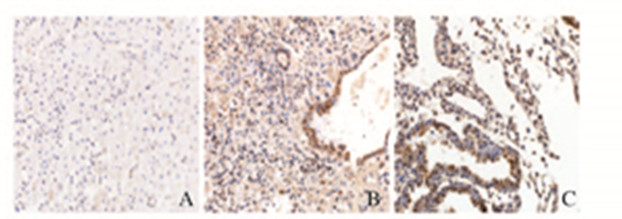
|
| A:Suergical abortion group; B:Incomplete abortion mifepristone group; C:Complete abortion mifepristone group. 图 3 各组蜕膜组织中IL-12 免疫组织化学染色结果(×200) Fig.3 Results of immunohistochemistry staining of IL-12 in deciduas tissue in various groups(×200) |
| (n=20,x±s) | ||
| Group | IL-10 | IL-12 |
| Surgical abortion | 56584.74±1 564.35 | 12 558.35±13 457.85 |
| Incomplete abortion mifepristone | 32283.45±1369.24 * | 36524.64±14328.28 * |
| Complete abortion mifepristone | 14258.29±1125.01 *△ | 58176.28±1641.24 *△ |
| * P<0.01 vs surgical abortion group; △ P<0.01 vs incomplete abortion mifepristone group. | ||
IL-10为相对分子质量19000的蛋白,IL-12为相对分子质量35000的蛋白(图 4)。Western blotting法检测结果与免疫组织化学检测结果相吻合。药流组IL-10蛋白表达水平低于人工流产组(P<0.01),药流完全组IL-10蛋白表达水平低于药流不全组(P<0.01);药流组IL-12蛋白表达水平高于人工流产组(P<0.01),药流完全组IL-12蛋白表达水平高于药流不全组。见表 2。
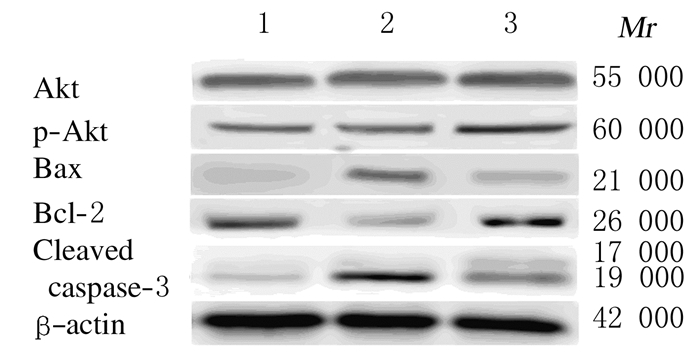
|
| Lane1:Surgical abortion group;Lane2:Incomplete abortion mifepristone group;Lane3:Complete abortion mifepristone group. 图 4 Western blotting法检测各组蜕膜组织中IL-10和IL-12蛋白表达电泳图 Fig.4 Electrophoregram of expressions of IL-10 and IL-12 in deciduas tissue in various groups detected by Western blotting method |
| (n=20,x±s) | ||
| Group | IL-10/β-actin | IL-12/β-actin |
| Surgical abortion | 1.09±0.07 | 0.42±0.04 |
| Incomplete abortion mifepristone | 0.78±0.05 * | 0.65±0.05 * |
| Complete abortion mifepristone | 0.58±0.04 *△ | 0.94±0.06 *△ |
| * P<0.01 vs surgical abortion group; △ P<0.01 vs incomplete abortion mifepristone group. | ||
米非司酮是第一个用于临床的孕激素和糖皮质激素的拮抗剂,其与孕激素受体和糖皮质激素受体均具有高亲和力,可竞争性抑制孕激素和糖皮质激素的作用,并具有抑制雌激素依赖性组织增生和抗氧化作用,目前已成为终止早、中期妊娠的主要药物。但部分患者因炎症、多次连续药物流产、人工流产和瘢痕子宫等原因而致流产不全,出现部分宫内残留而需再次行清宫术,严重影响了米非司酮的临床应用。
妊娠是一个复杂的生理过程,从免疫学角度看类似于器官移植,正常妊娠的胎儿继承的父系HLA抗原会刺激母体产生免疫排斥,但母体常表现为免疫耐受状态,这就需要在母胎界面建立一种微妙的免疫平衡。母胎界面免疫微环境是由子宫蜕膜的免疫细胞及其分泌的细胞因子组成的[3]。许多学者[4, 5, 6]发现:正常妊娠中Th1/Th2免疫反应呈现出Th2偏移现象,如果妊娠期呈现Th1偏移,将会发生流产或胎儿生长受限。
IL-10是Th2类细胞因子,是一个位于免疫调节网络中心具有免疫抑制和免疫刺激双重作用的免疫因子[7],其主要作用为免疫抑制。IL-10发挥免疫抑制功能的机制之一是通过对抗原提呈细胞,特别是对巨噬细胞和树突状细胞(dendritic cells,DCs)的抑制作用[8, 9]。小鼠模型研究[10]显示:妊娠期用提纯的外源性IL-10能够降低胚胎吸收率,而抗IL-10抗体则增加了吸收率。本研究结果显示:药流组蜕膜组织IL-10蛋白表达水平低于人工流产组,且药流不全组IL-10蛋白表达水平低于药流完全组。说明妊娠期蜕膜局部以IL-10为代表的Th2细胞因子占据优势,致使妊娠能够维持。但是行米非司酮药物流产后,米司非酮与孕激素受体结合,导致患者体内孕激素水平下降。有研究[11]表明:在小鼠体内,孕激素通过产生更多的不成熟DCs来抑制免疫反应。在培养DCs时增加孕酮含量,导致IL-10分泌量增加。低水平的孕激素使得母胎界面局部IL-10的分泌量下降,致使其抑制T细胞发生免疫应答,诱导T细胞耐受的作用下降,母胎界面的免疫耐受被打破,最终导致流产的发生[12]。而部分蜕膜细胞未受到米非司酮的影响或对米非司酮的反应不敏感,局部孕激素分泌水平未受影响或受影响程度较小,局部IL-10的分泌量下降障碍,母胎界面的免疫耐受未被完全打破,局部绒毛和/或滋养层细胞剥脱不全、残留,并伴有炎细胞浸润,最终导致流产不完全或药流失败。
IL-12是Th1型细胞因子,主要参与细胞免疫,可激发迟发型变态反应,同时能激活单核巨噬细胞、自然杀伤细胞,诱导单核细胞因子产生,参与炎性反应的发生[13, 14]。在妊娠过程中,IL-12抑制HCG的分泌、蜕膜蛋白合成,诱导滋养层细胞凋亡,直接或间接损害胎盘组织及胎儿,不利于妊娠。本研究结果显示:药流组IL-12蛋白表达水平高于人工流产组,且药流完全组IL-12蛋白表达水平高于药流不全组,说明米非司酮的作用可以促进蜕膜局部产生大量具有生物活性的IL-12,这可能促进初始T细胞分化为Th1细胞,引发免疫排斥,破坏了母胎界面免疫平衡。一方面升高的IL-12激活NK细胞,增加NK细胞毒作用[15, 16];另一方面可促使未致敏NK细胞和T细胞分泌炎性细胞因子TNF和IFN-γ,引发细胞免疫[17],导致流产。而部分蜕膜细胞未受到米非司酮的影响或对米非司酮的反应不敏感,IL-12的分泌障碍,局部的免疫平衡未被完全打破,部分绒毛和/或滋养层细胞剥脱不全、残留,导致流产不完全或药流失败。
| [1] | 孙敬霞,韩向阳.米非司酮药物流产时绒毛及蜕膜组织的形态学改变[J].中国实用妇科与产科杂志,2000,16(10):597-598. |
| [2] | Stanilov NS,Miteva LD,Dobreva ZG,et al.Monocytes expression of IL-12 related and IL-10 genes in association with development of colorectal cancer[J].Mol Biol Rep,2012,39(12):10895-10902. |
| [3] | 曹 霞,王莲莲,罗 娜.复发性自然流产育龄期妇女母-胎界面中细胞因子表达分析[J].细胞与分子免疫学杂志,2011,27(3):311-312. |
| [4] | Saito S,Nakashima A,Shima T,et al.Th1/Th2/Th17 and regulatory T-cell paradigm in pregnancy[J].J Reprod Immunol,2010,63(6):601-610. |
| [5] | Kumpel BM,Manoussaka MS.Placental immunology and maternal alloimmune responses[J].Vox Sang,2012,102(1):2-12. |
| [6] | Calleja-Agius J,Jauniaux E,Pizzey AR,et al.Investigation of systemic inflammatory response in first trimester pregnancy failure[J].Hum Reprod,2012,27(2):349-357. |
| [7] | Malfertheiner P,Schultze V,Rosenkranz B,et al.Safety and immunogenicity of an intramuscular Helicobacter pylori vaccine in noninfected volunteers:a phase Ⅰ study[J].Gastroenterology,2008,135(3):787-795. |
| [8] | Wilke CM,Wei S,Wang L,et al.Dual biological effects of the cytokines interleukin-10 and interferon-γ[J].Cancer Immunol Immunother,2011,60(11):1529-1541. |
| [9] | Fan X,Liu Z,Jin H,et al.Alterations of dendritic cells in sepsis:featured role in immunoparalysis[J].Biomed Res Int,2015,2015:903720. |
| [10] | Hackstein H,Morelli AE,Thomson AW.Designer dendritic cells for tolerance induction:guided not misguided missiles[J].Trends Immunol,2001,22(8):437-442. |
| [11] | Enninga EA,Holtan SG,Creedon DJ,et al.Immunomodulatory effects of sex hormones:requirements for pregnancy and relevance in melanoma[J].Mayo Clin Proc,2014,89(4):520-535. |
| [12] | Encabo A,Solves P,Carbonell-Uberos F,et al.The functional immaturity of dendritic cells can be relevant to increased tolerance associated with cord blood transplantation[J].Transfusion,2007,47(2):272-279. |
| [13] | Trinchieri G.Interleukin-12 and the regulation of innate resistance and adaptive immunity[J].Nat Rev Immunol,2003,3(2):133-146. |
| [14] | Liang W,Wang XF.In vitro induction of specific anti-tumoral immunity against laryngeal carcinoma by using human interleukin-12 gene-transfected dendritic cells[J].Chin Med J,2011,124(9):1357-1361. |
| [15] | Ni J,Miller M,Stojanovic A,et al.Sustained effector function of IL-12/15/18-preactivated NK cells against established tumors[J].J Exp Med,2012,209(13):2351-2365. |
| [16] | Kannan Y,Yu J,Raices RM,et al.IκBζ augments IL-12-and IL-18-mediated IFN-γ production in human NK cells[J].Blood,2011,117(10):2855-2863. |
| [17] | Sánchez B,Gueimonde M,Peña AS,et al.Intestinal microbiota as modulators of the immune system[J].J Immunol Res,2015.doi:10.1155/2015/159094. |




