扩展功能
文章信息
- 张宜春, 徐岩, 辜和平
- ZHANG Yichun, XU Yan, GU Hepin
- 脂蛋白(a)水平与VH-IVUS检测冠脉粥样硬化斑块成分的关联性分析
- Analysis on correlation between lipoprotein (a)and VH-IVUS examination of atherosclerotic plaque in patients with CHD
- 吉林大学学报(医学版), 2016, 42(01): 115-119
- Journal of Jilin University (Medicine Edition), 2016, 42(01): 115-119
- 10.13481/j.1671-587x.20160123
-
文章历史
- 收稿日期: 2015-06-05
2. 安徽医科大学附属第一医院心内科, 安徽合肥 230022
2. Department of Cardiology, First Affiliated Hospital, Anhui Medical University, Hefei 230022, China
冠心病(coronary heart disease,CHD)患者可因急性冠脉综合征(acute coronary syndrome,ACS)导致心脏急性事件发生,在临床上备受关注。大多数ACS发生是易损斑块(vulnerable plaques,VP)破裂所致,而炎症、炎症介质是促使VP破裂的关键因素[1]。及时发现VP,积极药物强化治疗或冠状动脉介入治疗(percutaneous coronary intervention,PCI),对高危CHD患者来说,具有重要的临床意义。VP检测方面,传统的灰阶血管内超声(intravascular ultrasound,IVUS)仅能提供斑块形态,不能提供斑块成分信息[2]。虚拟组织学血管内超声(virtual histology intravascular ultrasound,VH-IVUS)通过高频信号分析斑块成分,对斑块检测类似于病理学组织影像,可以客观准确地显示斑块形态学和成分性质,由此分辨斑块类型,为CHD患者治疗分层提供理论依据[3]。随着动脉粥样硬化(atherosclerosis,AS)病理生理深入研究,在AS形成过程中,以往的血清学指标及危险因素对平滑肌细胞增生和内皮功能失衡不能做出很好的解释[4]。近年来,国外学者指出:脂蛋白(a) [lipoprotein(a),Lp(a)] 是一种新的预测VP的血清学指标[5],Lp(a)是一种促炎症介质,是AS性疾病高危因素[6, 7, 8]。VH-IVUS识别VP特征与Lp(a)指标的关联性国内未见报道。本研究旨在利用VH-IVUS评估CHD患者AS斑块成分、稳定程度和Lp(a)的关系,探讨Lp(a)在斑块易损机制中作用。
1 资料与方法 1.1 病例资料2014年2月—2015年3月安徽医科大学附属安庆医院心内科收治39例CHD患者,其中男性24例,女性15例,平均年龄(59.5±9.6)岁。依据临床症状及冠状动脉造影(coronary angiography,CAG)结果分为稳定型心绞痛(stable angina pectoris,SAP)组21例,非ST段抬高型急性冠脉综合征 (non-ST elevation acute coronary syndrome,NSTEACS)组18例。NSTEACS组包括非ST段抬高型心肌梗死(non-ST elevation myocardial infarction,NSTEMI)和不稳定型心绞痛(unstable angina,UA)。另外15例因胸痛怀疑CHD 收治,CAG显示管腔未见异常者为对照组,其中男性9例,女性6例,平均年龄(57.8±9.3)岁。排除标准:①恶性肿瘤、恶性心律失常、严重瓣膜病变、主动脉夹层、心源性休克和其他重要脏器功能不全者。②慢性完全闭塞病变。③既往冠状动脉旁路移植术。入选患者予以阿司匹林肠溶片、氯吡格雷片、阿托伐他汀[9]或低分子肝素,如无禁忌证则给予β受体阻断剂、血管紧张素转化酶抑制剂/血管紧张素受体阻断剂(ACEI/ARB)。
1.2 生化指标检测采用Sysmex全自动生化分析仪测定血清Lp(a)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL)、低密度脂蛋白胆固醇(LDL)、超敏C反应蛋白(hs-CRP)和心肌坏死标记物等。
1.3 CAG及VH-IVUS检查经桡动脉路径,采用Judkins法行CAG,用目测法确定狭窄程度。对CAG所示病变狭窄≥50%的斑块行VH-IVUS (Boston Scientific Corp,iLab Ultrasound Imaging System) 检查,超声探头沿导引钢丝送入斑块远端至正常组织10mm,连续记录影像,超声探头按照1.0mm·s-1速度自动回撤至指引导管内,VH-IVUS数据用CD-ROM保存。用IVUS确定的最小管腔,记录血管径 (vessel average diameter,VAD)、管腔径 (lumen average diameter,LAD)、斑块面积(plaque area,PA)、面积狭窄率 (lumen area stenosis rate,LAS)、斑块负荷 (plaque burden,PD)、斑块偏心指数 (eccentric plaque index,EI)和血管重塑指数(vascular remodeling index,RI)。用iLab系统重建虚拟组织学图像,分析斑块体积、斑块成分面积及百分比:纤维(fibrous tissue,F;绿色标记)成分、纤维脂质(fibro-fatty,FF ;黄色标记)成分、钙化(dense calcium,DC;白色标记)成分和坏死(necrotic core,NC;红色标记)成分。VP大多表现为薄纤维帽斑块(thin cap fibro atheroma,TCFA):斑块含FF或NC>10%,纤维组织厚度≤150μm。
1.4 统计学分析采用SPSS19.0软件进行统计学分析。计量资料用几何均数和对数标准差描述,以x±s表示。经正态性检验,对于非正态分布的资料,如hs-CRP、Lp(a)等经对数转换,转换成正态分布资料后,再行方差齐性检验,方差齐的资料采用t检验,方差不齐的采用t′检验;计数资料以率表示,组间比较采用校正四格表χ2检验。Lp(a)与斑块成分、hs-CRP水平的相关性分析采用Spearman分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组受试者血清生化指标与对照组比较,SAP和NSTEACS组患者血清Lp(a)、hs-CRP和 LDL水平明显升高(P < 0.05),且NSTEACS组血清LP(a)、hs-CRP和LDL水平也高于SAP组(P < 0.05)。见表1。
| (x±s) | ||||||
| Group | n | TC[ c B/(nmol·L -1)] | HDL[ c B/(nmol·L -1)] | LDL[ c B/(nmol·L -1)] | Lp(a)[ ρ B/(mg·L -1)] | hs-CRP[ ρ B/(mg·L -1)] |
| Control | 15 | 3.96±0.78 | 1.22±0.27 | 2.18±0.56 | 166.00±87.28 | 1.37±0.87 |
| SAP | 21 | 4.25±1.29 | 1.17±0.23 | 2.67±0.78 * | 227.37±86.61 * | 2.18±0.56 * |
| NSTEACS | 18 | 4.67±1.31 | 1.24±0.56 | 2.71 ±0.84 *△ | 313.55±117.29 *△ | 2.36±0.74 *△ |
| * P<0.05 vs control group; △ P<0.05 vs SAP group. | ||||||
对CHD组(SAP和NSTEACS组)64处病变狭窄≥50%的斑块行IVUS和VH-IVUS 检查:左主干3处(4.69%),左前降支34处(53.12%),左回旋支12处(18.75%),右冠状动脉15处(23.44%)。64处病变共发现TCFA 8处,其中NSTEACS组7处(38.89%),SAP组1处(4.76%),NSTEACS组患者病变斑块TCFA发生率高于SAP组(χ2=4.9883,P=0.0149)。与SAP组比较,NSTEACS组患者病变斑块含NC和FF成分百分比增高(P < 0.05),含F成分百分比降低(P < 0.05)。见图1、2(插页三)和表2。
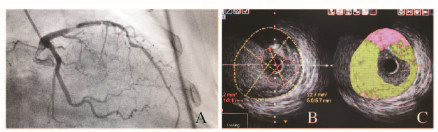
|
| 图 1 NSTEACS患者冠脉造影(A)及IVUS(B)和VH-IVUS(C)影像 Fig.1 Coronary angiogryphy (A), IVUS(B) and VH-IVUS(C) images of patients with NSTEACS |
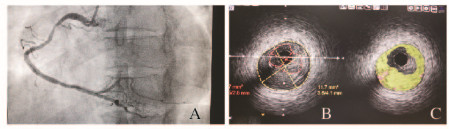
|
| 图 2 SAP患者冠脉造影(A)及IVUS(B)和VH-IVUS(C)影像 Fig.2 Coronary angiogryphy (A), IVUS(B) and VH-IVUS(C) images of patients with SAP |
| (x±s) | |||||||
| Group | n | PA( A/ mm 2) | LAS( η/%) | VAD ( d/mm) | LAD ( d/mm) | RI | EI |
| SAP | 21 | 7.57±3.84 | 59.38±14.17 | 3.86±0.64 | 2.14±0.73 | 1.27±0.59 | 1.61±0.78 |
| NSTEACS t P < /td> | 18 | 8.80±5.730.797 50.430 3 | 63.76±12.641.010 90.318 6 | 4.10±0.561.235 90.224 3 | 2.33±0.540.910 50.368 4 | 1.85±0.672.875 20.006 7 | 2.32±0.932.593 80.013 5 |
| Group | n | PD( η/%) | NC ( η/%) | DC ( η/%) | F ( η/%) | FF ( η/%) | |
| SAP | 21 | 59.22±12.63 | 11.72±8.67 | 17.76±10.15 | 56.39±15.36 | 13.97±7.87 | |
| NSTEACS t P |
18 |
64.16±13.97 1.159 6 0.253 6 |
18.63±9.95 2.318 1 0.026 1 |
14.38±8.74 1.104 4 0.276 6 |
49.39±16.14 1.386 0 0.174 0 |
18.74±6.18 2.078 9 0.044 6 |
|
Lp(a)分别与NC成分百分比、FF成分百分比、TCFA发生率和血清hs-CRP水平行Spearman相关性分析,Lp(a)与NC成分百分比、FF成分百分比、TCFA发生率和血清hs-CRP水平均呈正相关关系(r=0.411,r=0.312,r=0.318,r=0.309),差异均有统计学意义(P < 0.05)。见图3。

|
| 图 3 Lp(a) 与NC成分百分比的相关性 Fig.3 Correlation between Lp(a) and NC percentage |
Lp(a) 是一种急性应激反应蛋白,主要成分是低密度脂蛋白颗粒和载脂蛋白A1。Lp(a)通过加快血管平滑肌细胞增殖,促进其向内皮细胞迁移而加速AS进程,同时纤维蛋白溶酶原结合至内皮细胞表面的量减少,导致血浆组织型的纤溶酶原激活物活性进一步减弱,加速AS斑块进展[10]。
AS的风险随着Lp(a)水平的升高而增加[11]。本研究结果显示:CHD组患者血清Lp(a)、hs-CRP水平明显高于对照组,且NSTEACS组患者LP(a)、hs-CRP水平也高于SAP组,提示Lp(a)升高与病变斑块不稳定有关。本研究IVUS结果显示:NSTEACS组患者管腔狭窄程度、斑块负荷面积与SAP组比较差异无统计学意义,但血管斑块EI高于SPA组,且为正性重塑,表明SAP组患者血管以负性重塑为主,说明管腔的狭窄程度对急性心脏事件的预测远不如斑块的形态、成分比例和炎症反应敏感。本研究VH-IVUS结果显示:NSTEACS患者病变斑块大多不稳定,富含NC和FF成分,脂质核大,纤维帽极薄或无纤维帽;SAP患者病变斑块大多稳定,主要含F成分,脂质核小或无脂核,纤维帽厚,TCFA发生率也显著低于NSTEACS患者,说明NSTEACS患者炎症趋于活跃,可能有更多的炎症细胞、炎症介质及趋化因子刺激平滑肌细胞增殖,引起斑块体积迅速增大,同时炎性细胞释放大量溶解酶,进一步促使纤维帽破裂,形成急性血栓[12]。
本研究首次发现Lp(a)水平升高时与斑块中NC成分、FF成分、TCFA发生率和血清hs-CRP水平有良好的相关性,说明CHD患者Lp(a)水平和hs-CRP水平是伴随着斑块脂质池体积的增加而升高,也意味着病变斑块的不稳定性增加。这或许是Lp(a) 作为促炎症介质,对机体炎症机制的一种反应,同时也激活内皮载附因子致平滑肌细胞增殖[13]。Lp(a)不仅是一种促炎症介质,参与了AS斑块易损机制,还在某种程度上反映AS的严重程度[14]。在评估易损斑块方面,hs-CR不及Lp(a)敏感,这可能是Lp(a)与斑块NC的相关系数较hs-CRP相关系数更高的原因。
从某种角度上讲,VH-IVUS成像类似于病理学组织影像,为临床提供AS斑块形态学和成分性质,但基于VH-IVUS检查属于侵入性操作,加之昂贵的医疗设备和高值耗材,很难在CHD患者中普及应用。本组结果显示:NSTEACS患者Lp(a)水平高于对照组,且冠脉病变斑块不稳定随Lp(a)指标升高而增加。Lp(a)水平不受饮食、性别及其他脂蛋白的影响,在TC、TG正常的ACS患者中有独特的预测价值[8]。hs-CRP已是临床上ACS危险分层的敏感指标[15]。目前PCI己经成为高危NSTEACS患者血运重建的主流策略[16]。因此,联合检测Lp(a)和hs-CRP,方法简便、临床操作性强,在不额外增加患者医疗费用的基础上,2种方法联合运用可以早期发现VP,积极采取血运重建,以期达到心肌组织水平再灌注。本研究缺陷是样本量较少,尚需要以后进行大样本研究。
| [1] | Noto T,Kameyama T,Satoh T,et al. Association between virtual histology intravascular ultrasound findings and subsequent coronary events in patients with acute coronary syndrome[J]. Int Heart J,2015,56 (2): 157-162. |
| [2] | Kato M,Dote K,Sasaki S,et al.Presentations of acute coronary syndrome related to coronary lesion morphologies as assessed by intravascular ultrasound and optical coherence tomography[J].Int J Cardiol,2013,165 (3): 506-511. |
| [3] | Amano H,Ikeda T,Toda M,et al.Assessment of angiographic coronary calcification and plaque composition in virtual histology intravascular ultrasound[J].J Interv Cardiol,2015,28(2):205-214. |
| [4] | Prajapati J,Joshi H,Sahoo S,et al.Age-related differences of novel atherosclerotic risk factors and angiographic profile among gujarati acute coronary syndrome patients[J].J Clin Diagn Res: J Clin Diagn Res,2015,9 (6): 5-9. |
| [5] | Nave AH,Lange KS,Leonards CO,et al.Lipoprotein (a)as a risk factor for ischemic stroke: A meta-analysis[J].Atherosclerosis,2015,242(2):496-503. |
| [6] | Malaguarnera M,Vacante M,Russo C,et al.Lipoprotein (a)in cardiovascular diseases[J].Biomed Res Int,2013(1),2013:1-9. |
| [7] | Momiyama Y,Ohmori R,Fayad ZA,et al.Associations between serum lipoprotein (a)levels and the severity of coronary and aortic atherosclerosis[J].Atherosclerosis,2012,222(1):241-244. |
| [8] | Jacobson TA.Lipoprotein (a),cardiovascular disease,and contemporary management[J].Mayo Clin Proc,2013,88(11):1294-1311. |
| [9] | 李 录,侯建军,邱荣荣,等.阿托伐他汀对同型半胱氨酸作用下人脐静脉内皮细胞Bcl -2启动子区甲基化水平的影响及其抗动脉粥样硬化机制[J].吉林大学学报:医学版,2014,40(5):1002-1006. |
| [10] | Nordestgaard BG,Chapman MJ,Ray K,et al.Lipoprotein (a)as a cardiovascular risk factor;current status[J].Eur Heart J,2010,31(23):2844-2853. |
| [11] | 林小龙,何兴兰,王 佐.脂蛋白 (a)合成的调节[J].中国生物化学与分子生物学报, 2014,30(1):23-29. |
| [12] | 陈少伯,赵季红,梁国庆,等.血管内超声虚拟组织成像在冠状动脉临界病变中的应用[J].中国医学影像技术,2013,29(3):380-384. |
| [13] | 赵战芝,王 仁,张 凯,等.脂蛋白( a)对内皮祖细胞向缺血组织归巢的影响[J].中国动脉硬化杂志,2014,22(3):223-226. |
| [14] | 杨 简,涂玉林,王 佐.脂蛋白 (a)与动脉粥样硬化研究进展[J].中国动脉硬化杂志,2012,20(5):472-476. |
| [15] | Yousuf O,Mohanty BD,Martin SS,et al.High-sensitivity C reactive protein and cardiovascular disease: a resolute belief or an elusive link[J].J Am Coll Cardiol,2013,62(5):397-408. |
| [16] | Amsterdam EA,Wenger VK,Brindis RG,et al.2014 AHA/ACC guideline for the management of patients with non-ST-elevation acute coronary syndromes: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines[J].J Am Coll Cardiol,2014,64(24):2645-2687. |




