扩展功能
文章信息
- 孔文丽, 杨以良, 徐洪芹, 彭姗姗, 华瑞, 潘煜, 牛俊奇
- KONG Wenli, YANG Yiliang, XU Hongqin, PENG Shanshan, HUA Rui, PAN Yu, NIU Junqi
- 慢性丙型肝炎患者抗病毒治疗中肝功能与病毒学应答的关系
- Relationship between liver functionand virological response in patients with chronic hepatitis C during antiviral treatment
- 吉林大学学报(医学版), 2016, 42(01): 99-103
- Journal of Jilin University (Medicine Edition), 2016, 42(01): 99-103
- 10.13481/j.1671-587x.20160120
-
文章历史
- 收稿日期: 2015-05-24
丙型肝炎是一种由丙型肝炎病毒(HCV)引起的世界性传染病,全球有1.3~1.7亿人感染HCV病毒,占世界人口的2%~3%[1]。我国一般人群中抗HCV阳性率为3.2%[2]。HCV感染后近75%~85%的患者发生慢性化,5%~20%的患者在感染HCV20年内发展成肝硬化,1%~5%的患者发展为肝癌[1]。干扰素联合利巴韦林是治疗丙型肝炎公认有效的治疗方案。该方案可以抑制体内HCV的复制,减轻对肝脏的损害,改善肝功能。近年来有关抗病毒治疗中肝功能变化特点的研究较少。本研究对普通干扰素α2b(INF-α2b)联合利巴韦林抗病毒治疗的慢性丙型肝炎(chronic hepatitis C,CHC)患者肝功能变化的特点进行研究,探讨不同病毒学应答与肝功能的关系。
1 资料与方法 1.1 研究对象选择2010-2014年本科室在吉林省扶余县更新乡和德胜镇的流行病学调查中发现并确诊的CHC患者264例,其中男性193例,女性71例,平均年龄(49.8±7.9)岁;基因分型:1b型140例,2a型107例,1b/2a型5例,未分型12例。均为初治,诊断标准符合2004年《中国丙型肝炎防治指南》拟定的诊断标准[2]。排除标准:①失代偿期肝硬化患者(符合腹水、出血性静脉曲张和肝性脑病其中之一者);②同时并发慢性乙型肝炎或自身免疫性肝病的患者;③怀孕、甲状腺功能紊乱、应用放射性药物、存在心血管疾病和肿瘤等基础疾病者;④其他不符合抗病毒治疗指征者。
1.2 治疗方法INF-α2b 500万U,隔日1次皮下注射;利巴韦林15mg·kg-1,每日1次口服。疗程48周。在基线,治疗12、24、48和72周对患者HCVRNA和肝功能进行检测。
1.3 检测方法无菌条件下留取患者血清2mL。采用荧光定量逆转录聚合酶链式反应(FQ-RT-PCR)技术进行HCVRNA定量,试剂盒由德国罗氏诊断有限公司提供,型号:COBAS AmpliPrep/COBAS TaqMan,操作步骤及结果判定严格按照试剂盒说明书进行,HCVRNA定量检测正常范围为 < 15IU·mL-1。采用速率法测定肝功能,试剂及仪器均由强生公司提供,全自动生化分析仪型号为VITROS 350;肝功能检测参考值:丙氨酸氨基转移酶(ALT)0~40U·L-1,天冬氨酸氨基转移酶(AST)10~35U·L-1,总胆红素(TBIL)1.7~21.0μmol·L-1,直接胆红素(DBIL)0~6.8μmol·L-1。
1.4 疗效评价标准持续病毒学应答(SVR):治疗结束后至少随访24周血清HCVRNA定量检测低于检测限。无应答(NR):患者治疗 12 周时,HCVRNA 下降水平低于 2log10IU·mL-1,或治疗 24 周以上HCV RNA未 低于检测限。复发(relapse):指治疗结束时HCVRNA定量检测低于最低检测限,但停药后HCVRNA又变为阳性。治疗中反弹(breakthrough):治疗期间曾有HCVRNA载量降低或转阴,但尚未停药即出现HCVRNA载量上升或阳转。
1.5 统计学分析采用SPSS19.0统计软件进行统计学分析。肝功能指标采用中位数表示,组内比较采用Wilcoxon秩和检验,4组间比较采用Kruskal-Wallis检验,2组间比较采用Mann-Whitney U检验。计数资料多组间比较应用χ2检验,两组间比较采用Fisher精确概率检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 抗病毒治疗后CHC患者病毒学应答情况本研究共纳入CHC患者264例,均为初治患者,其中171例(64.8%)获得SVR,37例(14.0%)治疗中反弹,47例(17.8%)复发,9例(3.4%)无应答。
2.2 抗病毒治疗前CHC患者肝功能与病毒学应答的关系CHC患者基线时血清AST、TBIL和DBIL的异常率与SVR的获得无相关性(P>0.05)。与治疗中反弹组比较,基线ALT升高的患者更易获得SVR(P < 0.05),见表1。且统计学差异在ALT轻度升高( < 5ULN)及ALT正常组患者中尤为明显(P < 0.05),见表2。
| [n(η/%)] | |||||||||
| Variable | n | ALT | AST | TBIL | DBIL | ||||
| Normal | >40 U·L -1 | Normal | >35 U·L -1 | Normal | >21 μmol·L -1 | Normal | >35 μmol·L -1 | ||
| SVR | 171 | 46(56.1) | 125(68.7) | 46(59.0) | 125(67.2) | 96(63.6) | 75(66.4) | 111(63.1) | 60(68.2) |
| Breakthrough | 37 | 21(25.6) | 16(8.8) | 17(21.8) | 20(10.8) | 24(15.9) | 13(11.5) | 27(15.3) | 10(11.4) |
| Relapse | 47 | 14(17.1) | 33(18.1) | 13(16.7) | 34(18.3) | 25(16.6) | 22(19.5) | 32(18.2) | 15(17.0) |
| NR | 9 | 1(1.2) | 8(4.4) | 2(2.6) | 7(3.8) | 6(4.0) | 3(2.7) | 6(3.4) | 3(3.4) |
| χ 2 | 14.500 | 5.668 | 1.604 | 0.942 | |||||
| P | 0.002 * | 0.129 | 0.658 | 0.815 | |||||
| *The P value was obtained through the combination of SVR group and breakthrough group. | |||||||||
| [n(η/%)] | ||||||
| Group | ALT≤ULN | ALT<5ULN | 5ULN≤ALT<10ULN | ALT≥10ULN | χ 2 | P |
| SVRBreakthrough | 47(27.5)21(56.8) | 107(62.6)14(37.8) | 14(8.2)2(5.4) | 3(1.8)0(0.0) | 12.126 | 0.007 * |
| ULN:Upper limits of normal. *The P value was obtained through the combination of ALT≤ULN group and ALT<5ULN group. | ||||||
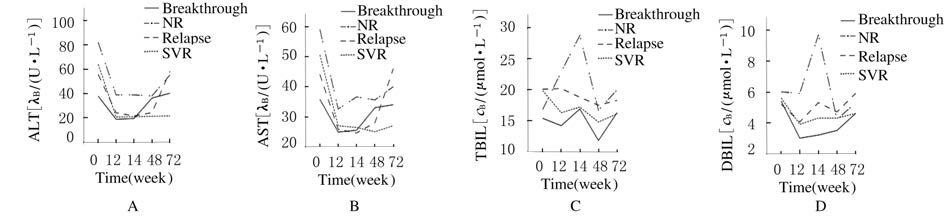
经过非参数检验,4组患者基线时血清TBIL和DBIL水平比较差异无统计学意义(P>0.05)。治疗中反弹组患者血清ALT和AST的水平明显低于SVR组、复发组及无应答组患者(P < 0.05)。SVR组、复发组与无应答组肝功能指标两两比较差异无统计学意义(P>0.05)。经抗病毒治疗,4组患者血清ALT和AST均下降,且12周时下降最明显,与治疗前比较差异有统计学意义(P < 0.05)。治疗中反弹组患者在48周时ALT和AST回升,复发组患者停药后24周时ALT和AST回升,直至停药后24周SVR组患者的ALT和AST可维持稳定。与治疗中反弹组比较,SVR组患者在12周时ALT和AST下降更明显,与治疗前比较差异有统计学意义(P < 0.05)。在抗病毒治疗过程中,无应答组患者血清ALT和AST水平始终高于SVR组、复发组和治疗中反弹组 (P < 0.05) 。与治疗前比较,SVR组患者在12周时TBIL和DBIL水平较其他时间点明显下降(P < 0.05),直至停药后24周可以维持稳定。在治疗24周时,无应答组患者血清TBIL、DBIL水平明显高于SVR组和治疗中反弹组患者(P < 0.05)。见图1。
|
| 图 1 各组患者治疗前和治疗后12、24、48、72周血清ALT(A)、AST(B)、TBIL(C)和DBIL(D)水平 Fig.1 Changes of ALT(A),AST(B),TBIL(C),and DBIL(D) levels of patients in various groups before treatment and 12,24,48,72 weeks after treatment |
干扰素联合利巴韦林是目前最有效的抗丙型肝炎病毒治疗方案,治疗终点是获得SVR。取得SVR有利于肝纤维化的缓解和逆转,降低肝癌发病率,降低肝病的病死率,改善生活质量。如何提高治疗应答率以及对疗效作出预测是近年来的研究热点。目前国内外对肝功能指标与应答关系的研究观点不一致。有研究[3, 4, 5, 6, 7, 8]表明:治疗前ALT、AST水平与SVR的实现无关,ALT正常与ALT升高的丙型肝炎患者抗病毒治疗疗效无差别,因此对于ALT正常的HCVRNA阳性患者也应积极抗病毒治疗。但也有研究[9, 10]证实:ALT升高的患者更易获得SVR。高载量无应答组患者治疗前DBIL显著高于应答者[11]。本研究显示:CHC患者基线时血清AST、TBIL和DBIL的异常率与SVR的实现无关联性;与治疗中反弹组患者比较,基线ALT轻度升高的患者比ALT正常的患者容易获得SVR;治疗中反弹组患者基线时血清ALT、AST的水平明显低于SVR组、复发组及无应答组。
干扰素可阻止病毒核酸的翻译及病毒蛋白的装配,从而抑制病毒复制,减轻肝细胞损伤,改善肝功能[12]。研究[13, 14]表明:CHC患者经过抗病毒治疗,随着HCVRNA载量的下降,ALT、AST等肝功能指标也随之下降。Gidding等[15]也报道:CHC患者抗病毒治疗后生化指标(ALT、APRI)明显好转,尤其是获得SVR的患者改善更明显。本研究结果显示:经过抗病毒治疗,4组CHC患者的血清ALT、AST水平在12周时明显下降,复发组患者、治疗中反弹组患者随着病毒的复制会再次升高,无应答组患者血清ALT、AST水平虽也有下降,但仍高于正常值上限,也高于其他3组患者,停药后会再次升高。可见,CHC患者在抗病毒治疗中,随着病毒水平的下降,除无应答组患者外,其余患者血清ALT和AST水平多数均能恢复正常,ALT和AST的再次升高往往可以反应病毒的反跳或复发。本研究结果还显示:与治疗中反弹组患者比较,获得SVR的CHC患者在抗病毒治疗12周时血清ALT和AST水平下降更明显。因此,抗病毒治疗早期转氨酶的迅速下降可能对SVR的实现有预测作用。Turbide等[16]在研究中也提出这种观点。
Mohamed 等[17, 18, 19]研究发现:在应用干扰素联合利巴韦林抗病毒治疗后CHC患者血清TBIL水平会下降,而DBIL水平变化不明显。有研究[11]报道:无病毒学应答组患者在抗病毒治疗中DBIL持续高于正常范围,TBIL明显高于高载量应答组。本研究中,SVR组患者经过抗病毒治疗血清TBIL和DBIL水平均下降;在抗病毒治疗中复发组患者血清TBIL水平也会下降,停药后略升高,但仍在正常范围,血清DBIL水平在正常范围波动,停药后24周略高于基线水平;治疗中反弹组患者在治疗过程中血清TBIL、DBIL水平在正常范围波动;无应答患者的TBIL、DBIL在24周时明显升高,治疗结束时下降,停药后会再次升高。
总之,CHC患者基线血清ALT水平轻度升高的患者治疗效果好。经过抗病毒治疗,所有患者的肝功能均有所改善,而获得SVR的患者改善更为明显。无病毒学应答患者虽病毒量未下降,但肝细胞损伤得到恢复,也能从抗病毒治疗中获益,进一步证实了抗病毒治疗的重要性。本研究中无应答组患者样本量较少,有待扩大样本进一步研究。
| [1] | Ansaldi F,Orsi A,Sticchi L,et al.Hepatitis C virus in the new era: Perspectives in epidemiology,prevention,diagnostics and predictors of response to therapy[J].World J Gastroenterol,2014,20(29):9633-9652. |
| [2] | 中华医学会肝病学分会,中华医学会传染病与寄生虫病学分会.丙型肝炎防治指南[J].中华肝脏病杂志,2004,12(4):194-198. |
| [3] | 赵 辉,谢 尧,李明慧.慢性丙型肝炎患者的血清HCV基因型和RNA含量与ALT和AST水平不相关[J].中华检验医学杂志,2007,30(6):631-634. |
| [4] | Mauss S,Hueppe D,John C, et al.Estimating the likelihood of sustained virological response in chronic hepatitis C therapy[J].J Viral Hepat,2011,18(4):e81-e90. |
| [5] | MarcianoS,Borzi SM,Dirchwolf M,et al.Pre-treatment prediction of response to peginterferon plus ribavirin in chronic hepatitis C genotype 3[J].World J Hepatol,2015,7(4): 703-709. |
| [6] | Kainuma M,Furusyo N, Azuma K,etal.Pegylated interferon α-2b plus ribavirin for Japanese chronic hepatitis C patients with normal alanine aminotransferase[J].Hepatol Res,2012,42(1): 33-41. |
| [7] | Hiramatsu N,Inoue Y,Oze T,etal.Efficacy of pegylated interferon plus ribavirin combination therapy for hepatitis C patients with normal ALT levels: a matched case-control study[J].J Gastroenterol,2011,46(11): 1335-1343. |
| [8] | Tohra SK,Taneja S,Ghosh S,et al.Prediction of sustained virological response to combination therapy with pegylated interferon alfa and ribavirin in patients with genotype 3 chronic hepatitis C[J].Dig Dis Sci,2011,56(8):2449-2455. |
| [9] | Zuberi BF,Zuberi FF,Memon SA,et al.Sustained virological response based on rapid virological response in genotype-3 chronic hepatitis C treated with standard interferon in the Pakistani population[J].World J Gastroenterol,2008,14(14):2218-2221. |
| [10] | Liu CH,Liu CJ,Lin CL, et al.Pegylated interferon-α-2a plus ribavirin for treatment-naive Asian patients with hepatitis C virus genotype 1 infection: a multicenter,randomized controlled trial[J].Clin Infect Dis,2008,47(10):1260-1269. |
| [11] | 方超萍,张薇薇,孙小波,等.丙型肝炎患者不同病毒载量与病毒学应答及肝功能改变的相关性[J].现代检验医学杂志,2012,27(5):18-21 |
| [12] | Strader DB,Wright T,Thomas DL,et al.Diagnosis,management,and treatment of hepatitis C[J].Hepatology,2004,39(4):1147-1171. |
| [13] | 黄毛山,王秋英,方玉才,等.379例HCV感染者丙型肝炎病毒载量与抗HCV及肝功能指标的相关性分析[J].中华实验和临床病毒学杂志,2014,28(4):291-293. |
| [14] | 王 盟,郑伟阳,张红宇,等.聚乙二醇干扰素α-2a与干扰素α-2a治疗慢性丙型肝炎的短期疗效分析[J].中华肝脏病杂志,2014,22(4):255-259. |
| [15] | Gidding HF,Law MG,Amin J, et al.Hepatitis C treatment outcomes in Australian clinics[J].Med J Australia,2012,196(10):633-637. |
| [16] | Turbide C,Soulellis C,Deschenes M,et al.Does a rapid decline in the hematological and biochemical parameters induced by interferon and ribavirin combination therapy for the hepatitis C virus predict a sustained viral response[J].Can J Gastroenterol,2008,22(2):149-152 |
| [17] | Mohamed AA,Amin MA,Ragab MM,et al.Protein kinase expression as a predictive factor for interferon response in chronic hepatitis C patients[J].J Adv Res,2014,5(1): 117-123. |
| [18] | 于国英,黄 群,马玉秀.慢性丙型肝炎抗病毒治疗进展[J].临床肝胆病杂志,2015,31(4):626-629. |
| [19] | 张丹丹,叶佩燕,黄玉仙,等.慢性丙型肝炎患者获得快速病毒学应答的预测因素分析[J].临床肝胆病杂志,2014,30(12):1310-1314. |
 2016, Vol. 42
2016, Vol. 42


