扩展功能
文章信息
- 王丹, 王振宇, 石光, 尹光浩
- WANG Dan, WANG Zhenyu, SHI Guang, YIN Guanghao
- TIMP-3基因真核表达载体的构建及其对乳腺癌MDA-MB-453细胞生长及侵袭的抑制作用
- Construction of eukaryotic expression vector of TIMP-3 gene and its inhibitory effect on growth and invasion of MDA-MB-453 cells
- 吉林大学学报(医学版), 2016, 42(01): 89-93
- Journal of Jilin University (Medicine Edition), 2016, 42(01): 89-93
- 10.13481/j.1671-587x.20160118
-
文章历史
- 收稿日期: 2015-05-06
基质金属蛋白酶(matrix metalloproteinases,MMPs)作为一种蛋白水解酶,可以水解细胞外基质(ECM)中的绝大部分成分。现在已陆续发现了28种MMPs,构成了MMPs超家族[1]。MMPs在正常生理过程中,参与细胞外基质的更新和重塑。而在一些病理情况下如恶性肿瘤的侵袭过程中,MMPs可以降解基底膜中的Ⅳ型胶原纤维,促进肿瘤细胞的局部侵袭,并使得肿瘤细胞通过内渗、外渗作用穿透血管,造成远处转移[2]。而组织基质金属蛋白酶抑制剂(tissue inhibitor of metalloproteinase,TIMPs)作为MMPs的天然抑制物,可以与MMPs以1∶1的比例形成复合物并进而抑制MMPs的活性[3]。目前共分离出4种TIMPs,命名为TIMP-1、TIMP-2、TIMP-3和TIMP-4。TIMP-1和TIMP-2与恶性肿瘤关系的研究较多,TIMP-3和TIMP-4与恶性肿瘤的关系正逐渐为人们所认识,尤其是TIMP-3作为唯一可以结合在细胞外基质上的TIMPs而受到关注[4]。目前关于TIMPs的研究多采用免疫组织化学染色方法,缺乏从基因调控水平上的研究,因此本文作者构建pcDNA3.1-TIMP-3真核表达载体,为进一步研究TIMP-3抑制乳腺癌早期侵袭和转移提供新的思路和方法。
1 材料与方法 1.1 细胞系、质粒和主要试剂乳腺癌细胞系MDA-MB-453购自中国科学院上海细胞生化研究所,大肠杆菌JM109由吉林大学免疫教研室惠赠。真核表达载体pcDNA3.1(+)购自美国Invitrogen公司,TA连接载体pMD18-T vector购自日本Takara公司,Trizol RNA 提取试剂盒、脂质体LipofectamineTM2000 reagent购自美国Invitrogen公司,逆转录酶、限制性内切酶、T4连接酶和Tag DNA聚合酶购自美国Clon Tech公司,DNA回收试剂盒购自美国QIAGene公司,G418购自美国Gibco公司。引物合成及测序均由上海生工生物工程有限公司完成。
1.2 TIMP-3 cDNA片段的获取根据GenBank中已知TIMP-3基因序列合成引物,上游引物为5′-AAGAATTCATGACGCCTTGGCTCGGG-3′,下游引物为5′-GGTCTAGATCAGGGGTCTGTGGCATT-3′;上游引物5′端带有EcoRⅠ酶切位点GAATTC,下游引物5′端带有XbaⅠ酶切位点TCTAGA。采用异硫氰酸胍法提自人胎盘组织中提取总RNA,经RT-PCR获得TIMP-3 cDNA片段。
1.3 重组pcDNA3.1-TIMP-3真核表达载体的构建将TIMP-3 cDNA片段电泳后全部回收,与TA克隆载体pMD18-T vector连接后,转化感受态菌JM109,以碱裂解法提取质粒,进行酶切鉴定,释放出目的DNA片段的质粒为阳性重组质粒。用EcoRⅠ、XbaI双酶切pMD18-T-TIMP3重组质粒及pcDNA3.1载体,经T4连接酶连接,转化JM109菌,筛选阳性质粒,进行酶切鉴定并经上海生工自动测序仪测序,酶切后产生TIMP-3片段并经测序检测正确的载体即为构建成功的pcDNA3.1-TIMP-3真核表达载体。
1.4 细胞培养MDA-MB-453细胞和NIH3T3细胞培养于含10%小牛血清的IMDM培养液中,置于37℃、5%CO2培养箱中。
1.5 细胞转染及鉴定按照脂质体LipofectamineTM2000 reagent说明书操作。将pcDNA-TIMP3重组载体转染入MDA-MB-453细胞,同时以转染pcDAN3.1空载体的细胞作为对照。在含有G418(100 mg·L-1)的选择性培养基中加压筛选4周,获得具有抗G418抗性的单细胞克隆,收集细胞进行Western blotting鉴定,阳性克隆进行扩增培养,用于下一步细胞功能实验。
1.6 实验分组MDA-MB-453细胞分为正常对照组、pcDNA空载体组(只转染pcDNA空载体)和pcDNA-TIMP-3组(转染pcDNA-TIMP-3)。
1.7 细胞增殖活性采用MTT法测定pcDNA组与pcDNA-TIMP-3组MDA-MB-453细胞增殖活性。各组MDA-MB-453细胞按6×104mL-1接种于96孔培养板中,每孔100μL,培养24h后,每孔分别加入10μL的MTT(5g·L-1)溶液,4h后终止培养,移除上清,加入100μL DMSO振荡10min,采用酶联免疫检测仪在490nm波长处测定各孔吸光度(A)值,以此表示细胞增殖活性[5, 6],A值越大,细胞增殖活性越强。pcDNA组与pcDNA-TIMP-3组各设6复孔。
1.8 体外侵袭实验采用Boyden小室侵袭实验,NIH3T3细胞培养液作为趋化因子,加入Boyden小室的下室。两室之间Matrige膜上分别包被不同细胞外基质成分Ⅰ型胶原(ColⅠ)、纤维连接蛋白(FN)、层黏连蛋白(LN)和玻璃连接蛋白(VN)。上室加入各组MDA-MB-453细胞悬液,含1.5×106个细胞,培养6h,显微镜下计数,每组设3个平行样本。以穿过Matrigel膜的侵袭细胞数作为判断各组MDA-MB-453细胞侵袭性的指标。
1.9 统计学分析采用SPSS 13.0统计软件进行统计学处理。各组MDA-MB-453细胞增殖活性和侵袭细胞数以x±s表示,组间比较采用t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 TIMP-3基因的扩增提取人胎盘TIMP-3总RNA,RT-PCR产物经琼脂糖凝胶电泳检测,可见1条大小约633bp的亮带,与目的基因片段大小相同,即TIMP-3 cDNA片段,以cDNA为模板再次进行PCR(巢式PCR),获得了较高含量的目的基因。见图1。
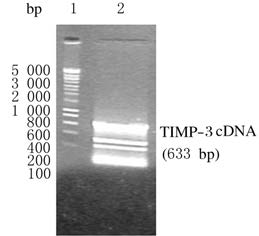
|
| Lane1:DL 2400 DNA marker; Lane 2:TIMP-3 gene product. 图 1 TIMP-3 基因RT-PCR扩增产物电泳图 Fig.1 Electrophoregram of RT-PCR amplification product of TIMP-3 gene |
pcDNA-TIMP-3重组载体经EcoRⅠ和XbaⅠ双酶切后,琼脂糖凝胶电泳可见1条大小约633bp的亮带,即TIMP-3基因片段,经测序后与GenBank序列完全相同,表明pcDNA3.1-TIMP-3重组真核表达载体构建成功。见图2。
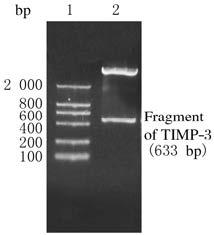
|
| Lane 1:DL 2000 DNA marker; Lane 2: pcDNA-TIMP-3. 图 2 pcDNA-TIMP-3载体经EcoRⅠ和XbaⅠ酶切鉴定电泳图 Fig.2 Electrophoregram of digestion identification of pcDNA-TIMP-3 by EcoRⅠ and XbaⅠ |
转染pcDNA-TIMP-3表达载体的MDA-MB-453细胞有高丰度的TIMP-3蛋白表达。见图3。
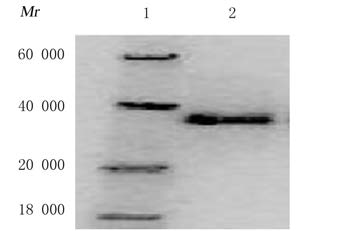
|
| Lane 1:Protein marker; Lane 2:pcDNA-TIMP-3. 图 3 Westernblotting法检测重组TIMP-3蛋白电泳图 Fig.3 Electrophoregram of TIMP-3 protein detected by Westernblottingmethod |
pcDNA-TIMP-3组细胞平均A值为0.68±0.01,pcDNA空载体组和正常对照组细胞的平均A值分别为1.09±0.04和1.12±0.08。pc-DNA-TIMP-3组细胞的增殖活性明显低pcDNA空载体组和正常对照组(P < 0.05)。
2.5 各组MDA-MB-453细胞Boyden小室体外侵袭实验结果与pcDNA空载体组和正常对照组比较,pcDNA-TIMP3组穿透以Col Ⅰ、LN、FN和VN包被的Matrigel膜的侵袭细胞数明显减少(P < 0.05)。见表1。
| Group | Number of cells penetrating matrigel membrane | |||
| Col Ⅰ | FN | LN | VN | |
| Normal control | 101.00±2.11 | 146.00±2.06 | 105.00±4.20 | 208.00±5.01 |
| pcDNA | 98.00±3.62 | 141.00±2.15 | 107.00±2.58 | 212.00±1.66 |
| pcDNA-TIMP-3 | 18.00±2.53 *△ | 24.00±1.63 *△ | 20.00±1.16 *△ | 72.00±4.35 *△ |
| * P<0.05 vs normal control group; △ P<0.05 vs pcDNA group. | ||||
乳腺癌是严重危害妇女健康的常见恶性肿瘤,其发病率呈逐年上升趋势[7]。乳腺癌的侵袭及转移造成患者较差的预后[8]。而乳腺癌细胞在侵袭、转移过程中必须突破细胞外基质等一系列自然屏障,MMPs及其抑制剂TIMPs是参与降解细胞外基质的重要酶类[9]。
有研究[10]表明:MMPs与TIMPs在恶性肿瘤中失去平衡,TIMPs无法抑制MMPs的水解活性,从而造成恶性肿瘤的侵袭和转移。目前关于TIMP-3与乳腺癌转移关系尚缺乏基因水平的研究。本研究中首次构建了TIMP-3真核表达载体,通过人为上调乳腺癌细胞TIMP-3的表达水平,观察其对乳腺癌细胞生长和侵袭的影响。
本研究采用的pcDNA3.1真核表达载体,具有巨细胞病毒强启动子CMV序列,确保目的基因的高水平表达,载体中还有双重选择标记和复制序列,在原核细胞中有氨苄抗性,在真核细胞中有新霉素抗性,更方便目的基因的筛选[11]。本研究将重组载体再经双酶切、鉴定、测序,所得到的片段与报道序列的同源性达100%,说明本研究的载体构建完全成功。
将pcDNA3.1-TIMP-3重组真核表达载体转染入MDA-MB-453细胞,并与MDA-MB-453细胞同时进行G418筛选,Western blotting法检测结果显示:原本无TIMP-3表达的MDA-MB-453细胞均稳定表达了TIMP-3。
转染TIMP-3基因后MDA-MB-453细胞的增殖活性较转染了pcDNA空载体及未转染TIMP-3基因的MDA-MB-453细胞明显减弱,表明TIMP-3表达上调后对乳腺癌细胞的生长和增殖有抑制作用。其可能机制是:①TIMP1、TIMP2、TIMP3和TIMP4的过量表达均可抑制肿瘤细胞生长[12];②TIMP-3可抑制人类成纤维细胞生长因子诱导的内皮细胞生长[13];③另外有研究[14]表明:TIMP-3的过表达可诱发数种肿瘤细胞及小鼠血管平滑肌细胞的凋亡。本研究Boyden小室侵袭实验表明:TIMP-3还可以抑制乳腺癌细胞MDA-MB-453穿透人工基底膜的能力。由于人工基底膜的主要成分是ColⅠ、FN、LN和VN,而MMP-2、MMP-9是降解这些胶原的主要酶类[15],因此本研究结果提示:MMP-2、9的活性受到TIMP-3的抑制,转染了TIMP-3基因的细胞侵袭能力有所下降。基底膜对维持BM结构的完整起重要作用,是肿瘤浸润与转移的重要屏障。转染TIMP-3基因后可望在一定程度上限制肿瘤细胞的侵袭和转移。此外还有研究[16, 17]表明:TIMP-3具有抑制肿瘤新生血管的作用。
综上所述,本研究成功获得了稳定表达TIMP-3蛋白的乳腺癌MDA-MB-453细胞系。本研究结果为进一步研究TIMP-3在乳腺癌侵袭中的作用及其机制奠定了实验基础。
| [1] | D'addazio G, Artese L,Piccirilli M,et al. Role of matrix metalloproteinases in radicular cysts and periapical granulomas[J].Minerva Stomatol,2014,63(11/12):411-420. |
| [2] | Kim GE,Lee JS,Choi YD,et al.Expression of matrix metalloproteinases and their inhibitors in different immunohistochemical-based molecular subtypes of breast cancer[J].BMC Cancer,2014,14:959. |
| [3] | Suarez-Roa ML,Asbun-Bojalil J,Ruiz-Godoy LM,et al.Immunoexpression of matrix metalloproteinases and their inhibitors in different areas of oral squamous cell carcinoma[J].Aust Dent J,2012,57(3):300-307. |
| [4] | Kornfeld JW,Meder S,Wohlberg M,et al.Overexpression of TACE and TIMP3 mRNA in head and neck cancer:association with tumour development and progression[J].Br J Cancer, 2011,104(1):138-145. |
| [5] | Liu Ww,Liu Y,Liang S,et al.Hypoxia and radiation-induced overexpression of Smac by an adenoviral vector and its effects on cell cycle and apoptosis in MDA-MB-231 human breast cancer cells[J].Exp Ther Med,2013,6(6):1560-1564. |
| [6] | Li Y,Guo C,Wang Z,et al.Enhanced effects of TRAIL-endostatin-based double-gene-radiotherapy on suppressing growth,promoting apoptosis and inducing cell cycle arrest in vascular endothelial cells[J].J Huazhong Med Sci,2012,32(2):167-172. |
| [7] | 尉承泽,江泽飞.乳腺癌治疗基本原则和临床选择[J].中国实用外科杂志,2009,29(9):774-776. |
| [8] | 刘政红.乳腺癌早期筛查临床意义探讨[J].当代医学,2011,17(33):154-155. |
| [9] | 范松青,魏启幼,李美容,等.基质金属蛋白酶及其抑制剂在乳腺癌中的表达及其临床意义[J].癌症,2003,22(9):968-973. |
| [10] | Murphy G.Tissue inhibitors of metalloproteinases[J].Genome Biol,2011,12(11): 233-236. |
| [11] | 陈培生,邓三花,王伟飞,等.重组质粒pcDNA3.1/SurP/Trail 联合吉西他滨诱导胰腺癌细胞凋亡的实验研究[J].胃肠病和肝病学杂志,2015,24(1):72-74. |
| [12] | 陶国权.TIMP在结直肠癌中的作用及其调控机制研究[J].中国普通外科杂志,2013,12(5):1341-1345. |
| [13] | Guan Z,Zhang J,Song S,et al.Promoter methylation and expression of TIMP3 gene in gastric cancer[J].Diagn Pathol,2013,8:110. |
| [14] | Hassan ZK,Elamin MH,Daghestani MH,et al.Oleuropein induces anti-metastatic effects in breast cancer[J].Cancer Prev,2012,13(9):4555-4559. |
| [15] | Babykutty S,Suboj P,Srinivas P,et al.Insidious role of nitric oxide in migration /invasion of colon cancer cells by upregulating MMP-2/9 via activation of cGMP-PKG-ERK signaling pathways[J].Clin Exp Metastasis,2012,29(5):471-492. |
| [16] | Das AM,Seynhaeve AL,Rens JA,et al.Differential TIMP3 expression affects tumor progression and angiogenesis in melanomas through regulation of directionally persistent endothelial cell migration[J].Angiogenesis,2014,17(1):163-177. |
| [17] | 张 莹,李青艳,崔泽实,等.TSG101与HIF-1α在乳腺癌组织中的表达及意义[J].中国实用内科杂志,2014,34(增1):96-98. |




