扩展功能
文章信息
- 杨擎, 隋欣, 王宝森, 于智莘, 朱凯, 律广富, 王建玮, 闫文昊, 张慧媛, 林嘉楠, 刘英娜, 李娜, 曲晓波
- YANG Qing, SUI Xin, WANG Baosen, YU Zhixin, ZHU Kai, LYU Guangfu, WANG Jianwei, YAN Wenhao, ZHANG Huiyuan, LIN Jianan, LIU Yingna, LI Na, QU Xiaobo
- 五味子乙素对谷氨酸诱导SH-SY5Y细胞损伤的保护作用及其机制
- Protective effect of schizandra B on injury of SH-SY5Y cells induced by Glu and its mechanim
- 吉林大学学报(医学版), 2016, 42(01): 80-84
- Journal of Jilin University (Medicine Edition), 2016, 42(01): 80-84
- 10.13481/j.1671-587x.20160116
-
文章历史
- 收稿日期: 2015-09-30
阿尔茨海默病(Alzheimer’s disease,AD)是一种常见的神经退行性病变,是老年痴呆常见原因,主要表现为认知障碍、记忆丧失和沟通不良等[1]。谷氨酸(glutamic,Glu)在AD等神经退行性疾病中起着重要的作用,能引起神经兴奋性毒性,导致神经细胞内分解代谢酶活性增加[2],引起氧化损伤和DNA损伤[3, 4]。DNA损伤后可引发ATR信号途径,导致下游因子CHK1和Cdc25c磷酸化反应,诱导细胞周期阻滞。
在《神农本草经》记载中,将五味子[Schisandra Chinensis (Turcz.) Baill.]列为上品,其中主要有效活性成分为 五味子乙素(schizandraB,Sch B)[5],Sch B能保护神经细胞氧化损伤,增强线粒体功能和结构的完整性[6]。有研究[7, 8]显示:Sch B对神经系统具有保护作用,能减轻神经细胞DNA损伤。但Sch B 对Glu致神经细胞损伤的保护作用及对ATR信号通路的调节机制尚未见报道。现代研究[9]表明:SH-SY5Y细胞的形态和生理功能均与正常神经细胞相似,被广泛用于神经退行性疾病方面研究 。本研究旨在探讨Sch B对Glu致SH-SY5Y细胞损伤的保护作用及对ATR信号通路调控的影响。
1 材料与方法 1.1 细胞和主要试剂SH-SY5Y细胞由吉林大学基础医学院药理实验室提供。Glu购于生工试剂公司。Sch B购于上海源叶生物科技有限公司,Sch B用二甲基亚砜(DMSO)溶解配制成100 mol·L-1 浓缩液,-20℃保存,使用时用1640培养液稀释配制成所需浓度工作液。四甲基偶氮唑盐(MTT)购于美国Amresco公司,RPMI-1640购于美国Corning公司,胎牛血清购于美国Gibco公司,β-actin、ATR、p-CHK1、p-Cdc25c和P53试剂盒购于美国Proteintech公司,山羊抗小鼠抗体、山羊抗兔抗体和BCIP/NBT碱性磷酸酯酶显色试剂盒购于北京康为世纪生物科技有限公司。
1.2 细胞培养与分组将SH-SY5Y细胞用RPMI-1640培养基(10%胎牛血清,0.5%庆大霉素,1%两性B霉素)放入含有5%CO2、37℃培养箱中培养。2d换液1次,3~4d传代1次,待细胞处于对数生长期进行实验及相关检测。SH-SY5Y细胞分为对照组、DMSO组、模型组、Sch B1组、Sch B2组和Sch B3组。细胞接种24h后,DMSO组给予17mmol·L-1DMSO,Sch B1、Sch B2和Sch B3组分别给予0.05、0.10 和1.00 μmol·L-1Sch B预处理24h后,除对照组和DMSO组外,均给予20 mmol·L-1 Glu[10]继续孵育细胞24h,消化收集细胞测定各项指标。
1.3 MTT法测定细胞存活率SH-SY5Y细胞以每孔4×104 mL-1接种于96孔板中,每组细胞8复孔,培养结束前4h每孔加入20μL MTT,培养结束后吸去培养液,每孔加入150μL DMSO,震荡10 min后,使结晶完全溶解,在495nm波长下测定吸光度(A)值。对照组细胞存活率设为100%, 计算其余各组细胞存活率 ,细胞存活率=(各实验组A值/对照组A值)×100% 。
1.4 流式细胞术测定细胞周期SH -SY5Y 细胞以6×104 mL-1浓度接种于6孔板中,按照上述方法处理后胰酶消化收集,再用PBS洗2~3次,每组细胞加入1 mL预冷75%乙醇,-20℃冰箱内过夜,1 000 g离心5 min,1 mL预冷PBS洗涤,用碘化丙啶染色液后上机检测。
1.5 Western blotting法检测ATR信号通路相关蛋白表达细胞经上述方法处理后胰酶消化收集,提取蛋白用考马斯亮蓝法进行蛋白定量。进行SDS-PAGE垂直电泳,然后电转至PVDF膜上。转膜后用TBST清洗膜3次,每次5 min,脱脂奶粉封闭1h,再用TBST洗膜。将膜放入稀释好的β-actin(1∶20 000稀释)、ATR(1∶1000稀释)、p-CHK1(1∶500稀释)、p-Cdc25c(1∶500稀释)和P53(1∶500稀释)中,4℃孵育过夜,在二抗(1∶2 000稀释)中室温孵育1h,TBST洗膜,在NBT/BCIP显色液中避光显色,用凝胶成像分析系统测定灰度值,各组蛋白表达强度=实验组灰度值/对照组灰度值,进行半定量分析。
1.6 统计学分析利用SPSS11.0统计软件进行统计学分析。各组SH-SY5Y细胞存活率、细胞周期中各期细胞所占百分比和ATR信号通路相关蛋白表达水平均以x±s表示,多组间样本均数比较采用单因素方差分析,两组间比较采用SNK-q法检验。以P<0.05为差异有统计学意义。
2 结 果 2.1 各组SH-SY5Y细胞存活率与对照组比较,DMSO组细胞存活率无明显变化(P>0.05) ,模型组SH-SY5Y细胞存活率明显降低(P<0.05);与模型组比较,Sch B1 、Sch B2和Sch B3组细胞存活率均升高(P<0.05或P<0.01)。其中Sch B2组细胞存活率最高,选取Sch B2组(0.10 μmol·L-1 Sch B+ 20 mmol·L-1 Glu)作为Sch B组进行以下实验相关指标检测。见表 1。
| (n=8,x±s,η/%) | ||
| Group | Dose(μmol·L-1) | Survival rate |
| *P<0.05 compared with control group;△ P<0.05,△△P<0.01 compared with model group. | ||
| Control | 0.00 | 100.00±0.00 |
| DMSO | 0.00 | 97.78±8.82 |
| Model | 0.00 | 68.80±6.10* |
| Sch B1 | 0.05 | 79.69±6.52△ |
| Sch B2 | 0.10 | 91.22±3.35△△ |
| Sch B3 | 1.00 | 82.01±3.35△ |
与对照组比较,模型组G0/G1期细胞所占百分比降低(P<0.05);与模型组比较,Sch B组G0/G1期细胞所占百分比明显升高(P<0.05),提示对照组和Sch B组细胞均处于静止期,对照组细胞较模型组细胞稳定。与对照组比较,模型组S期和G2/M期细胞所占百分比明显升高(P<0.05),提示出现了细胞周期阻滞;与模型组比较,Sch B组S期和G2/M期细胞所占百分比明显降低 (P<0.05)。见图 1和表 2。
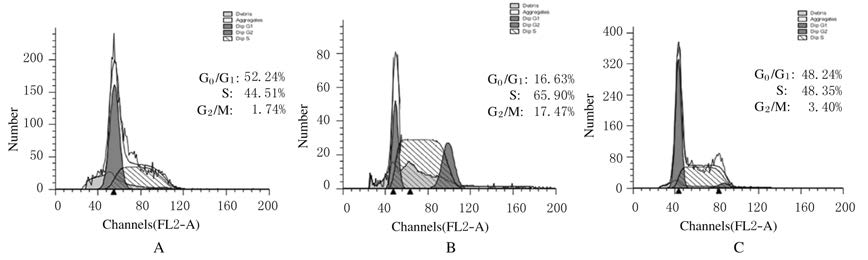
|
| A:Control group;B:Model group;C:SchB group. 图 1 各组SH-SY5Y细胞不同细胞周期流式细胞术检测结果 Fig.1 FCM results of Cell cycle of SH-SY5Y cells in various groups |
| (n=3,x±s,η/%) | |||
| Group | Percentage of SH-SY5Y cells | ||
| G 0/G 1 | S | G 2/M | |
| *P<0.05 compared with control group;△P<0.05 compared with model group. | |||
| Control | 52.24±0.25 | 44.51±0.27 | 1.74±0.09 |
| Model | 16.63±0.14* | 65.90±0.32* | 17.47±0.19* |
| Sch B | 48.24±1.42△ | 48.35±1.17△ | 3.40±0.05△ |
与对照组比较,模型组ATR、p-CHK1、p-Cdc25c和P53蛋白的表达水平均明显 增加(P<0.05);与模型组比较,Sch B组ATR、p-CHK1、p-Cdc25c和P53蛋白的表达水平均明显降低(P<0.05)。见图 2和表 3。

|
| Lane 1:Control group;Lane 2:Model group;Lane 3:Sch B group. 图 2 各组SH-SY5Y细胞ATR信号通路相关蛋白表达电泳图 Fig.2 Electrophoregram of expressions of ATR signaling pathway related proteins in SH-SY5Y cells in various groups |
| (n=3,x±s) | |||||
| Group | Dose(μmol·L-1) | ATR | p-CHK1(ser317) | p-Cdc25c(ser216) | P53 |
| *P<0.05 compared with control group;△P<0.05 compared with model group. | |||||
| Control | 0.0 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 |
| Model | 0.0 | 1.29±0.05* | 1.10±0.09* | 1.17±0.06* | 1.15±0.11* |
| Sch B | 0.1 | 1.05±0.03△ | 1.03±0.07△ | 0.97±0.02△ | 0.96±0.09△ |
Glu作为一种兴奋型氨基酸能引起神经兴奋性毒性,诱导神经元损伤,Glu神经毒性损伤是AD神经退行性疾病产生的重要因素。研究[11, 12]表明:Sch B对损伤后的神经细胞具有保护作用。本研究结果显示:Sch B作用于Glu致损伤SH-SY5Y细胞后细胞存活率明显升高,提示Sch B对Glu诱导的SH-SY5Y细胞损伤具有保护作用。高浓度Glu产生过多自由基导致DNA损伤,DNA损伤后可在G0/G1期、S期和G2/M期3个检查点进行DNA修复,如果不能及时修复将会进一步导致细胞周期阻滞或凋亡。本研究结果显示: SH-SY5Y细胞经 Sch B预保护后G0/G1期细胞百分比升高,S期和G2/M期细胞百分比均降低,提示Sch B可能抑制Glu致损伤的SH-SY5Y细胞在S期和G2/M 期的细胞周期阻滞。
ATR是DNA损伤早期信号传导重要的感受因子,DNA损伤诱导ATR被激活,ATR蛋白激酶识别DNA损伤引起的DNA双链断裂,并进行DNA修复,同时ATR诱发下游细胞因子磷酸化。CHK1作为ATR重要的下游靶点,是ATR信号通路下游检测点,参与ATR信号通路的调节,ATR信号传导使CHK1 Ser317位点磷酸化而激活,磷酸化的CHK1(p-CHK1)诱导细胞在S和G2/M期周期延迟或阻滞,进而促使下游因子Cdc25c蛋白的磷酸化(p-Cdc25c),使细胞在G2/M 期阻滞[13]。p-CHK1可激活P53蛋白,当损伤严重时,依赖P53的凋亡反应被启动,引起细胞凋亡[14],同时ATR也能直接激活P53蛋白,使细胞滞留在S期和G2/M期[15]。本实验结果显示:Sch B预保护后 SH-SY5Y细胞中 ATR蛋白表达减少,下游p-CHK1(ser317)、p-Cdc25c(ser216)和P53相关因子表达减少,提示Sch B可能通过抑制ATR信号通路的传导及下游因子的激活,减轻细胞周期阻滞,从而降低Glu诱导的SH-SY5Y细胞DNA损伤。
综上所述,Sch B通过抑制ATR信号通路活性,调节S期和G2/M期细胞阻滞,对Glu致 SH-SY5Y细胞损伤起到保护作用,本研究结果为Sch B在AD退行性病中作用的研究提供了理论依据。
| [1] | Zussy C,Brureau A,Keller E,et al.Alzheimer's disease related markers,cellular toxicity and behavioral deficits induced six weeks after oligomeric amyloid-β peptide injection in rats[J].PLoS One,2013,8(1):e53117. |
| [2] | Xu MF,Xiong YY,Liu JK,et al.Asiatic acid,a pentacyclic triterpene in centella asiatica,attenuates glutamate-induced cognitive deficits in mice and apoptosis in SH-SY5Y cells[J].Acta Pharmacol Sinica,2012,33(5):578-587. |
| [3] | Pivovarova NB,Andrews SB.Calcium-dependent mitochondrial function and dysfunction in neurons[J].FEBS J,2010,277(18):3622-3636. |
| [4] | 黄丹华,周珊珊.氧化应激与阿尔茨海默病[J].国际神经病学神经外科学杂志,2012,39(3):268-270. |
| [5] | 王佳丽,杨洪涛.五味子主要化学成分的药理研究[J].河南中医,2014,34(2):357-359. |
| [6] | Chiu PY,Lam PY,Yan CW,et al.Schisandrin B protects against solar irradiation-induced oxidative injury in BJ human fibroblasts[J].Fitoterapia,2011,82(4):682-691. |
| [7] | Liu W,Xu ZF.Research progress on antioxidants against neurotoxicity induced by methylmercury[J].Chin J Ind Med,2011,24(4):276-279. |
| [8] | Zou Q,Yan MM,Cha YH,et al.Protective effect and probable mechanism of schisandrin B on PC12 cells[J].Herald Med,2013,32(8):1010-1014. |
| [9] | 冯 波,王 蓉,盛树力.神经退行性疾病研究中拟神经细胞模型:人神经母细胞瘤株SH-SY5Y的来源特性及应用[J].中国临床康复,2006,10(6):121-123. |
| [10] | Nampoothiri M,Reddy ND,John J,et al.Insulin blocks glutamate-induced neurotoxicity in differentiated SH-SY5Y neuronal cells[J].Behav Neurol,2014,2014:674164.doi:/10.1155/2014/674164. |
| [11] | 邹 琼,严明敏,查运红,等.五味子乙素保护神经细胞作用及其可能机制[J].医药导报,2013,32(8):1010-1014. |
| [12] | 梁 婧,侯海燕,兰晓霞,等.五味子乙素的药理作用及其分子机制的研究进展[J].中国现代应用药学,2014,31(4):506-510. |
| [13] | 孙 佳,李胜范,郑丽丽.ATM/ATR在DNA损伤反应中的作用[J].中华临床医师杂志:电子版,2011,5(6):1683-1686. |
| [14] | Brooks CL,Gu W.New insights into p53 activation[J].Cell Res,2010,20(6):614-621. |
| [15] | Zilfou JT,Lowe SW.Tumor suppressive functions of p53[J].Cold Spring Harb Perspect Biol,2009,1(5):a001883. |




