扩展功能
文章信息
- 母传贤, 刘国玲
- MU Chuanxian, LIU Guoling
- 昆明山海棠对胶原性关节炎大鼠免疫功能的干预作用及其机制
- Intervention effect of tripterygium hypoglaucum hutch on immune function of rats with collagen induced arthritis and its mechanism
- 吉林大学学报(医学版), 2016, 42(01): 64-69
- Journal of Jilin University (Medicine Edition), 2016, 42(01): 64-69
- 10.13481/j.1671-587x.20160113
-
文章历史
- 收稿日期: 2015-04-09
2. 商丘医学高等专科学校生物化学与分子生物学教研室, 河南商丘 476100
2. Department of Biochemistryand Molecular Biology, Shangqiu Medical College, Shangqiu 476100, China
类风湿关节炎(rheumatoid arthritis,RA)是一自身免疫性疾病,是由炎症反应引起患者机体纤维组织和肉芽增生,从而引起关节腔内血液供应严重受损导致关节畸形和功能障碍。RA发病原因复杂,至今尚无定论,但大量实验证实炎症反应和免疫应答在RA的发生、发展中起着关键性的作用。昆明山海棠(Tripterygium hypoglaucum hutch,THH)是一种传统中草药,属卫矛科植物,其药理作用主要是抗炎、调节免疫和抗肿瘤等 [1],可通过抑制细胞免疫、体液免疫等多个环节对机体的免疫功能产生影响[2],THH应用于RA治疗已被证实有确切疗效[3, 4],但其作用机制目前尚不明确。本实验在成功地建立胶原性关节(collagen -induced arthritis,CIA) 大鼠模型的基础上,观察 THH对CIA大鼠的治疗作用,探讨其对CIA大鼠治疗的可能机制,为临床使用THH治疗RA提供新的实验依据。
1 材料与方法 1.1 实验动物、药物、主要试剂和仪器Sprague-Dawley (SD) 大鼠50只,雌雄各半,体质量(180±20)g,购自郑州大学医学院实验动物中心,动物许可证号:SCXK(豫)2012-0007。THH,滇虹药业集团玉溪生物制药有限公司,规格:0.28 g×100片,批号:国药准字Z53021643。 地塞米松盐酸注射液(5mg/mL)购自湖北天药药业股份有限公司,多聚赖氨酸、鸡Ⅱ型胶原(chicken type Ⅱ collagen,CⅡ)和弗氏完全佐剂购自美国Sigma公司,胎牛血清(FBS) 、脂多糖(LPS)、 IgG抗体测定试剂盒和刀豆蛋白A (Con A) 购自美国Invitrogen公司,噻唑蓝 (MTT)、二甲基亚砜 (DMSO) 均为北京华迈科生物技术有限公司产品,RPMI-1640培养基为美国Gibco公司产品,小牛血清由北京中生瑞泰科技有限公司提供,白细胞介素23(IL-23)、肿瘤坏死因子α (TNF-α)、白细胞介素12(IL-12)和抗CⅡ抗体检测试剂盒由杭州四季青生物材料研究所提供。 YJ-1450型医学净化工作台购自苏州净化设备公司,Napco-6100型二氧化碳培养箱由美国杜邦公司提供,EL30型酶标仪购于美国Bio-Tek公司。
1.2 方 法SD大鼠50只,随机分为正常组(n=10)和CIA模型制备组(n=40)。造模方法如下:无菌条件下,CⅡ15 mg溶于0.1mol·L-1醋酸7.5mL中,于4℃过夜充分溶解。次日,与等体积弗氏完全佐剂于冰浴中充分乳化,混匀,制成稳定的乳化剂,置4℃冰箱保存备用。在造模组大鼠的左后肢足跖皮内皮下注射0.1 mL乳化剂致炎,第7天在大鼠尾、背多点皮下注射 0.1 mL 该胶原乳剂作为激发注射。正常组大鼠在同一部位同样方法注射等剂量生理盐水。造模后36只大鼠左足红肿明显,体积增大,说明造模成功,成功率为90%。将造模成功的36只大鼠随机分为模型组、地塞米松组及200和400 mg·kg-1THH干预组,每组9只。THH干预组大鼠于造模后第7~35天分别灌胃给予200和400 mg·kg-1THH ,每天1次;地塞米松组大鼠灌胃给予0.08 mg·kg-1地塞米松,每天1次;正常组和模型组大鼠灌胃给予2 mL·kg-1生理盐水,每天1次。
1.3 一般情况观察实验期间观察各组大鼠进食量、饮水、毛发、体质量、活动状况、精神状态和踝趾关节等一般情况变化。
1.4 足肿胀度和关节炎指数(AI)测量用自制足容积测定仪分别于给药前及给药后不同时间测量各组大鼠左足肿胀度。AI评分方法:分别于并与造模第1 天、造模最后1 d 和治疗最后1 d 根据大鼠踝关节、跖趾关节、趾关节红肿程度和受影响关节数进行AI 评分,具体标准按5级评分法评价[5]。
1.5 血清抗CⅡ抗体测定[6]致炎后35d,腹腔注射3%巴比妥那麻醉大鼠,腹腔取血,分离血清,进行CⅡ特异性抗体检测。CⅡ用PBS稀释为400 mg·L-1,于96孔酶标板每孔加入100μL,密封。4℃冰箱孵育过夜。洗3遍后,每孔加入200μL封闭液,室温下封闭1~2h。清洗后,每孔加入100μL样品(封闭液稀释)。密封平板,37℃孵育1h。用羊抗大鼠IgG-HRP检测血清中抗CⅡ抗体,在室温放置1h。底物(TMB )显色0.5h后,加入终止液( 1 mol·L-1H2SO4 )。采用酶标仪测其吸光度(A)值,结果以每组A值的均值表示。
1.6 MTT法检测脾T和B淋巴细胞增殖反应[2]致炎后35d,无菌常规制备脾淋巴细胞悬液,台盼蓝染液进行活细胞计算大于95%,调整细胞浓度至终浓度为1×10-6mL-1;用含体积分数为10%的RPMI-1640培养液培养细胞,按每孔 100μL接种于96孔细胞培养板,给予100μL ConA(5g·L-1)和LPS(5g·L-1) 分别刺激T和B淋巴细胞,另设不给予ConA和LPS刺激的自身空白对照孔,每个样品每实验点设3复孔。37℃、5%CO2培养44h;每孔加入20μLMTT(5g·L-1),继续培养至48h,终止培养,吸弃培养液,每孔加入DMSO200μL终止反应,振荡摇匀。酶标仪检测波长570nm处A值。
1.7 脾组织中IL-23、TNF-α和IL-12水平测定取300 mg脾脏加入冷生理盐水0.9 mL和无水乙醇0.1 mL,匀浆,4℃、3500 r·min-1离心15 min;取上清液,按试剂盒说明检测细胞因子IL-23、TNF-α和IL-12水平。
1.8 组织病理学检查3%巴比妥那麻醉处死大鼠,取大鼠足跖部位的组织,用4%甲醛及时固定,石蜡包埋,切片,HE染色,光镜下观察各组大鼠足组织病理形态学改变。
1.9 统计学分析采用SPSS11.9统计学软件进行统计学处理。各组大鼠体质量、AI、脾T细胞和B细胞增殖活性、血清抗CⅡ抗体均水平和脾组织中IL-12、IL-23及TNF-α水平均以x±s 表示,组间比较采用单因素方差分析。 以ɑ=0.05为检验水准。
2 结 果 2.1 各组大鼠一般情况实验过程中,模型组大鼠于造模后第7天表现食欲下降、活动减少、皮毛无光泽,并伴有轻微脱毛、精神倦怠,体质量增长缓慢,甚至减轻,消瘦明显,与正常组大鼠比较差异有统计学意义(P<0.01);400 mg·kg-1THH干预组和地塞米松组大鼠给药14 d后体质量的减轻受到明显抑制,与模型组比较差异有统计学意义(P<0.01),而200 mg·kg-1THH干预组与模型组比较差异无统计学意义(P>0.05)。见表 1。
| (x±s,m/g) | |||||||
| Group | n | Body weight | |||||
| ( t/d) 0 | 7 | 14 | 21 | 28 | 35 | ||
| P<0.01 compared with normal group;△P<0.01 compared with model group. | |||||||
| Normal | 10 | 161.2±4.8 | 167.4±3.0 | 178.9±5.4 | 189.4±3.6 | 199.6±3.1 | 216.8±5.8 |
| Model | 9 | 156.7±3.5 | 162.8±2.7* | 166.3±2.1* | 171.8±3.4* | 179.3±2.4* | 185.7±3.2* |
| Dexamethasone | 9 | 160.8±5.1 | 166.7±3.6 | 176.4±3.5△ | 183.5±5.0△ | 191.3±4.5△ | 215.3±4.6△ |
| THH(mg·kg-1) | |||||||
| 200 | 9 | 162.3±2.4 | 165.4±4.5 | 170.0±5.2 | 174.2±2.2 | 180.4±3.7 | 186.5±3.8 |
| 400 | 9 | 150.6±2.7 | 155.8±3.9 | 169.4±4.3△ | 176.8±4.5△ | 188.8±5.4△ | 212.4±3.7△ |
致炎数小时后,模型组大鼠关节红肿;第7天激发注射后,踝趾关节红肿且表面皮肤发亮充血,足垫增厚,关节炎症状逐渐加重;第 35天模型组大鼠活动量减少,出现负重困难。与模型组比较,THH干预组大鼠第2周无明显变化,第3周后 400 mg·kg-1THH 干预组和地塞米松组大鼠关节肿胀得到缓解,关节红肿、皮肤发亮充血及趾尖出血点等现象逐渐减轻,大鼠足爪肿胀明显减轻(P<0.01),而200 mg·kg-1THH 干预组大鼠无明显变化(P>0.05)。见表 2。
| (x±s,V/mL) | ||||||||
| Group | n | Degree of paw swelling | ||||||
| ( t/d) 7 | 14 | 18 | 22 | 26 | 30 | 35 | ||
| *P<0.01 compared with normal group;△P<0.01 compared with model group. | ||||||||
| Normal | 10 | 0.061±0.018 | 0.066±0.021 | 0.071±0.031 | 0.098±0.030 | 0.109±0.045 | 0.128±0.034 | 0.131± 0.037 |
| Model | 9 | 0.185±0.024 | 0.187±0.029* | 0.228±0.059* | 0.279±0.034* | 0.349±0.041* | 0.389±0.048* | 0.398±0.045* |
| Dexamethasone | 9 | 0.188±0.045 | 0.160±0.034 | 0.196±0.037△ | 0.208±0.051△ | 0.224±0.041△ | 0.300±0.037△ | 0.233±0.019△ |
| THH(mg·kg-1) 200 | 9 | 0.187±0.024 | 0.171±0.045 | 0.220±0.034 | 0.268±0.045 | 0.278±0.044 | 0.284±0.022 | 0.315±0.043 |
| 400 | 9 | 0.190±0.042 | 0.162±0.025 | 0.192±0.052△ | 0.208±0.042△ | 0.220±0.041△ | 0.228±0.044△ | 0.230±0.051△ |
与正常组比较,模型组大鼠从致炎后第 14天开始AI明显增高(P<0.01);与模型组比较,400 mg·kg-1THH 干预组和地塞米松组大鼠22d后足肿胀程度明显下降,关节炎症状明显减轻,大鼠行动灵活性增加,AI明显降低(P<0.01),而200 mg·kg-1THH干预组大鼠无明显变化(P>0.05)。见表 3。
| (x±s) | ||||||||
| Group | n | AI | ||||||
| ( t/d) 7 | 14 | 18 | 22 | 26 | 30 | 35 | ||
| P<0.01 compared with normal group;△P<0.01 compared with model group. | ||||||||
| Normal | 10 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Model | 9 | 0.22±0.12 | 3.50±0.45* | 6.41±0.71* | 7.32±0.64* | 6.37±0.75* | 4.75±0.37* | 4.36±0.32* |
| Dexamethasone | 9 | 0.23±0.16 | 3.71±0.49 | 4.62±0.51 | 5.21±0.37△ | 5.06±0.54△ | 3.52±0.37△ | 2.80±0.34△ |
| THH(mg·kg-1) | ||||||||
| 200 | 9 | 0.25±0.18 | 3.40±0.43 | 5.41±0.42 | 7.23±0.34 | 5.70±0.44 | 4.68±0.68 | 4.21±0.59 |
| 400 | 9 | 0.23±0.20 | 3.82±0.49 | 4.91±0.50 | 5.20±0.64△ | 4.31±0.25△ | 3.60±0.27△ | 2.91±0.37△ |
与正常组比较,模型组大鼠脾T淋巴细胞和脾B 淋巴细胞增殖活性明显升高 (P<0.01);与模型组比较,400 mg·kg-1THH干预组和地塞米松组大鼠T淋巴细胞和B淋巴细胞增殖活性明显降低(P<0.01), 200 mg·kg-1THH干预组无明显变化(P>0.05)。见表 4。
| (x±s) | ||||
| Group | n | T cellactivity | B cellactivity | Anti-CⅡ IgG antibody |
| P<0.01 compared with normal group;△P<0.01 compared with model group. | ||||
| Normal | 10 | 0.598±0.021 | 0.231±0.019 | 0.608±0.024 |
| Model | 9 | 0.712±0.018* | 0.458±0.019* | 0.769±0.031* |
| Dexamethasone | 9 | 0.615±0.019△ | 0.359±0.024△ | 0.671±0.040△ |
| THH(mg·kg-1) | ||||
| 200 | 9 | 0.708±0.029 | 0.436±0.018 | 0.746±0.015 |
| 400 | 9 | 0.619±0.021△ | 0.341±0.014△ | 0.698±0.011△ |
与正常组比较,模型组大鼠血清中抗CⅡ抗体水平升高 (P<0.01);与模型组比较,400 mg·kg-1THH干预组和地塞米松组大鼠血清抗CⅡ抗体水平明显下降(P<0.01),200 mg·kg-1THH干预组无明显变化(P>0.05)。见表 4。
2.6 各组大鼠脾组织IL-23、TNF-α和IL-12水平与正常组比较,模型组大鼠脾组织IL-23、TNF-α和IL-12水平明显升高(P<0.01);与模型组比较, 400 mg·kg-1THH干预组和地塞米松组大鼠脾组织IL-23、TNF-α和IL-12水平均明显降低 (P<0.01),200 mg·kg-1THH干预组无明显变化(P>0.05)。见表 5。
| [x±s,ρB/(μg·L-1)] | ||||
| Group | n | IL-23 | TNF-α | IL-12 |
| *P<0.01 compared with normal group;△P<0.01 compared with model group. | ||||
| Normal | 10 | 75.32±19.06 | 91.36±20.58 | 152.82±12.15 |
| Model | 9 | 134.04±41.201* | 134.60±19.08* | 250.11±19.64* |
| Dexamethasone | 9 | 76.34±20.25△ | 93.07±30.34△ | 176.32±20.46△ |
| THH (mg·kg-1) | ||||
| 200 | 9 | 131.31±20.54 | 133.38±19.51 | 248.53±30.15 |
| 400 | 9 | 78.32±18.02△ | 94.31±15.06△ | 179.31±18.04△ |
与正常组比较,模型组大鼠足爪皮下组织细胞排列不规则,存在严重的炎性细胞浸润和血管增生现象;与模型组比较, 400 mg·kg-1THH干预组和地塞米松组大鼠足爪皮下组织病理学变化明显改善, 200 mg·kg-1THH干预组大鼠足爪皮下组织病理学无明显变化(图 1,见插页三)。
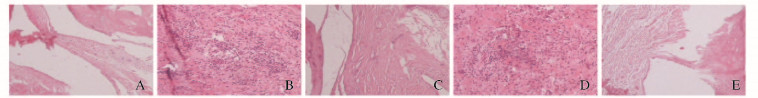
|
| 图 1 各组大鼠足爪皮下组织病理学(HE,×400) Fig.1 Pathology of paw tissue of rats in various groups (HE,×400) A:Control group;B: Model group;C:Dexamethasone group;D:200 mg·kg-1 THH group;E: 400·kg-1 THH group. |
RA是一种慢性全身性免疫性疾病,具有全身炎症反应等特点[7]。而CIA大鼠模型不仅在细胞免疫,而且在体液免疫方面更接近于人类RA,因此CIA模型是筛选和研究治疗RA药物的理想模型[8]。本实验在采用CⅡ成功建立CIA大鼠模型的基础上研究发现:模型组大鼠逐渐出现精神倦怠、活动减少、食欲下降、体质量减轻和明显消瘦等现象;200 mg·kg-1THH治疗后,大鼠一般状况与模型组比较无明显改善,而400 mg·kg-1THH治疗后,与模型组比较,大鼠活动灵敏性增加,食欲明显增强,消瘦程度明显减轻,体质量亦明显增加,AI明显下降,大鼠的精神状况得到显著改善,表明THH(400 mg·kg-1)对CIA关节炎大鼠有一定的治疗效果。THH为卫矛科雷公藤属植物,不良反应较小,具有抗炎、抗肿瘤等作用[9, 10, 11]。唐瑛等[12]报道: THH胶囊具有抗炎和免疫凋节作用,且对大鼠佐剂关节炎(adjuvant arthritis,AA)有明显的预防和治疗作用。目前在临床上也已用于治疗RA,治疗效果显著,但其作用机制尚不十分明确。
关于RA的病因研究至今尚无确切结论,但大量研究表明免疫和炎症反应在RA发生、发展中起越来越重要的作用。RA是一种典型的多因素诱发的自身免疫反应性疾病,刘春芳等[13, 14]研究发现:在RA的发病中,活化的T淋巴细胞起重要作用。陈尹等[15]亦证实:CIA大鼠体内T淋巴细胞免疫功能失调,Th1、Th2间比例失衡,在抗原特异性T细胞的辅助下,刺激B细胞产生抗体。B淋巴细胞的主要功能是接受外来抗原刺激,增殖、发育为分泌抗体的浆细胞,并继而产生抗体,是体液免疫的基础。本研究结果显示:400 mg·kg-1THH不但可明显抑制CIA大鼠T淋巴细胞的增殖活性,还可降低CIA 大鼠B淋巴细胞增殖反应,提示THH可通过抑制体液免疫而对CIA大鼠起到治疗作用。
炎症因子是RA发病的又一重要因素,而IL-23、TNF-α和IL-12作为体内主要炎性细胞因子,起着重要的致病作用。IL-23是新发现的一种炎性细胞因子,许建中等[16]报道:RA患者滑膜组织中IL-23p19mRNA、蛋白表达水平增高显著。Parham等[17]报道:自然杀伤细胞(NK)作为机体重要的免疫细胞(IL-23R),表面有IL-23受体,IL-23通过结合NK细胞膜表面IL-23R复合物,刺激细胞内信号传导系统(如Jak2、sTAT3)诱导NK细胞激活,活化的NK细胞不仅可合成和分泌TNF-α、IL-12和IL-37等多种细胞因子,也可直接刺激CD4+T细胞激活分泌IL-17。TNF-α在调控全身炎症和免疫中起着极其重要的作用,不仅具有诱导炎症、酶的释放、纤维细胞增生及组织损伤,而且还是破骨细胞的活化因子,能引起骨和软骨的吸收破坏,促进成纤维细胞增生[18]。IL-12主要是由T、B淋巴细胞和单核-巨噬细胞产生一种细胞炎症因子,可促进T淋巴细胞IFN-γ的产生,抑制IL-10、IL-11等的合成,还可直接促进B淋巴细胞增生、分化,分泌自身抗体,诱导自身免疫性疾病发生[19] 。本研究显示:400 mg·kg-1THH能明显抑制脾脏中IL-23、TNF-α和IL-12等细胞因子的产生,说明THH对CIA的治疗还与其改善异常的细胞免疫功能有关。
综上所述,THH可明显改变大鼠一般状况,改善大鼠关节组织病理学变化,明显降低关节AI,缓解相关症状,其机制可能与其抑制增高的T和B淋巴细胞增殖反应,调节CIA大鼠的免疫功能降低体内炎性细胞因子分泌等有关。
| [1] | 王丽君,石莉萍.龙牙楤木多糖的提取及含量测定[J].中药材,2006,29(10):1085-1087. |
| [2] | 韩 锐.抗癌药物研究与实验技术[M].北京:北京医科大学·中国协和医科大学联合出版社,1997:297-305. |
| [3] | Dhaouadi T,Sfar I,Abelmoula L,et al. Role of immune system,apoptosis and angiogenesis in pathogenesis of rheumatoid arthritis and joint destruction,a systematic review[J].Tunis Med,2007,85(12):991-998. |
| [4] | Derk CT.Rheumatoid arthritis: an update[J].Del Med J,2005,77(2):59-63. |
| [5] | 邹惠美,张 帆,张国英,等.类风湿性关节炎大鼠模型在昆明山海棠作用下关节炎指数的评分改变[J].中外医学研究,2014,12(23):14-15. |
| [6] | Jin Y,Li J,Zhang YF,et al.The therapeutic action of actarit in type Ⅱ collagen-induced arthritis miceand its mechanism[J].Chin Pharm,2001,36(12):814-817. |
| [7] | Li X,Yuan FL,Lu WG,et al.The role of interleukin-17 in mediating joint destruction in rheumatoid arthritis[J].Biochem Biophys Res Commun,2010,397(2):131-135. |
| [8] | 朱 蕾,魏 伟.白芍总苷对大鼠胶原性关节炎及其免疫功能的影响[J].中国药学杂志,2007,42 (20):1547-1551. |
| [9] | 黄耀峰,沈雪松,顾生玖,等.雷公藤和昆明山海棠化学成分相似性分析[J].安徽农业科学,2009, 37(13): 5961-5963. |
| [10] | 张 帆,邹惠美,崔道林,等.昆明山海棠对CIA大鼠IL-6、IL-17及IFN-γ含量的影响[J].中外医学研究, 2014,12(13):138-139. |
| [11] | 伍小波,罗先钦,徐嘉红.昆明山海棠治疗大鼠肾毒血清型肾炎的实验研究[J].西南农业大学学报:自然科学版, 2006, 28(4):636-639. |
| [12] | 唐 瑛,陈大军,郑有顺.昆明山海棠胶囊对大鼠佐剂性关节炎T淋巴细胞的影响[J].中国中医骨伤杂志,2004,12(1):7-9. |
| [13] | Yocum DE.T cell:pathogenic cells and therapeutic targets in rheu1matoid arthritis[J].Sem Arthritis Rheum,1999,29(1):27-35. |
| [14] | 刘春芳,林 娜,贾红伟,等.雷公藤甲素对Ⅱ型胶原诱导性关节炎小鼠免疫功能的影响[J].中国中医药信息杂志,2004,11(7):602-604. |
| [15] | 陈 尹,魏 伟,吴 虹,等.木瓜苷对佐剂性关节炎大鼠血清抗体水平的下调作用[J].中国药理学通报,2007,23(7):941-944. |
| [16] | 许建中,张晓强,刘占举.白细胞介素-23在类风湿关节炎滑膜中的表达及意义[J].中华风湿病学杂志,2007,11(2):96-98. |
| [17] | Parham C,Chirica M,Timans J,et al.A receptor for the heterodimeric cytokine IL-23 is composed of IL-12R beta 1 and a novel cytokine receptor subunit,IL-23R[J].J Immunol,2002,168(11):5699-5708. |
| [18] | Acock DJ,Banquerigo ML,Brahn E.Angiogenesis inhibition suppresses collagen arthritis[J].J Exp Med,1992,175(4):1135-1137. |
| [19] | van Schaardenburg D,Breedveld FC.Elderly-onset rheumatoid arthritis[J].Rheum Clin Dis North Am,1994,23(6):367-378. |




