扩展功能
文章信息
- 邵敏, 王新颖, 刘星, 王燕, 周鹤峰, 葛正龙
- SHAO Min, WANG Xinying, LIU Xing, WANG Yan, ZHOU Hefeng, CE Zhenglong
- hISO基因原核表达载体的构建及其在大肠杆菌中的表达及鉴定
- Construction of prokaryotic expression vector of hISO gene and its expression in E.coli and identification
- 吉林大学学报(医学版), 2016, 42(01): 59-63
- Journal of Jilin University (Medicine Edition), 2016, 42(01): 59-63
- 10.13481/j.1671-587x.20160112
-
文章历史
- 收稿日期: 2015-06-15
2. 遵义医学院生物化学教研室, 贵州遵义563003
2. Department of Biochemistry, Zunyi Medical University, Zunyi 563003, China
麦芽糖酶和葡萄糖化酶(maltase-glucoamylase,MGAM)复合体、蔗糖酶和异麦芽糖酶(sucrase-isomaltase,SI) 复合体均属于α-葡萄糖苷酶(α-glucosidase),人体当中的这4种α-葡萄糖苷酶均具有水解α-1,4糖苷键的作用,其中SI 复合体的N端还具有水解α-1,6糖苷键的作用,SI 复合体在肠道中的胰蛋白酶的作用下分解为蔗糖酶和异麦芽糖酶(isomaltase,ISO)而发挥作用[1, 2]。 随着人们生活水平的提高,糖尿病的发病率逐年上升,预计2030年全球患病人数将达到5.52亿[3]。多项调查研究[4, 5, 6]表明:如果血糖不能有效控制,将对血管、神经等多个系统造成损害,产生多种并发症。碳水化合物必需经过α-葡萄糖苷酶水解生成单糖之后才能被小肠吸收,因此抑制α-葡萄糖苷酶的活性,对于降低餐后血糖有重要意义。目前,化学合成的α-葡萄糖苷酶抑制剂如阿卡波糖、伏格列波糖等药物在临床上应用广泛,但制备工艺复杂且都存在一定的不良反应[7],许多天然α-葡萄糖苷酶抑制剂也有大量研究[8, 9],但材料来源相对有限。 本研究在体外获得双糖水解酶人异麦芽糖酶(hISO)基因,构建原核表达载体pET-28a(+)-hISO,通过在大肠杆菌中表达得到hISO蛋白,为今后以其为抗原,采用免疫手段得到抗体,通过抑制hISO活性而控制餐后血糖奠定实验基础。
1 材料与方法 1.1 细胞、菌种、质粒和主要试剂Caco-2细胞、pET-28a(+)表达载体、大肠杆菌E.coli BL21(DE3)和DH5α由本实验室保存。Trizol 试剂(美国Invitrogen 公司),高保真Taq DNA聚合酶和DNA胶回收试剂盒(上海生工),T4DNA连接酶、DNA marker、PrimeScript One Step RT-PCR Kit Ver.2、限制性核酸内切酶NheⅠ和NotⅠ(日本Takara公司),蛋白质相对分子质量标准(美国Thermo公司),Ni-NAT预装柱( 英国GE公司),Anti-SI抗体(ab84977,英国Abcam公司)。引物由上海英俊生物技术有限公司合成。
1.2 引物设计根据GenBank 公布的序列(NCBI Reference Sequence: NM_001041.3)为参考,设计ISO基因的特异性PCR引物,引物设计如下:上游引物5′- CTAGCTAGC ACACCCAATCGTTTCCGGTTCAAG-3′ (下划线部分 为NheⅠ酶切位点),下游引物5′- TATGCGGC CGC AGGAGTAATAAGTAATGCAGGGCCCCA -3′ (下划线部分为NotⅠ酶切位点)。
1.3 Caco-2细胞总RNA的提取复苏冻存的Caco-2细胞,用含10%胎牛血清的DMEM,37℃、5% CO2条件下培养,待细胞铺满瓶80%时用胰蛋白酶消化收集细胞,用Trizol 试剂提取总RNA,具体方法参照说明书进行,提取后的总RNA经琼脂糖凝胶电泳并拍照,若电泳结果显示28S、18S和5S条带清晰完整,说明总RNA较完整,无拖尾和降解现象,符合后续实验要求。
1.4 ISO目的基因的扩增Caco-2类似小肠上皮细胞模型[10],以Caco-2细胞总RNA为模版,按照逆转录试剂盒说明书操作进行,以一步RT-PCR扩增目的基因。PCR反应体系为:模版RNA 1μL,PrimeScript 1 Step Enzyme Mix 2μL,2×1 Step Buffer 25μL,上游和下游引物各2μL,补充RNase Free dH2O至50μL。扩增条件:50℃、30min;94℃、2 min,94℃、30s,60℃、30s,72℃、2min,25个循环;72℃延伸6min。扩增后的产物进行琼脂糖凝胶电泳并拍照,理论上应获得大小为1770bp左右的ISO基因片段。
1.5 重组表达载体的构建、筛选及鉴定参照文献[11]进行并略作改动。将pET-28a(+)表达载体的质粒和电泳后回收的扩增产物分别用NheⅠ和NotⅠ双酶切,在T4DNA连接酶的作用下,16℃连接18 h,将连接产物转化感受态细胞DH5α,涂布于含有卡那霉素的平板上进行抗性筛选,过夜培养后平板上可见单菌落,挑取多个阳性克隆提取质粒进行PCR扩增及NheⅠ和NotⅠ双酶切鉴定,由于ISO基因大小为1770bp,pET-28a(+)片段为5304bp,故经NheⅠ和NotⅠ双酶切应产生2个条带,若使用单酶切后得到大小为7074bp片段。酶切鉴定正确的重组质粒送上海立菲生物技术有限公司测序,将测序后的结果与GenBank中已公布的序列通过Vector NTI软件进行比对,序列完全正确的重组质粒命名为pET-28a(+) -hISO。
1.6 pET-28a(+) -hISO转化和诱导表达将测序鉴定正确的重组质粒pET-28a(+)-hISO转化大肠杆菌BL21(DE3)感受态细胞,挑取卡那霉素平板上生长的单菌落37℃摇床上振荡培养,至对数生长期A600为 0.5~0.6,加入异丙基硫代半乳糖苷(IPTG)至终浓度为1mmol·L-1,分别在0、2、3、4和5h不同时间下诱导表达后收集菌体,PBS洗涤后,加入Tris-NaCl缓冲液超声破碎裂解菌体,收集上清,进行SDS-PAGE电泳,检测分析hISO融合蛋白(相对分子质量68860)的诱导表达情况。
1.7 pET-28a(+) -hISO融合蛋白的纯化鉴定融合蛋白纯化采用Ni-NAT柱亲和层析,参照说明书进行,用分别含10、20、40、60、80、100和200 mmol·L-1咪唑的缓冲液进行阶段洗脱,流速为2mL·min-1,收集各阶段洗脱峰,进行SDS-PAGE电泳检测ISO融合蛋白相对分子质量和纯度。
1.8 融合蛋白的Western blotting分析纯化后的融合蛋白经SDS-PAGE电泳后,半干法转移至PVDF膜上,5%脱脂奶粉室温封闭1 h,TBST洗膜后加入SI抗体(ab84977),4℃过夜,TBST洗涤3次,二抗室温孵育1 h,TBST洗膜,ECL显色并拍照,若显色后条带单一且大小为69 000左右,说明纯化的蛋白是ISO融合蛋白,并且没有降解。
2 结 果 2.1 Caco-2细胞总RNA提取的Caco-2细胞的总RNA见图 1,无拖尾和降解现象,28S、18S和5S条带完整清晰,经紫外分光光度计检测纯度符合要求,可以用于模板扩增目的片段。
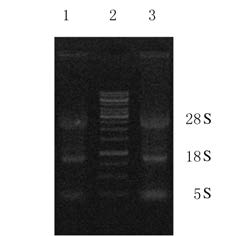
|
| Lane 1,3: Total RNA of Caco-2 cells;Lane 2:DL10000 DNA marker. 图 1 Caco-2细胞的总RNA琼脂糖凝胶电泳图 Fig.1 Agarose gel electrophoregram of total RNA from Caco-2 cells |
以所提取的Caco-2细胞总RNA为模板进行RT-PCR扩增,经琼脂糖凝胶电泳检测,得到大小为1770bp片段,与预期大小相一致。见图 2。
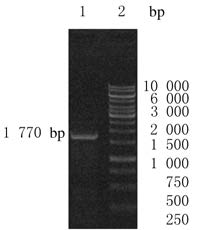
|
| Lane 1: hISO;Lane 2: DL10 000 DNA marker. 图 2 hISO 基因RT-PCR 产物 Fig.2 RT-PCR products of hISO gene |
将在抗性平板上生长的单菌落随机挑取多个进行摇菌培养,提取重组质粒进行PCR扩增目的基因,均有目的条带。将质粒DNA用NheⅠ和NotⅠ双酶切,得到目的片段(大小1 770bp)和酶切后的pET-28a(+)(大小5 304bp),使用单酶切后得到大小为7 074bp片段,见图 3。将测序后的结果与GenBank中已公布的序列进行比对,部分测序及比对结果见图 4和5,证明载体pET-28a(+) -hISO构建成功。

|
| Lane 1: Plasmid digested by double-enzyme;Lane 2: DL10000 DNA marker;Lane 3: Plasmid digested by single -enzyme. 图 3 pET-28a(+)-hISO 的酶切鉴定 Fig.3 Identification of recombinant plasmid pET-28a(+)-hISO by enzyme digestion |
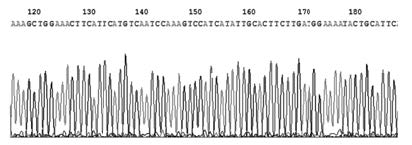
|
| 图 4 pET-28a(+)-hISO 的部分测序结果 Fig.4 DNA partial sequencing of pET-28a(+)-hISO |

|
| 图 5 pET-28a(+)-hISO重组载体插入片段部分比对图 Fig.5 Part of sequencing figure of inserted fragment of pET-28a(+)-hISO |
在0、2、3、 4和5h不同的诱导时间下IPTG诱导蛋白的表达,与蛋白质相对分子质量标准进行比对, pET-28a(+)-hISO经诱导后产生相对分子质量约为69000的蛋白,与预期hISO蛋白大小 (68860)相一致。经SDS-PAGE电泳检测分析诱导表达情况,随着诱导时间增加,所获得的融合蛋白的表达水平逐渐升高,在诱导4 h后得到的蛋白表达水平最高。见图 6。
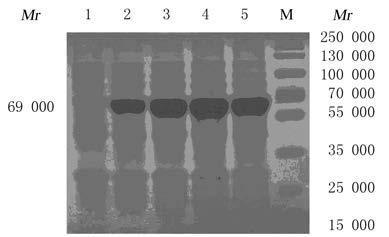
|
| Lane 1-5: Total protein of recombinant strains at 0,2,3,4 and 5 h after induction;M: Protein marker. 图 6 ISO融合蛋白SDS-PAGE电泳图 Fig.6 SDS-PAGE electrophoregram of ISO fusion protein |
将裂解后的上清经Ni-NAT柱亲和层析纯化,结果见图 7。在不同咪唑浓度下的洗脱峰,纯化后的融合蛋白在相对分子质量69 000附近条带较单一且清晰,在清洗液中无目的蛋白,说明融合蛋白与Ni柱完全吸附。经10、20、40、60、80、100和200 mmol·L-1咪唑缓冲液进行阶段洗脱,随着咪唑缓冲液浓度的增加,洗脱后得到的蛋白浓度也逐渐增加,在40和60 mmol·L-1咪唑缓冲液洗脱后能够得到浓度和纯度相对较高的蛋白,在100、200 mmol·L-1咪唑缓冲液下未见目的条带,说明蛋白完全洗脱。
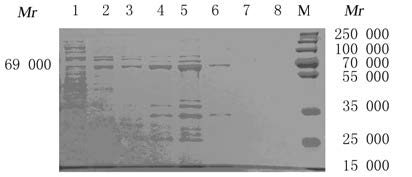
|
| Lane 1:Washing fluid;Lane 2-8:Elution buffer containing 10,20,40,60,80,100 and 200 mmol·L-1 imidazole;M:Protein marker. 图 7 融合蛋白纯化的SDS-PAGE分析 Fig.7 SDS-PAGE analysis of purification of fusion protein |
亲和层析纯化的hISO重组蛋白,经SDS-PAGE电泳,转PVDF膜,ECL发光显色后,在69 000处出现单一的目的条带(预期大小为68 860),表明重组的融合蛋白能够与抗SI抗体发生特异性结合反应,获得了ISO融合蛋白。见图 8。
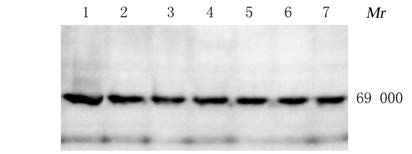
|
| Lane 1-7:hISO fusion protein. 图 8 Western blotting法检测hISO蛋白 Fig.8 hISO protein detected by Western blotting method |
α-葡萄糖苷酶抑制剂是目前治疗糖尿病的口服降糖药物中一类,因其研究相对比较成熟,所以在临床上使用广泛,其可以竞争性抑制位于小肠的各种α-葡萄糖苷酶,使摄入的淀粉类物质水解成为单糖的速度减慢,从而延缓单糖吸收达到降低餐后血糖的目的。
本研究采用RT-PCR法以Caco-2细胞的总RNA为模板,扩增得到hISO部分基因序列,将其克隆到pET-28a(+)原核表达载体中,体外表达获得融合蛋白hISO。由于pET系统表达重组蛋白功能强大,同时宿主大肠杆菌生长迅速,培养成本相对低廉,可以大量培养,pET-28a(+)中含有T7强启动子[12],因此目的基因可以高水平转录,含有的6×His标签使其可以采用Ni-NAT柱亲和层析纯化融合蛋白。在纯化融合蛋白过程中,由于有文献报道BL21(DE3)的融合蛋白多以包涵体的形式存在,需要使用尿素等变性剂将其溶解并进行复性处理,操作繁琐且蛋白质活性容易受到影响[13, 14]。本研究直接用超声裂解处理的菌体离心上清中纯化得到可溶性蛋白,而并未处理沉淀中的包涵体,这种方式相对简单,且获得的融合蛋白足够满足后续实验的需要。
在后续实验中要使用融合蛋白作为免疫原免疫产蛋鸡获得卵黄抗体。有研究[15]表明:带有标签的融合蛋白在后续实验中进行抗体制备时并不受His标签蛋白影响。本研究通过克隆hISO的部分序列,体外表达融合蛋白,并准备以其为抗原制备卵黄抗体用于降低餐后血糖,该实验为进一步探索在2型糖尿病治疗中针对α-葡萄糖苷酶靶向抑制作用的研究奠定了基础。
| [1] | Lee BH,Eskandari R,Jones K,et al. Modulation of starch digestion for slow glucose release through "toggling" of activities of mucosal α-glucosidases[J].J Biol Chem,2012,287(38):31929-31938. |
| [2] | Rodríguez D,Ramsay AJ,Quesada V,et al.Functional analysis of sucrase-isomaltase mutations from chronic lymphocytic leukemia patients[J].Hum Mol Genet,2013,22(11):2273-2282. |
| [3] | 陈 锐,聂海洋,陈锦英,等.糖尿病肾病机制的中西医研究进展[J].中国老年学杂志,2014,34(22):6515-6517. |
| [4] | Kiadaliri AA,Gerdtham UG,Eliasson B,et al.Health utilities of type 2 diabetes-related complications: a cross-sectional study in Sweden[J].Int J Environ Res Public Health,2014,11(5):4939-4952. |
| [5] | Sinharay K,Paul UK,Bhattacharyya AK,et al.Prevalence of diabetic foot ulcers in newly diagnosed diabetes mellitus patients[J].J Indian Med Assoc,2012,110(9):608-611. |
| [6] | Skrepnek GH,Armstrong DG,Mills JL.Open bypass and endovascular procedures among diabetic foot ulcer cases in the United States from 2001 to 2010[J].J Vasc Surg,2014,60(5):1255-1264 |
| [7] | 王 谦,张 璐,边晓丽,等.α-葡萄糖苷酶抑制剂及构效关系的研究进展[J].中国新药杂志,2014,23(2):189-195. |
| [8] | Striegel L,Kang B,Pilkenton SJ,et al.Effect of lack tea and black tea pomace polyphenols on α-glucosidase and α-amylase inhibition,relevant to type 2 diabetes prevention[J].Front Nutr,2015,2(3):1-6. |
| [9] | Wubshet SG,Moresco HH,Tahtah Y,et al.High-resolution bioactivity profiling combined with HPLC-HRMS-SPE-NMR: α-Glucosidase inhibitors and acetylated ellagic acid rhamnosides from Myrcia palustris DC.(Myrtaceae)[J].Phytochemistry,2015,116:246-252. |
| [10] | Cheng MW,Chegeni M,Kim KH,et al.Different sucrose-isomaltase response of Caco-2 cells to glucose and maltose suggests dietary maltose sensing[J].J Clin Biochem Nutr,2014,54(1):55-60 |
| [11] | 郝 峰,王 皓,许会静,等.anoctamin 1在中国仓鼠卵巢细胞中的表达及其离子通道特性[J].吉林大学学报:医学版,2014,40(6):1226-1231. |
| [12] | 田灵芝,徐美娟,饶志明.一株重组大肠杆菌/pET-28a-lpgad 的构建及其高效生产γ-氨基丁酸转化条件的优化[J].生物工程学报,2012,28(1): 65-75. |
| [13] | Kim MJ,Park HS,Seo KH,et al.Complete solubilization and purification of recombinant human growth hormone produced in Escherichia coli[J].PLoS One,2013,8(2):e56168. |
| [14] | 苏雅拉图,张永胜,陈宇杰,等.重组小鼠IFN-β原核表达载体的构建及包涵体溶解条件的筛选[J].吉林大学学报:医学版,2013,39(4):841-846. |
| [15] | 钟 洁,陈乐然,刘 洋,等.可介导多药耐药的cfr基因的原核表达及多克隆抗体的制备[J].中国兽医科学,2014,44(10):1060-1065. |




