扩展功能
文章信息
- 黎萍, 郑百红, 陈鹏, 许忠, 张磊, 潘薇
- LI Ping, ZHENG Baihong, CHEN Peng, XU Zhong, ZHANG Lei, PAN Wei
- 硒对病毒性心肌炎小鼠心肌细胞凋亡的抑制作用及其作用机制
- Inhibitory effect of selenium on apoptosis of myocardial cells in mice with viral myocarditis and its mechanism
- 吉林大学学报(医学版), 2016, 42(01): 54-58
- Journal of Jilin University (Medicine Edition), 2016, 42(01): 54-58
- 10.13481/j.1671-587x.20160111
-
文章历史
- 收稿日期: 2015-06-22
病毒性心肌炎(viral myocarditis,VMC)是小儿常见的心血管疾病,柯萨奇病毒B组病毒(coxsackie virus B,CVB)是一种嗜心肌病毒,占VMC病原体的50%以上[1]。CVB可通过免疫损失、氧化损伤等机制导致心肌细胞凋亡,使心肌细胞功能受损,参与VMC的发病[2]。 CVB中以具有嗜心肌性的柯萨奇B3病毒(CVB3)致病性最强。研究[3]表明:CVB病毒感染可通过PI3K途径导致Akt的磷酸化,使得PI3K-Akt信号通路失活,增加被感染心肌细胞的凋亡。本课题组的前期临床研究[4]表明:硒可通过抑制脂质过氧化反应保护VMC患儿的心肌。研究[5, 6, 7]表明:硒具有抗氧化、抗凋亡的作用,对缺血性心脏病、心肌肥大等均具有保护作用。硒是否对VMC具有抗心肌细胞凋亡作用,进而抑制VMC的发病,其作用与PI3K-Akt信号传导通路中Akt激活及其下游靶基因编码的Bax和Bcl-2蛋白关系如何,目前尚未见报道。本研究通过建立VMC小鼠模型,观察了硒减轻CVB3所致的心肌细胞凋亡的作用,以及其对PI3K-Akt信号通路活化及其下游Bcl-2和Bax蛋白表达水平的影响。
1 材料与方法 1.1 病 毒CVB3的Nancy株由吉林大学基础医学院微生物学教研室惠赠。病毒的半数组织感染量(50% tissue culture infective dose,TCID50)为100/0.1 mL,-80℃保存备用。
1.2 药品及主要试剂亚硒酸钠片为北京曙光药业有限责任公司生产,维生素C为东北制药集团沈阳第一制药有限公司生产。MTT试剂盒和 TUNEL试剂盒购自上海碧云天公司,胎牛血清及DMEM12购自美国Gibco公司,鼠Akt及磷酸化Akt(p-Akt)、Bax、Bcl-2和Cleaved caspase-3的一抗购及二抗均购自美国Sant Cruz公司。
1.3 实验动物及分组60只4周龄BALB/c雄性小鼠,随机分为正常对照组、病毒对照组和硒干预组,每组20只。正常对照组小鼠连续3 d腹腔注射不含病毒的培养液200μL;病毒对照组小鼠腹腔注射100 TCID50 CVB3病毒液200μL,连续3 d;硒干预组小鼠在病毒对照组同样的处理后给予100 μg·kg-1亚硒酸钠,每日1次,连续处理14 d。于第15天小鼠分别眼球后取血,断颈处死,同时沿心纵轴眼科剪切开心脏取心脏,一半10%甲醛固定待HE染色后行病理学检查,另外一半置于-80℃冰箱冻存。
1.4 病理学检查常规固定、包埋、切片,HE染色后,在光镜高倍视野下,每张切片随机取5个视野,根据病变面积计算心肌病理变化程度。病变面积=每个视野中炎性细胞浸润及坏死区域面积/整个视野的面积。无病变为0分,病变面积小于25%为1分,25%~50%为2分,50%~75%为3分,大于75%为4分。最后计算心肌病变积分。
1.5 TUNEL染色法检测心肌细胞凋亡参照上海碧云天公司提供的TUNEL试剂盒说明书,病理切片给予3%H2O2甲醇阻断内源性过氧化物酶10 min,漂洗3次,每次5 min;蛋白酶K工作液常温20 min,漂洗5 min,重复3次;加TUNEL反应液,37℃湿盒中避光孵育60min,洗3次;含辣根过氧化物酶的抗荧光素抗体37℃湿盒中避光孵育30 min,洗3次;显色10 min,漂洗3次;苏木素复染细胞核数秒,流水冲洗,脱水,透明,中性树胶封片。阴性对照反应液中不加末端脱氧核苷酸转移酶,其他反应同前。高倍镜视野下(×400)观察切片,凋亡细胞核散大呈棕色,染色质聚集成致密的团块。随机选取5个非重叠视野,心肌细胞凋亡率=凋亡心肌细胞数/心肌细胞总数×100%。
1.6 Western blotting法检测心肌组织中Akt、p-Akt、Bcl-2、Bax和 Cleaved caspase-3 蛋白表达水平采用组织裂解液裂解心肌组织,提取细胞总蛋白,BCA法测定浓度后,取30μg总蛋白上样电泳,电转至PVDF膜,室温封闭3h,用封闭液1∶400稀释相应一抗,4℃过夜;洗膜,用相应的HRP标记的二抗室温孵育,给予化学发光剂发光,以GIS数码凝胶成像系统分析灰度值,蛋白灰度值与β-actin灰度值的比值表示蛋白相对表达水平。
1.7 统计学分析采用SPSS18.0软件进行统计学分析。小鼠生存率组间比较采用χ2检验。各组小鼠心肌病理积分、心脏质量/体质量比、心肌细胞凋亡率及Akt、p-Akt、Bax、Bcl-2和Cleaved caspase-3蛋白表达水平以x[TX-]±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结 果 2.1 各组小鼠生存率、心肌病理学积分和心脏质量/体质量比正常对照组小鼠状态良好,无死亡;病毒对照组小鼠14d生存率为60.0%(12/20),硒干预组小鼠14d生存率为85.0%(17/20)。与病毒对照组比较,硒干预组小鼠生存率明显提高(P<0.01)。正常对照组小鼠心肌组织未见明显病变;其他2组小鼠心肌组织均可见典型的病毒性心肌炎的病理学改变,其中病毒对照组小鼠心肌组织可见片状及弥漫性炎性细胞浸润,心肌纤维断裂和局灶性坏死,硒干预组较病毒对照组轻,炎性细胞浸润少,坏死灶小且减少。各组小鼠心肌病理学积分和心脏质量/体质量比组间比较差异均有统计学意义(P<0.01)。见表 1。
| (n=20,x±s) | ||
| Group | Pathology score of myocardium | Heart/body weight ratio |
| *P<0.01 vs normal control group; △P<0.01 vs virus control group. | ||
| Normal control | 0.0±0.0 | 4.04±0.45 |
| Virus control | 2.9±0.8* | 6.95±0.56* |
| Selenium intervention | 0.8±0.2*△ | 4.49±0.58*△ |
病毒对照组小鼠心肌细胞凋亡率为(51.23±2.41)%,硒干预组小鼠的心肌细胞凋亡率为(24.89±2.13)%,二者比较差异有统计学意义(P<0.01),提示硒能减轻CVB3感染所致的心肌细胞凋亡。
2.3 各组小鼠心肌细胞Akt、p-Akt、Bax、Bcl-2和 Cleaved caspase-3 蛋白表达水平与正常对照 组比较,病毒对照组小鼠心肌细胞Bax、 Cleaved caspase-3蛋白表达水平明显增高,而Bcl-2蛋白表达下降,Bax/Bcl-2蛋白比值明显增加,差异均有统计学意义(P<0.01)。与病毒对照组比较,硒干预组小鼠心肌细胞Bax、Cleaved caspase-3蛋白表达明显降低(P<0.01);p-Akt、Bcl-2蛋白表达增加(P<0.01),Bax/Bcl-2蛋白比值下降(P<0.01),提示硒可通过增加Akt的磷酸化,继而调控Bax/Bcl-2蛋白的表达,从而减少CVB3病毒感染的心肌细胞凋亡发生。见图 1和表 2。
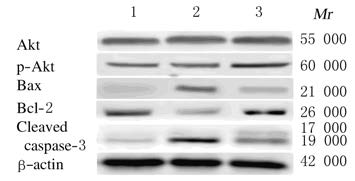
|
| 图 1 各组小鼠心肌细胞中Akt、p-Akt、Bax、Bcl-2和Cleaved caspase-3蛋白表达电泳图 Fig.1 Electrophoregram of expressions of Akt,p-Akt,Bax,Bcl-2 and Cleaved caspase-3 in myocardial cells of mice in various groups Lane 1: Normal control group;Lane 2: Virus control group;Lane 3: Selenium intervention group. |
| (n=3,x±s) | ||||||
| Group | Akt | p-Akt | Bax | Bcl-2 | Bax/Bcl-2 | Cleaved caspase-3 |
| *P<0.01 vs normal control group; △P<0.01 vs virus control group. | ||||||
| Normal control | 0.79+0.08 | 0.39+0.06 | 0.11±0.05 | 0.72+0.14 | 0.17±0.06 | 0.13±0.04 |
| Virus control | 0.81+0.23 | 0.42+0.11 | 0.83±0.02* | 0.45+0.09* | 1.92±0.34* | 0.85+0.11* |
| Selenium intervention | 0.83+0.19* | 0.71+0.19*△ | 0.56±0.21*△ | 0.97+0.24*△ | 0.61±0.12*△ | 0.58±0.09*△ |
已有研究[2]证实:CVB所致的VMC与自身免疫学炎症反应、病毒直接杀伤以及诱导凋亡有关。在不同细胞环境中,PI3K-Akt信号通路的抑制是宿主细胞活性减少的重要原因[8]。研究[5]发现:硒具有明显的抗凋亡生物学效应。硒对CVB3感染的心肌细胞的凋亡抑制作用尚未明确。本研究以CVB3感染的小鼠心肌炎模型为研究对象,观察硒对CVB3感染心肌炎小鼠的保护作用,检测各组心肌细胞PI3K-Akt信号传导通路中Akt、p-Akt及其下游靶基因编码的Bax和Bcl-2蛋白表达变化,探讨硒是否通过PI3K-Akt信号通路及其下游蛋白Bcl-2、Bax发挥对CVB感染导致VMC小鼠的保护作用。
本研究中TUNEL检测结果表明:病毒对照组小鼠心肌细胞凋亡发生率较正常对照组明显增高,而硒干预组小鼠心肌细胞凋亡率下降51.43%。当心肌细胞受到病毒侵袭时,一方面可激活凋亡程序,通过牺牲感染细胞达到清除病毒的作用;另一方面,病毒也可调控凋亡相关基因的表达,调控心肌细胞的凋亡[9]。可以看出硒对CVB3感染导致的心肌损伤具有保护作用,能抑制其诱导的心肌细胞凋亡。与病毒对照组比较,硒干预组小鼠心肌细胞p-Akt、Bcl-2表达上升,Bax、Cleaved caspase-3蛋白表达下降。PI3K-Akt信号通路在细胞的存活、增殖以及凋亡等过程中发挥重要的生物学作用[10]。激活的PI3K可直接使下游靶分子Akt磷酸化,从而使Akt激活;Akt-Ser的473位点磷酸化是Akt激活的必要条件,因而p-Akt蛋白与总Akt蛋白比值可表示Akt的活化程度[11]。激活的Akt通过与下游效应分子结合,影响其下游的多种效应分子如Bax、Bcl-2等而发挥其抗凋亡作用[12]。PI3K/Akt信号途径的激活可有效地保护心肌细胞[13, 14]。病毒对照组小鼠心肌组织Bax、Cleaved caspase-3蛋白表达增加,而Bcl-2蛋白被抑制,这一结果与文献[15]报道一致。研究[16]表明:CVB3感染可促进线粒体凋亡途径的细胞色素C释放,活化caspase-3,启动凋亡级联反应。线粒体凋亡途径主要由Bax、Bcl-2等Bcl-2家族调控,能够通过改变线粒体外膜的通透性来促进或者抑制细胞色素C和其他凋亡因子的释放[17, 18, 19]。caspase-3是执行凋亡的关键蛋白,其主要表现在凋亡的最后阶段,负责水解机体许多核心蛋白,最终引起细胞的形态学改变。本研究结果提示:硒对CVB3感染导致的VMC小鼠心肌细胞有一定的保护作用,其作用机制与硒通过活化PI3K-Akt信号通路,并调控其下游Bcl-2和Bax蛋白表达,继而抑制caspase-3的裂解,抑制凋亡有关。
综上所述,本研究表明:硒可通过调控PI3K-Akt信号通路及其下游蛋白Bcl-2、Bax的表达,抑制CVB3诱导的心肌细胞凋亡,对CVB3感染的VMC小鼠发挥心肌保护作用,硒是否对其他凋亡途径有调节作用,尚待进一步研究。
| [1] | Pankuweit S,Klingel K.Viral myocarditis: from experimental models to molecular diagnosis in patients[J].Heart Fail Rev,2013,18(6):683-702. |
| [2] | Fairweather D,Stafford KA,Sung YK.Update on coxsackievirus B3 myocarditis[J].Curr Opin Rheumatol,2012,24(4):401-407. |
| [3] | Chen Z,Yang L,Liu Y,et al.LY294002 and Rapamycin promote coxsackievirus-induced cytopathic effect and apoptosis via inhibition of PI3K/Akt/mTOR signaling pathway[J].Mol Cell Biochem,2014,385(1/2):169-177. |
| [4] | 郑百红,毓明涛,郑百波,等.微量元素硒对急性病毒性心肌炎患儿脂质过氧化损伤的影响[J].吉林大学学报:医学版,2004,30(3):437-440. |
| [5] | 李小华,王爱民,刘莉莉,等.硒对4-羟基壬烯酸和β淀粉样蛋白诱导的神经细胞凋亡抗氧化保护作用[J].中华老年心脑血管病杂志,2014,16(4):428-430. |
| [6] | Musik I,Kocot J,Lewandowska A,et al.The investigation of the possible protective influence of selenium on antioxidant barrier in heart of rats exposed to lithium[J].Life Sci,2015,132(1):1-5. |
| [7] | Benstoem C,Goetzenich A,Kraemer S,et al.Selenium and its supplementation in cardiovascular disease-what do we know?[J].Nutrients,2015,7(5):3094-3118. |
| [8] | Yao H,Han X,Han X.The cardioprotection of the insulin-mediated PI3K/Akt/mTOR signaling pathway[J].Am J Cardiovasc Drugs,2014,14(6):433-442. |
| [9] | Ursu ON,Sauter M,Ettischer N,et al.Heme oxygenase-1 mediates oxidative stress and apoptosis in coxsackievirus B3-induced myocarditis[J].Cell Physiol Biochem,2014,33(1):52-66. |
| [10] | 邓 旺,赵 燕,何 婧,等,胰岛素通过PI3K信号通路对肺泡上皮钠通道β亚基表达的调控[J].吉林大学学报:医学版,2014,40(2):233-237. |
| [11] | Diehl N,Schaal H.Make yourself at home: viral hijacking of the PI3K/Akt signaling pathway[J].Viruses,2013,5(12):3192-3212. |
| [12] | Liang K,Ye Y,Wang Y,et al.Formononetin mediates neuroprotection against cerebral ischemia/reperfusion in rats via downregulation of the Bax/Bcl-2 ratio and upregulation PI3K/Akt signaling pathway[J].J Neurol Sci,2014,344(1/2):100-104. |
| [13] | Umoh NA,Walker RK,Al-Rubaiee M,et al.Acute alcohol modulates cardiac function as PI3K/Akt regulates oxidative stress[J].Alcohol Clin Exp Res,2014,38(7):1847-1864. |
| [14] | 张 静,马翠丽,王志国.黄芪甲苷对大鼠心肌局部缺血再灌注损伤的改善作用及其对PI3K/Akt/mTOR信号通路的影响[J].吉林大学学报:医学版,2014,40(5):991-996,1130. |
| [15] | Chau DH,Yuan J,Zhang H,et al.Coxsackievirus B3 proteases 2A and 3C induce apoptotic cell death through mitochondrial injury and cleavage of eIF4GI but not DAP5/p97/NAT1[J].Apoptosis,2007,12(3):513-524. |
| [16] | Saraste A,Arola A,Vuorinen T,et al.,Cardiomyocyte apoptosis in experimental coxsackievirus B3 myocarditis[J].Cardiovasc Pathol,2003,12(5):255-262. |
| [17] | Zhang T,Saghatelian A.Emerging roles of lipids in BCL-2 family-regulated apoptosis[J].Biochim Biophys Acta,2013,1831(10):1542-1554. |
| [18] | 潘晓波,孙景辉,高 齐.儿童病毒性心肌炎诊疗进展[J].中国实验诊断学,2014,18(5):863-867. |
| [19] | 黎 萍,郑百红,潘 薇,等.硒对病毒性心肌炎小鼠心肌的保护作用及其机制研究[J].中国实验诊断学,2015,19(3):352-354. |




