扩展功能
文章信息
- 张博男, 张静怡, 储金秀, 王树华, 韩淑英
- ZHANG Bonan, ZHANG Jingyi, CHU Jinxiu, WANG Shuhua, HAN Shuying
- 荞麦花叶芦丁对高糖刺激血管损伤的保护作用
- Protective effect of rutin from buckwheat flowers and leaves on vascular injury induced by high glucose stimulation
- 吉林大学学报(医学版), 2016, 42(01): 40-47
- Journal of Jilin University (Medicine Edition), 2016, 42(01): 40-47
- 10.13481/j.1671-587x.20160109
-
文章历史
- 收稿日期: 2015-06-14
2. 河北省唐山市工人医院心内四科, 河北唐山 063000
2. Department of Cardiology, Tangshan Gongren Hospital, Hebei Province, Tangshan 063000, China
糖尿病(diabetes mellitus,DM)是胰岛素分泌缺陷或(及)胰岛素作用缺陷所引起的糖、脂肪及蛋白质代谢紊乱的慢性代谢性疾病,可以大大增加患者心血管疾病的发生率,心血管疾病已经成为DM最主要的并发症之一[1]。DM导致血管病变的机制非常复杂,其中高血糖诱发的活性氧自由基(ROS)过量生成、体内抗氧化系统活性降低是DM血管内皮损伤的促进因素[2];减少高血糖诱发的氧化应激及提高抗氧化酶活性可能是改善DM血管功能的有效方法。荞麦主要分布在我国东北地区,其化学成分主要含有芦丁和槲皮素等黄酮类化合物。本研究室前期研究[3, 4]发现:荞麦花叶总黄酮具有降糖、降脂、改善糖耐量及舒张血管等活性,其主要成分芦丁对大鼠糖尿病心肌病和心肌梗死亦有明显的保护作用,但是否可以改善高糖刺激血管的内皮依赖性舒张功能目前尚未见报道。由于血管内皮功能紊乱在DM早期即可出现[5],本实验分别从体内和体外角度观察荞麦花叶芦丁(rutin from buckwheat flowers and leaves,RBFL) 对高糖刺激血管内皮损伤的影响,并探讨其可能机制。
1 材料与方法 1.1 实验动物、药物和主要试剂健康SD大鼠,体质量(200±20)g,动物合格证号:SCXK(京)2009-004,由中国医学科学院实验动物研究所提供,于华北理工大学实验动物中心饲养。 RBFL为自制[6],经本校中药学系确认。链脲佐菌素(streptozotocin,STZ)、苯肾上腺素(phenylephrine,PE)、乙酰胆碱(acetylcholine,Ach)、左旋硝基精氨酸甲酯(Nω-nitro-L-argininemethyl ester hydrochloride,L-NAME)、亚甲蓝(methylene blue,MB)和硝普钠(sodium nitroprusside,SNP)均购自美国Sigma公司。ROS荧光探针DCFH-DA购自江苏碧云天生物技术研究所。一氧化氮(nitric oxide,NO)试剂盒、一氧化氮合酶(nitric oxide synthase,NOS)试剂盒、超氧化物歧化酶(superoxidedismutase,SOD)试剂盒和谷胱甘肽-过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒均购自南京建成生物工程研究所。其余试剂为巿售分析纯。克氏液成分(K-H液,mmol·L-1):NaCl 118.0,KCl 4.7,KH2PO4 1.2,MgSO4 1.2,NaHCO3 25.0,CaCl2 1.25,葡萄糖11.0,pH 7.4。在高浓度葡萄糖K-H液中,葡萄糖为44 mmol·L-1,其余成分不变。
1.2 DM模型制备及分组给药45只大鼠适应性喂养1周,随机取出8只为正常对照组(control)。其余37只大鼠空腹一次性腹腔注射STZ (60 mg·kg-1)诱导1型DM动物模型[7],正常对照组注射相同剂量的柠檬酸钠缓冲液。72 h后尾静脉取血检测空腹血糖(FBG),FBG≥11.1 mmol·L-1者定为DM模型动物[4]。造模成功大鼠共34只,分为模型组(model)10只及低剂量(45 mg·kg-1)、中剂量(90 mg·kg-1)、高剂量(180 mg·kg-1) RBFL干预组[4],每组8只,灌胃给药,每天1次,连续8周;正常对照组和模型组大鼠灌胃等量的生理盐水。记录给药8周后各组大鼠的血糖和体质量变化。
1.3 Ach诱导的DM大鼠胸主动脉舒张实验将各组大鼠处死,分离胸主动脉,置于通混合气体(95% O2,5% CO2)的4℃ K-H液中,去除周围结缔组织后将血管剪成约3~4 mm宽的血管环(避免因过度牵拉造成内皮损伤)。将血管环放入含K-H液的浴槽内,持续通以混合气体(95% O2,5% CO2)并保持37℃恒温。先以0.5 g张力稳定30 min,然后逐步调节张力至2 g,每隔20 min换液1次,平衡1 h后开始实验。加入60 mmol·L-1 KCl刺激,待收缩幅度达到峰值后洗脱3次,以激发主动脉环最大收缩。待主动脉环稳定后,在浴槽中加入1 μmol·L-1 PE (根据实验需要,在加入PE前30 min加入0.1 mmol·L-1 L-NAME或0.01 mmol·L-1 MB孵育),收缩达到峰值后累积加入Ach (1×10-9~1×10-5 mol·L-1),检测各组大鼠胸主动脉对Ach诱导的内皮依赖性舒张反应。设定PE引起的最大收缩幅度为100%,以加入Ach后的血管张力幅度与PE诱发最大收缩幅度之间的比值反映血管的舒张性能。血管舒张率=(PE诱发的最大张力-ACh相应浓度时的张力)/PE诱发的最大张力×100%。
1.4 SNP诱导的DM大鼠胸主动脉舒张实验按照1.4的方法,待动脉环稳定后,在浴槽中加入0.1 mmol·L-1 L-NAME孵育30 min,然后加入1 μmol·L-1 PE,收缩达到峰值后累积加入SNP(1×10-10~1×10-5 mol·L-1),检测各组胸主动脉对SNP诱导的非内皮依赖性舒张反应。设定PE引起的最大收缩幅度为100%,以加入SNP后的血管张力幅度与PE诱发最大收缩幅度之间的比值反映血管的舒张性能。血管舒张率=(PE诱发的最大张力-SNP相应浓度时的张力)/PE诱发的最大张力×100%。
1.5 DM大鼠血清ROS、NO水平和SOD、GSH-Px及NOS活性检测各组大鼠饲养8周后,用4%水合氯醛麻醉,腹主动脉取血,3 000 r·min-1、4℃离心15 min,取上清液备用。按试剂盒操作说明书测定各组血清ROS、NO水平和SOD、GSH-Px及NOS活性。
1.6 RBFL急性给药实验分组及药物处理正常大鼠处死并迅速分离胸主动脉,在Organ bath系统中稳定并检测内皮完整性之后,取内皮完整的血管环于不同K-H液中孵育4 h,分为9组,每组6根血管环。①正常葡萄糖对照组(control):11 mmol·L-1 葡萄糖;②高浓度葡萄糖损伤组(HG):44 mmol·L-1 葡萄糖;③低剂量(0.2 mg·L-1)RBFL处理组(HG+low RBFL);④中剂量(0.4 mg·L-1)RBFL处理组(HG+moderate RBFL);⑤高剂量(0.8 mg·L-1)RBFL处理组(HG+high RBFL)[3];⑥高浓度葡萄糖+L-NAME组(HG+L-NAME);⑦高浓度葡萄糖+L-NAME+RBFL组(HG+L-NAME+ high RBFL);⑧高浓度葡萄糖+MB组(HG+MB);⑨高浓度葡萄糖+MB+RBFL组(HG+MB+ high RBFL)。RBFL在孵育的最后30 min内加入,L-NAME(0.1 mmol·L-1)和MB(0.01 mmol·L-1)较RBFL早30 min加入。孵育结束后,所有组别的灌流液均换成正常葡萄糖浓度的K-H液。
1.7 Ach和SNP诱导的高糖孵育大鼠胸主动脉舒张实验待血管环稳定后,分别按照1.4和1.5的方法检测各组大鼠胸主动脉对Ach和SNP诱导的内皮依赖性舒张反应。
1.8 高糖孵育大鼠胸主动脉SOD及tNOS活性检测大鼠胸主动脉在不同K-H液中孵育4 h后,将其匀浆,3 000 r·min-1、4℃离心15 min,取上清液备用。按试剂盒操作说明检测正常葡葡糖对照组、HG组和RBFL处理组大鼠胸主动脉SOD和NOS活性。
1.9 统计学分析采用SPSS 13.0 软件包进行统计学处理。各组大鼠血糖、体质量,血清ROS、NO水平,tNOS、SOD、GSH-Px活性,胸主动脉SOD、NOS活性和Ach、SNP诱导的血管舒张率,均以x±s表示,组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结 果 2.1 各组大鼠一般状况正常对照组大鼠一般情况良好,活动自如,精神状态佳,毛发光泽顺滑;模型组大鼠一般情况较差,出现多食、多饮和多尿现象,体质量下降,行动迟缓,毛发杂乱无光;RBFL干预组大鼠较模型组大鼠一般情况明显改善。
2.2 各组大鼠血糖和体质量与正常对照组比较,8周后模型组大鼠体质量明显下降,血糖明显升高(P<0.01);与模型组比较,RBFL干预组大鼠体质量明显升高,血糖降低(P<0.05或P<0.01)。见表 1。
| x±s | |||
| Group | n | Body weight ( m/g) | FBG [ c B/(mmol·L-1)] |
| * P<0.01 vs control group; △ P<0.05, △△ P<0.01 vs model group. | |||
| Control | 8 | 396.74±26.23 | 5.76±0.45 |
| Model | 8 | 231.36±19.65* | 25.37±3.26* |
| RBFL | |||
| Low | 6 | 285.62±19.41△ | 18.21±2.31△ |
| Moderate | 7 | 331.45±18.12△△ | 15.89±2.12△△ |
| High | 7 | 352.23±19.35△△ | 13.12±1.86△△ |
与正常对照组比较,模型组大鼠胸主动脉对Ach诱导的内皮依赖性舒张反应即血管舒张率明显降低(P<0.05或P<0.01);灌胃给药8周后,不同剂量(45、90和180 mg·kg-1)RBFL干预组DM大鼠胸主动脉的内皮依赖性舒张功能显著改善,血管舒张率随着给药剂量的增加而升高(P<0.05或P<0.01)。见图 1。
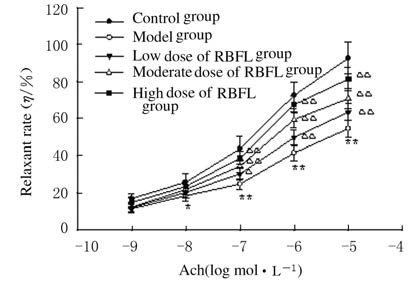
|
| n=6,x±s; *P<0.05,**P<0.01vs control group;△P<0.05,△△P<0.01vs model group. 图 1 血管张力测定法检测Ach诱导的DM大鼠血管舒张率 Fig.1 Vessel relaxant rates induced by Ach in DM rats detected with vessel tension assay |
分别与模型+L-NAME组和模型+MB组比较,模型+L-NAME+高剂量RBFL干预组和模型+MB+高剂量RBFL干预组大鼠Ach诱导的内皮依赖性舒张率差异均无统计学意义(P>0.05),见图 2。与模型组比较,给药8周后不同剂量 (45、90和180 mg·kg-1) RBFL干预组大鼠SNP诱导的血管舒张率差异无统计学意义(P>0.05),见图 3。
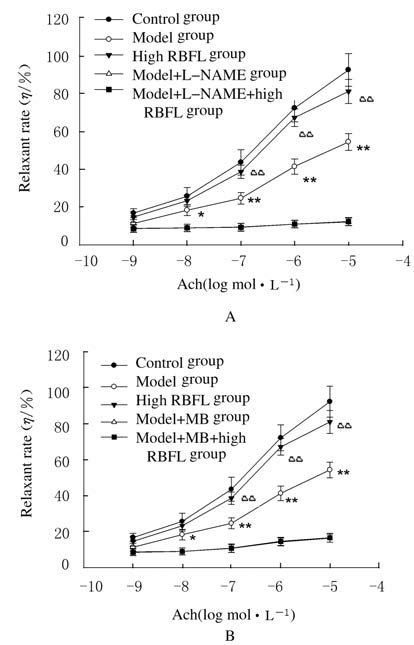
|
| n=6,x±s; *P<0.05,**P<0.01vs control group;△P<0.01 vs model group. 图 2 血管张力测定法检测L-NAME(A)或MB(B)预处理后Ach诱导的DM大鼠血管舒张率 Fig.2 Vessel relaxant rates induced by Ach pretreated with L-NAME(A) or MB(B) in DM rats detected with vessel tension assay |
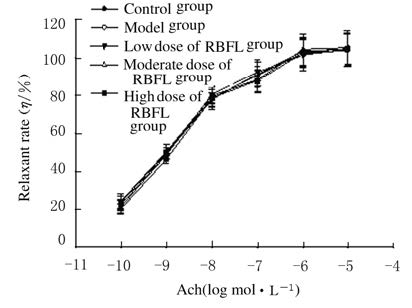
|
| 图 3 血管张力测定法检测SNP诱导的DM大鼠血管舒张率 Fig.3 Vessel relaxant rates induced by SNP in DM rats detected with vessel tension assay |
与正常对照组比较,DM模型组大鼠血清ROS水平明显增高(P<0.01),NO水平明显降低(P<0.01),SOD和NOS活性明显降低(P<0.01);与模型组比较,灌胃给药8周后,高剂量(180 mg·kg-1) RBFL干预组大鼠ROS水平明显降低(P<0.01),NO水平升高(P<0.05),SOD和tNOS活性增强(P<0.01)。不同组别大鼠血清GSH-Px活性比较差异无统计学意义(P>0.05)。见表 2。
| (x±s) | ||||||
| Group | n | ROS [ λ B/ (U·mL -1)] | NO [ c B/ (μmol·L -1)] | tNOS [ λ B/ (U·L -1)] | SOD [ λ B/ (U·mL -1)] | GSH-Px [ λ B/ (U·mL -1)] |
| *P<0.01 vs control group;△P<0.05,△△P<0.01 vs model group. | ||||||
| Control | 8 | 576.25±57.42 | 32.65±4.86 | 19.42±2.31 | 186.32±12.25 | 475.35±26.37 |
| Model | 8 | 985.23±46.21 * | 20.36±3.57 * | 11.57±1.65 * | 117.68±13.57 * | 469.26±22.31 |
| High RBFL | 7 | 656.42±51.56 △△ | 27.54±4.25 △ | 17.85±2.21 △ | 165.46±15.12 △△ | 471.84±24.62 |
与正常葡萄糖对照组比较,HG组大鼠胸主动脉Ach诱导的血管舒张率明显降低(P<0.01);与HG组比较,不同剂量 (0.2、0.4和0.8 mg·L-1) RBFL处理组高糖孵育大鼠胸主动脉的血管舒张率明显升高(P<0.05或P<0.01)。见图 4。
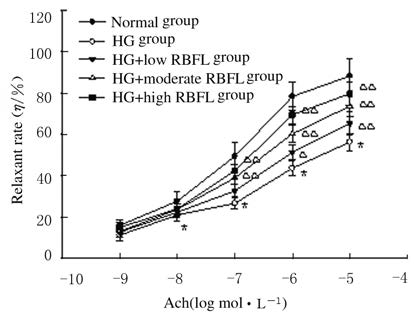
|
| n=6,x±s;*P<0.01 vs normal group; △P<0.05,△△P<0.01 vs HG group. 图 4 血管张力测定法检测Ach诱导的高糖孵育大鼠血管舒张率 Fig.4 Vessel relaxant rates induced by Ach after incubation in high glucose K-H solution detected with vessel tension assay |
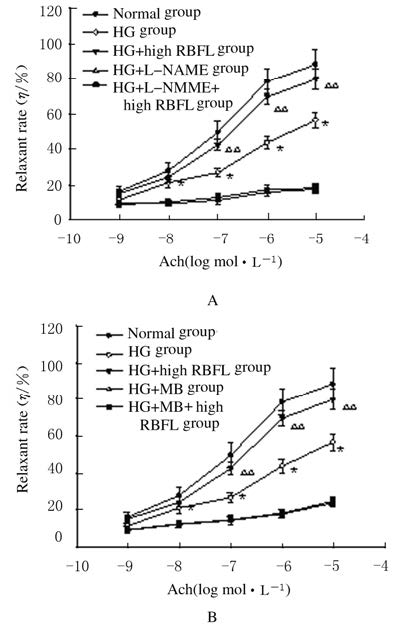
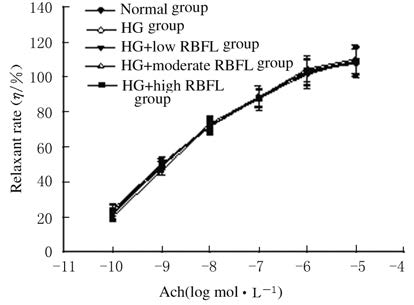
分别与HG+L-NAME组和HG+MB组比较,HG+L-NAME+RBFL组和HG +MB+RBFL组大鼠Ach诱导的血管舒张率差异均无统计学意义(P>0.05)。与HG组比较,不同剂量 (0.2、0.4和0.8 mg·L-1) RBFL处理组大鼠SNP诱导的血管舒张率差异无统计学意义(P>0.05)。见图 5和6。
|
| n=6,x±s;*P<0.01 vs normal group;△P<0.01vs HG group. 图 5 血管张力测定法检测L-NAME(A)或MB(B)预处理后Ach诱导的高糖孵育大鼠血管舒张率 Fig.5 Vessel relaxant rates induced by Ach pretreated with L-NAME(A) or MB (B) after incubation in high glucose solution detected with vessel tension assay |
|
| 图 6 血管张力测定法检测SNP诱导的高糖孵育大鼠血管舒张率 Fig.6 Vessel relaxant rates induced by SNP after incubation in high glucose K-H solution detected with vessel tension assay |
与正常葡萄糖对照组比较, HG组大鼠胸主动脉组织中SOD和tNOS活性明显下降(P<0.01);与HG组比较,高剂量 (0.8 mg·L-1)RBFL处理组大鼠胸主动脉组织中SOD和tNOS活性明显升高(P<0.05或P<0.01)。见表 3。
| (n=6,x±s) | ||
| Group | SOD [λB/ (U·mL-1)] | tNOS[λB/ (U·L-1)] |
| *P<0.01 vs normal group;△P<0.05,△△P<0.01 vs HG group. | ||
| Normal | 212.36±31.21 | 22.34±2.32 |
| HG | 136.29±26.37* | 12.65±1.95* |
| High RBFL | 187.65±22.54△△ | 18.36±2.24△ |
DM患者早期就已出现血管内皮功能紊乱。血管内皮细胞贴附于血管内壁,在调节血管张力、血管生成、血小板功能方面具有重要作用,是大部分心血管疾病危险因子作用的重要靶点[8, 9]。氧化应激在DM大血管及微血管并发症的发生中起关键作用,并且其造成血管损伤的早期表现就是进行性内皮功能障碍[10],因此如何防治DM内皮功能障碍,延缓心血管并发症的发生是治疗DM、提高DM患者生存质量的关键。本研究采用STZ诱导的DM大鼠模型和离体高浓度葡萄糖胸主动脉急性损伤动物模型作为研究对象,观察RBFL慢性整体给药和急性给药对高糖 刺激胸主动脉舒张功能的影响并探讨其可能机制,结果显示:DM模型组和离体高浓度葡萄糖急性损伤组大鼠胸主动脉对Ach诱导的内皮依赖性舒张功能明显下降而对SNP 诱导的舒张作用无明显下降,提示DM初期和急性高糖刺激使主动脉舒张功能受损,且此改变可能与血管平滑肌无关而主要与血管内皮受损有 关;RBFL灌胃给药8周或预处理可以剂量依赖性改善DM和急性高糖刺激大鼠胸主动脉对Ach诱导的内皮依赖性舒张功能,但对SNP诱导的血管舒张反应影响不大,提示RBFL改善胸主动脉的舒张功能主要与保护内皮有关, 而不直接作用于血管平滑肌;RBFL灌胃给药8周还可以明显降低DM大鼠血糖,改善DM大鼠的消瘦状态,奠定了RBFL用于糖尿病治疗的理论基础。
高糖刺激可以抑制血管内源性NO合成而导致血管内皮依赖性舒张功能受损[11]。本研究显示:RBFL改善高糖刺激血管舒张功能可被NOS抑制剂L-NAME和鸟苷酸环化酶抑制剂MB所取消,提示RBFL的血管保护作用可能与增加NO的合成有关。高血糖引起的ROS的大量生成[12]以及体内抗氧化酶活性的降低[13]也是导致血管内皮功能障碍的重要原因。过表达SOD[14]或抑制与ROS生成相关的NADPH氧化酶[15]可以改善高糖引起的血管内皮功能障碍,说明ROS参与了高糖引起的血管内皮功能损伤。本研究结果显示:DM大鼠血清中ROS生成增加,SOD活性下降,tNOS活性和NO水平明显降低;高浓度葡萄糖损伤胸主动脉中SOD和tNOS活性下降,RBFL可以明显抑制DM大鼠血清ROS的过量生成,升高NO水平并增强了DM大鼠血清和高浓度葡萄糖损伤胸主动脉SOD和tNOS活性,提示RBFL可通过提高机体抗氧化酶活性,降低ROS生成以及增加NO合成,改善高糖刺激胸主动脉的内皮依赖性舒张功能。本研究亦观察到各组大鼠血清GSH-Px活性比较无明显差异。GSH-Px的主要作用是降低H2O2水平,DM大鼠体内产生了大量的H2O2,使H2O2在机体大量堆积,可能是DM大鼠GSH-Px水平没有无降低的原因;由于抗氧化酶之间存在着某种互补机制,RBFL (180 mg·kg-1)未改变GSH-Px活性,原因是CAT与GSH-Px有协同清除H2O2的作用,可能由于RBFL对CAT活性影响不明显,故GSH-Px活性亦未改变。
本实验从整体和器官2个角度证实了RBFL可以改善高糖刺激胸主动脉的内皮依赖性舒张功能,该作用可能与减轻血管氧化应激以及促进血管内皮细胞合成NO有关。本研究为RBFL在临床控制DM心血管并发症提供了新的思路和实验依据。
| [1] | Matsumoto T,Lopes RA,Taguchi K,et al.Linking the beneficial effects of current therapeutic approaches in diabetes to the vascular endothelin system[J].Life Sci,2014,118(2): 129-135. |
| [2] | Giacco F,Brownlee M.Oxidative stress and diabetic complications[J].Circ Res,2010,107(9): 1058-1070. |
| [3] | 张博男,储金秀,韩淑英.荞麦花叶总黄酮的舒张血管作用及其机制[J].中国药理学通报,2010,26(7):952-956. |
| [4] | Zhang BN,Han SY,Wang ZL,ea al.Protective effects of rutin from buckwheat flowers and leaves on diabetic cardiomyopathy[J].Lat Am J Phar,2013,32(5): 674-678. |
| [5] | Canivell S,Gomis R.Diagnosis and classification of autoimmune diabetes mellitus[J].Autoimmun Rev,2014,13(4/5):403-407. |
| [6] | Han SY,Chu JX,Li GM,et al.Effects of rutin from leaves and flowers of buckwheat on angiotensin Ⅱ-induced hypertrophy of cardiac myocytes and proliferation of fibroblasts[J].Lat Am J Phar,2010,29(1): 137-140. |
| [7] | 左风云,董 岭,杨 英.大鼠1型与2型糖尿病模型的对比研究[J].疾病检测与控制,2015, 9(6):383-384. |
| [8] | Diagnosis and classification of diabetes mellitus[J].Diabetes Care,2013,36(Suppl 1):S67-74. |
| [9] | Vanhoutte PM.Endothelial dysfunction: the first step toward coronary arteriosclerosis[J].Circ J,2009,73(4):595-601. |
| [10] | Batchuluun B,Inoguchi T,Sonoda N,et al.Metformin and liraglutide ameliorate high glucose-induced oxidative stress via inhibition of PKC-NAD(P)H oxidase pathway in human aortic endothelial cells[J].Atherosclerosis,2014,232(1): 156-164. |
| [11] | Toda N,Imamura T,Okamura T.Alteration of nitric oxide-mediated blood flow regulation in diabetes mellitus[J].Pharmacol Ther,2010,127(3): 189-209. |
| [12] | Devi TS,Hosoya K,Terasaki T,et al. The critical role of TX-the NIP in oxidative stress and DNA damage and retinal pericy teapoptosis under high glucose: implications for diabetic reti-nopathy[J].J Exp Cell Res,2013,319(7): 1001-1012. |
| [13] | Dursun B,Dursun E,Suleymanlar G,et al.The effect of hemodialysis on accelerated atherosclerosis in diabetic patients: correlation of carotid artery intima-media thickness with oxidative stress[J].J Diabetes Complications,2009,23(4): 257-264. |
| [14] | 张孝侠,李永华.氧化损伤与糖尿病发病的相关性[J].中国热带医学,2013,13(5):611-613. |
| [15] | 刘江月.梓醇抑制NADPH氧化酶保护2型糖尿病早期血管内皮功能[J].中国中药杂志,2014,39(15):2936-2941. |




