扩展功能
文章信息
- 肖欢, 潘卫民, 孙雯, 陈鸿颜, 徐军发
- XIAO Huan, PAN Weimin, SUN Wen, CHEN Hongyan, XU Junfa
- 可溶性mB7-H4对ConA诱导小鼠肝损伤的保护作用
- Protective effect of soluble protein mB7-H4 on liver injury of mice induced by Con A
- 吉林大学学报(医学版), 2016, 42(01): 36-39
- Journal of Jilin University (Medicine Edition), 2016, 42(01): 36-39
- 10.13481/j.1671-587x.20160108
-
文章历史
- 收稿日期: 2015-06-12
2. 广东省医学分子诊断重点实验室, 广东东莞523808
2. Guangdong Provincial Key Laboratory of Medical Molecular Diagnosis, Dongguan 523808, China
B7-H4分子自发现以来一直被公认为是一种T细胞活化强有力的负性调控因子[1]。在机体的免疫应答过程中,B7-H4分子为免疫细胞的激活提供了刺激信号。活化的T细胞[2, 3, 4, 5, 6, 7, 8]产生以白细胞介素4(IL-4)、肿瘤坏死因子α(TNF-α)和γ干扰素(IFN-γ)为主的细胞因子,其中IL-4、TNF-α和IFN-γ等细胞因子介导的肝细胞免疫性损伤是病毒性肝炎的重要致病机制。B7-H4能否通过抑制IL-4、TNF-α和IFN-γ等细胞因子产生而减弱肝细胞的免疫性损伤目前尚不清楚。关于可溶性mB7-H4与免疫性肝损伤关系的研究目前国内外尚未见相关报道。本研究采用刀豆蛋白A(Con A)诱导小鼠肝损伤模型[9]来模拟人的免疫性肝损伤,通过输注原核表达的重组可溶性mB7-H4,观察小鼠接受Con A注射后其肝损伤程度,为病毒性肝炎的防治提供理论依据。
1 材料与方法 1.1 实验动物、药物及试剂昆明(KM)小鼠,雌雄各半,8~10周龄,体质量(20±2) g,由海南医学院动物中心提供,合格证号:43004700010546。pETmB7-H4载体[10](广东医学院临床免疫学教研室赠送),可溶性mB7-H4(本室制备),Con A和异丙基硫代半乳糖苷(IPTG)(美国Sigma公司),IL-4和IFN-γ 酶联免疫法(ELISA)试剂盒(美国eBioscience公司),天冬氨酸氨基转移酶(ALT)和丙氨酸氨基转移酶(AST)测定试剂盒(上海荣盛生物技术有限公司)。
1.2 实验动物及分组整个实验过程中小鼠自由饮食,随机分为对照组、 Con A组和mB7-H4蛋白100、200及400 μg组,每组10只。
1.3 可溶性mB7-H4蛋白的制备采用IPTG诱导含pET/mB7-H4的 E.coli BL21(DE3)大量表达。在变性的条件下,通过Ni+-NTA亲和层析纯化、获得可溶性mB7-H4蛋白。经过复性以及去除内毒素处理,获得具有生物活性的可溶性mB7-H4蛋白。
1.4 给药方法及Con A诱导肝损伤动物模型的建立在Con A注射前2 h,mB7-H4蛋白100、200和400 μg组每只小鼠分别注射可溶性mB7-H4蛋白50、100和200 μg/1.5 mL,注射Con A建立肝损伤动物模型后8 h再次注射上述量蛋白。肝损伤动物模型的建立方法:将Con A 配成浓度为1 g·L-1,通过尾静脉注射,剂量为25 mg·kg-1。注射Con A后24和48 h,各组小鼠摘眼球取血,分离后的血清冻存于-80℃备用。引颈处死小鼠取肝脏,置于10%甲醛溶液固定,采用于组织病理学检测。
1.5 小鼠血清IL-4、IFN-γ、ALT和AST水平测定参照试剂盒说明书进行检测。血清IL-4和IFN-γ水平测定采用定量ELISA试剂盒,其中IL-4检测灵敏度为4 ng·L-1,IFN-γ检测灵敏度为15 ng·L-1。血清ALT和AST水平测定采用全自动生化分析仪,由海南医学院附属医院检验科生化室完成。
1.6 小鼠肝脏组织病理学观察各组小鼠肝脏组织切片由海南医学院病理教研室制备,切片厚5 μm,HE染色,光学显微镜下进行组织病理学检测。
1.7 统计学分析采用SPSS19.0统计软件进行统计学分析。使用CurveExpert1.3软件绘制标准曲线。血清ATL、AST、IL-4和IFN-γ水平均以x±s表示,组间比较采用析因设计的方差分析。以P<0.05为差异有统计学意义。
2 结 果 2.1 各组小鼠肝功能检测结果注射Con A后,mB7-H4蛋白组小鼠不同时间点(5只/点)血清ALT和AST检测结果见表 1。与对照组比较,Con A组和不同剂量mB7-H4蛋白组小鼠血清ALT和AST水平均明显升高(P<0.05)。随着可溶性mB7-H4蛋白注射剂量的增加,ALT和AST值呈明显降低趋势,与Con A组比较,mB7-H4蛋白200和400 μg组小鼠血清ALT和AST水平明显降低(P<0.05 或P<0.01)。
| [n=5,x±s,λB/(U·L-1)] | ||||
| Group | ALT | AST | ||
| (t/h)24 | 48 | 24 | 48 | |
| *P<0.05 vs control group;△P<0.05,△△P<0.01 vs Con A group. | ||||
| Control | 112.1±11.1 | 112.1±11.1 | 85.2±12.1 | 85.2±12.1 |
| Con A | 360.7±23.7* | 334.5±26.3* | 238.7±23.3* | 209.5±16.4* |
| mB7-H4 | ||||
| 100 μg | 360.4±39.8* | 267.2±31.8* | 225.7±22.4* | 202.8±16.8* |
| 200 μg | 293.1±20.4*△△ | 206.2±31.5*△△ | 197.5±16.4*△ | 187.8±16.5*△ |
| 400 μg | 256.6±25.4*△△ | 197.3±29.4*△△ | 176.6±19.2*△△ | 157.2±20.2*△△ |
注射Con A后,mB7-H4蛋白组小鼠不同时间点(5只/点)血清IL-4和IFN-γ测定结果见表 2。与对照组比较,Con A组和不同剂量mB7-H4蛋白组小鼠血清IL-4和IFN-γ水平均明显升高(P<0.05)。随着可溶性mB7-H4蛋白注射剂量的增加,血清IL-4和IFN-γ水平呈明显降低趋势,与Con A组比较,不同剂量 mB7-H4蛋白组小鼠血清IL-4和IFN-γ水平差异均有统计学意义(P<0.01)。
| [n=5,x±s,ρB/(ng·L-1)] | ||||
| Group | IL-4 | IFN-γ | ||
| (t/h)24 | 48 | 24 | 48 | |
| *P<0.05 vs control group;△P<0.01 vs Con A group. | ||||
| Control | 52.1±6.1 | 52.1±6.1 | 575.2±62.1 | 575.2±62.1 |
| Con A | 360.8±23.7* | 334.5±26.3* | 3 825.7±252.4* | 3 202.8±216.8* |
| mB7-H4 | ||||
| 100 μg | 336.4±37.1*△ | 277.2±31.2*△ | 3 238.7±213.3*△ | 2 820.5±176.4*△ |
| 200 μg | 253.1±20.7*△ | 209.2±30.5*△ | 3 197.5±216.4*△ | 2 817.8±246.5*△ |
| 400 μg | 187.6±25.4*△ | 114.3±29.4*△ | 2 176.6±197.2*△ | 1 857.2±200.2*△ |
注射Con A 24和48 h后,Con A组和不同剂量mB7-H4蛋白组小鼠肝细胞出现不同程度的变性改变,肝窦内可见红细胞淤积。Con A组小鼠肝中央静脉和门静脉区见多叶核粒细胞伴有胞核破损、胞浆出现囊性或空泡样改变以及大量淋巴细胞浸润;mB7-H4蛋白组小鼠肝细胞的损伤较轻,肝脏内未见坏死区,汇管区仅见少量细胞浆出现了空泡样改变,但胞核完整以及少量淋巴细胞浸润。见图 1和2(插页二)。
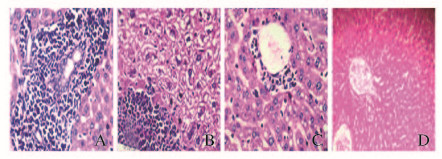
|
| A:Con A group;B-D:100,200, and 400 μg mB7-H4 group. 图1 Con A注射24 h后各组小鼠肝脏组织病理学(HE,×100) Fig.1 Pathology of liver tissue of mice in various groups 24 h after Con A injection(HE,×100) |
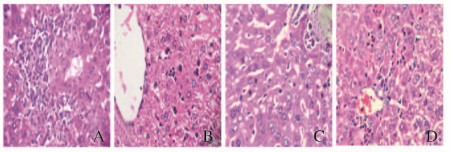
|
| A:Con A group;B-D:100,200, and 400 μg mB7-H4 group. 图2 Con A注射48 h后各组小鼠肝脏组织病理学(HE,×100) Fig.2 Pathology of liver tissue of mice in various groups 48 h after Con A injection(HE,×100) |
目前对B7-H4的研究主要集中在肿瘤方面[11, 12, 13, 14],如卵巢癌和胃癌等,B7-H4在这些癌组织中均高表达。B7-H4在炎症方面的研究较少,主要集中于类风湿关节炎[15]和肾病[16]等自身免疫性疾病,而关于其在自身免疫性肝炎中的表达情况尚未有相关研究。本研究以 Con A诱导的小鼠肝损伤[17]为研究对象,很好地模拟了人类病毒性肝炎和自身免疫性肝病等疾病,当给予Con A 剂量为20 mg·kg-1,2 h后肉眼可见肝脏淤血变暗,并逐渐加重,24 h 后可见肝脏几乎完全水肿坏死;光镜下观察可见肝内大量淋巴细胞浸润,在汇管区尤为明显,肝窦内红细胞淤积等。本研究结果显示:在注射Con A后,Con A组和mB7-H4蛋白组小鼠血清中ALT和AST水平较对照组均明显升高,随着可溶性mB7-H4蛋白注射剂量的增加,ALT和AST呈降低趋势,均低于Con A组;各组小鼠肝组织切片后经HE染色,在光学显微镜下可见:mB7-H4蛋白组小鼠肝脏损伤均Con A组均有不同程度的减轻。本研究结果表明:可溶性mB7-H4蛋白在Con A诱导小鼠肝损伤中,能减轻Con A带来的损伤,具有肝脏保护作用。
Con A 诱导的肝炎模型中,Con A 注射后,血清IL-4 和IL-5 水平升高,IL-4 和IL-5主要由NKT 细胞分泌产生,这可能是其导致肝脏损伤的一个重要原因;在IL-4和IL-5 基因敲除的小鼠或用其单抗预处理,均不能导致Con A诱导肝损伤,说明IL-4和IL-5 在Con A 诱导的肝炎模型中也起到非常重要的作用。本研究结果显示:注射Con A后,各组小鼠血清IL-4和IFN-γ水平较对照组均明显升高,且随着可溶性mB7-H4蛋白注射剂量的加大,IL-4和IFN-γ水平呈减低趋势,明显低于Con A组。这与文献[18]报道一致,TNF-α和IFN-γ是该模型肝脏损伤中最重要的细胞因子,IL-4和IL-5在Con A诱导的肝炎模型中也发挥了重要的作用[19]。
本课题组采用小鼠尾静脉注射可溶性mB7-H4蛋白方法,实现了最佳可溶性mB7-H4蛋白浓度在自身免疫性肝炎模型中发挥保护的作用[20]。本研究结果显示:注射重组原核表达可溶性mB7-H4蛋白能明显抑制受Con A刺激的小鼠释放IFN-γ和IL-4,提示可溶性mB7-H4是通过抑制IFN-γ和IL-4分泌,从而下调免疫炎症反应,保护肝细胞。本研究扩展了B7-H4对免疫炎症反应调节功能的认识,为可溶性mB7-H4在病毒性肝炎防治研究中的应用提供了实验依据。但有关可溶性mB7-H4在免疫性肝损伤中的作用机制尚有待进一步研究。
| [1] | Sica GL,Choi IH,Zhu G,et al. B7-H4,a molecule of the B7 family,negatively regulates T cell immunity[J].Immunity,2003,18(6):849-861. |
| [2] | He C,QiaoH,Jiang H,et al.The inhibitory role of b7-h4inantitumor immunity: association with cancel progression and survival[J].Clin Dev Immanol,2011,2011:695834. |
| [3] | 王 辉,田 波,鲁常青.B7 家族 PD -L1 和 B7-I-I4 的研究进展[J].细胞与分子免疫学杂志,2013,29(2):216-217. |
| [4] | Wang X,Hao J,Metzger DL,et al.B7-H4 treatment of T cells in-hibits ERK,JNK,p38,and AKT activation[J].PLoS One,2012,7(1):e28232. |
| [5] | Zhu G,Augustine MM,Azuma T,et al.B7-H4-deficient mice display augmented neutron phil-mediated innate immunity[J].Blood,2009,113(8):1759-1767. |
| [6] | Chen L.Co-inhibitory molecules of the B7-CD28 family in the control of T cell immunity[J].Nature RevImmunol,2004,4(5):336-347. |
| [7] | Zhang L,Wu H,Lu D,et al.The costimulatory molecule B7-H4 promote tumor progression and cell proliferation through translocating into ucleus[J].Oncogene,2013,32 (46):5347-5358. |
| [8] | 李 丽,胡为民,王朝莉,等.小鼠 B7-H4 基因的真核表达及其对淋巴细胞增殖的影响[J].中国微生态学杂志,2012,24(4):292-294,297. |
| [9] | Tiegs C,Hentschel J,Wendel A.T cell-dependent experimental liver injury in mice inducible by concanavalin A[J].J Clin Invest,1992,90(1):196-203. |
| [10] | 肖德乾,肖 欢,胡国艳,等.小鼠B7-H4原核表达载体的构建、表达及多克隆抗体的制备[J].广东医学院学报,2009,27(5): 481-484. |
| [11] | Zhang LL,Shao SL,Wu Y.Expression of osteopontin and B7-H4 in epithelial ovarian neoplasm and their significance[J].Clin J Cancer,2010,29(1):25-29. |
| [12] | Arigami T,Uenosono Y,Hirata M,et al.Expression of B7-H4 in blood of patients with gastric cancer predicts tumor progression and prognosis[J].Surg Oncol,2010,102(7):748-752. |
| [13] | Dangaj D,Lanitis E,Zhao A,et al.Novel recombinant human B7-H 4 antibodies over come tumoral im mune escape to potentiate T-cell antitumor response[J].Cancer Res,2013,73 (15 ):4820-4829. |
| [14] | Sun SQ,Jiang CG,Lin Y,et al.Enhanced T cell immunity by B7-H4 downregulation in nonsmall-cell lung cancer cell lines[J].J Int Med Res,2012,40(2):497-506. |
| [15] | 郭国宁,尚永军,朱国宴,等.B7-H4在类风湿关节炎组织内的表达及分布研究[J].现代免疫学,2011,31(2):130-134. |
| [16] | 俞大亮,厉小梅,王喜梅,等.共刺激分子B7-H4在狼疮性肾炎肾组织及血清中的表达[J].安徽医学,2012,33(7):793-796. |
| [17] | Kremer M,Hines IN,Milton RJ,et al.Favored T helper 1 response in a mouse model of hepatosteatosis is associatedwith enhanced T cell-mediated hepatitis[J].Hepatology,2006,44(1): 216-227. |
| [18] | Abadi YM,Jeon H,Ohaeqbulam KC,et al.Host b7 x promotes pulmonary metastasis of breast cancer[J].J Immunol,2013,190(7):3806-3814. |
| [19] | Louis H,Le Moine A,Flamand V,et al.Critical role of interleukin 5 and eosinophils in concanavalin A-induced hepatitis in mice[J].Gastroenterology,2002,122(7): 2001-2010. |
| [20] | Xu JF,Xiao H,Hu GY,et al.Ectopic B7-H4-Ig expression attenuates concanavalin A-induced hepatic injury[J].Clin Immunol,2010,136(4):30-41. |




