扩展功能
文章信息
- 齐慧慧, 陈冰, 陈晓娜, 王瑶琪, 佟青玥, 孙丽光, 杨永广
- QI Huihui, CHEN Bing, CHEN Xiaona, WANG Yaoqi, TONG Qingyue, SUN Liguang, YANG Yongguang
- 几种成年小鼠胸腺上皮细胞分离和富集方法效果的比较
- Comparison of effects between adult murine TEC isolation and enrichment methods
- 吉林大学学报(医学版), 2016, 42(01): 24-30
- Journal of Jilin University (Medicine Edition), 2016, 42(01): 24-30
- 10.13481/j.1671-587x.20160106
-
文章历史
- 收稿日期: 2015-09-16
2. 吉林大学中日联谊医院麻醉科, 吉林长春 130033;
3. 吉林大学公共卫生学院营养与食品卫生学教研室, 吉林长春 130021;
4. 吉林大学第一医院甲状腺外科, 吉林长春 130021
2. Department of Anesthesia, China-Japan Union Hospital, Jilin University, Changchun 130033, China;
3. Department of Nutrition and Food Hygiene, School of Public Health, Jilin University, Changchun 130021, China;
4. Department of Thyroid Surgery, First Hospital, Jilin University, Changchun1 30021, China
胸腺上皮细胞(thymic epithelial cells,TECs)是一群不表达泛造血细胞标志CD45而表达上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)标志的胸腺内非胸腺细胞,也是胸腺基质细胞(thymic stromal cells,TSCs)中最重要的细胞型[1]。TECs有2个重要的亚群 ——皮质TECs(cortical TECs,cTECs)和髓质TECs(medullary TECs,mTECs),其栖居于胸腺的不同部位,有序指导胸腺细胞的发育过程[2]。尽管TECs功能很重要,但由于成年小鼠胸腺会发生增龄性萎缩,使得功能性TECs被脂肪细胞增龄性替代,并且其本身就不足胸腺中细胞结构的1%,加之缺乏合适的技术来纯化、量化这个稀少而离散的细胞群[3],导致对成年小鼠TECs的功能以及分化能力的了解有限。目前,已有研究[4, 5, 6]表明:胶原酶和Liberase可以分离胸腺组织中细胞与细胞、细胞与基质间的网络交联,得到TSCs和胸腺细胞的单细胞悬液,随后通过流式细胞术即可识别离散的TECs。另有研究[7, 8]表明:免疫磁珠分选法(magnetic activated cell sorting,MACS)和密度梯度离心法可以通过富集TSCs而间接实现对TECs的富集。本研究首先对比了新型的LiberaseTM与传统的collagenase Ⅴ对成年小鼠胸腺的消化能力(包括消化时间、细胞活力以及TSCs的产量),然后比较了MACS、Percoll与Ficoll 3种富集方法对成年小鼠TECs的富集效果,旨在探寻高效且具有准确体内代表性的TECs分离、富集方法,为后续Real-time PCR和分子谱系分析等实验提供高纯度的TECs。
1 材料与方法 1.1 实验动物、主要试剂和仪器27只SPF级BABL/c小鼠,6~8周龄,购自北京维通利华实验动物技术有限公司,动物许可证号:CCXK(京)-2012-0001,在吉林大学第一医院转化医学研究院实验动物中心无菌饲养。混合胶原酶LiberaseTM购自德国罗氏公司,collagenase Ⅴ、DNaseⅠ和Ficoll淋巴细胞分离液购自德国Sigma公司,新生牛血清和DMEM培养基购自美国Gibco公司,小鼠anti-CD45-APC-Cy7、anti-CD45-APC、anti-EpCAM-FITC、anti-I-A/I-E-PerCP、anti-Ly51-AF647、anti-CD4-FITC、anti-CD4-AF647及PI抗体购自美国Biolegend公司,MACS anti-APC-MicroBeads 购自美国BD公司,MACS LD柱购自德国Miltenyi公司,Percoll分层液(ρ=1.130 g·mL-1)购自北京索莱宝公司。MACS分选器购自德国Miltenyi公司,FACS Canto型流式细胞仪购自美国BD公司。
1.2 实验分组由于单个成年小鼠胸腺中TECs含量较为稀少,所以实验采用汇集胸腺法(pooled thymus)提取TECs,每个实验组汇集3只小鼠胸腺。实验分为TECs的分离实验与富集实验。分离实验根据酶的种类与工作浓度分为5个分离组:1.0 g·L-1collagenase Ⅴ组和0.5、0.7、1.0及2.0 U·mL-1Liberase TM组。采用分离实验得出的最适酶分离浓度(Liberase TM 1.0 U·mL-1)进行TECs的分离与富集。富集实验分为4组:未进行富集处理的对照组和MACS、Percoll及Ficoll富集组。
1.3 组织处理小鼠经脱颈处死后,浸入75%酒精消毒1 min,沿着胸骨边缘剪断两侧肋骨,上掀胸骨,取出胸腺。在PBS缓冲液中先剔除血管及结缔组织,随后将胸腺剪成小块,用注射器背部轻轻挤压组织,允许胸腺细胞释放,反复更新PBS、挤压胸腺直至溶液变澄清。
1.4 细胞悬液制备将处理过的组织剪成小于1 mm×1 mm×1 mm小块放入15 mL离心管中,加入新鲜配制的3 mL 消化酶(LiberaseTM或collagenase Ⅴ)工作液,45°角置于37℃振荡水浴中温和作用15 min,随后通过40 μm细胞过滤网将上清液过滤到冰上的终止液中(含10%新生牛血清的DMEM培养基)终止消化过程,再向残余组织中加入3 mL 消化酶工作液,37℃水浴继续震荡作用15 min,再将上清液过滤到终止液中,如若仍有组织残余,重复消化过程,直至组织消化完全,全过程一般不超过60 min。将含消化细胞的终止液500 g、4℃离心10 min,弃上清,加入适量的FACS缓冲液(10 mL 10% 叠氮钠和1 g 牛血清白蛋白于1 L D-Hank’s 溶液中)重悬,即为消化物,待用。
1.5 分离实验1.0 g·L-1collagenase Ⅴ组和0.5、0.7、1.0及2.0 U·mL-1Liberase TM组分别按照相应的酶工作浓度对胸腺组织进行消化,方法同1.4,记录消化时间,得到的消化物经细胞计数后,直接用于流式抗体染色。
1.6 富集实验①Percoll富集法:参考Stoeckle等[8]的实验方法,并采用1.5中得到的最适酶消化浓度(Liberase TM 1.0 U·mL-1)对汇集胸腺进行消化;于所得消化物中加入2 mL Percoll工作液(2.96 mL未稀释Percoll溶液和0.6 mL 1.5 mol·L-1 的氯化钠于2.44 mL 蒸馏水中,终密度ρ=1.07 g·mL-1),充分混匀后,沿着管壁缓慢加入10 mL DMEM培养基,避免2种液体相混,3500 g、升速降速调为0、4℃离心35 min。离心后小心收集白膜层(即低密度层细胞),加入10 mL DMEM,300 g、4℃离心10 min,弃上清,加入适量FACS缓冲液,细胞计数,随后进行流式抗体染色。②MACS富集法:由于CD45是胸腺细胞的泛表达标志,参考Seach等[9]的方法,采用anti-CD45-APC抗体与anti-APC MicroBeads 结合的两步MACS法,清除大量的CD45+ 胸腺细胞,富集TSCs。首先,按照1.5中得到的最适酶消化浓度(LiberaseTM 1.0 U·mL-1)对汇集胸腺进行消化,并对消化物进行计数;按每1×107个细胞加入100 μL MACS缓冲液(含0.5%牛血清白蛋白和2 mmol·L-1EDTA的PBS溶液)和10 μL anti-CD45-APC抗体,混匀后4℃避光孵育10 min。加入孵育体系10倍体积的MACS缓冲液,300 g、4℃离心10 min。弃上清,按每1×107个细胞加入80 μL MACS缓冲液重悬细胞后,再按每1×107个细胞加入20 μL anti-APC MicroBeads,混匀,4℃,避光15 min。加入孵育体系10倍体积的MACS缓冲液,洗去未结合的抗体,300 g、4℃离心10 min。按每1×108个细胞加入500 μL MACS缓冲液等待磁珠分选。根据所得的细胞数及收集物为CD45-TSCs等情况,选择LD柱(最多容纳5 × 108个细胞)。经过润洗柱子、细胞上样和洗柱3个过程后,得到纯化的TSCs,细胞计数后,等待流式抗体染色。③Ficoll富集法:参考Scoville等[10]的方法,并按照1.5中得到的最适酶消化浓度(LiberaseTM 1.0 U·mL-1)对汇集胸腺进行消化,消化物用5 mL DMEM培养基重悬;随后,将重悬液沿管壁缓慢加到2.5 mL Ficoll分离液的上层,避免2种液体相混,400 g,升速降速调为0,室温离心20 min。离心后小心收集白膜层,加入9 mL DMEM,2000 r·min-1、4℃离心5 min,弃上清,加入适量FACS缓冲液,细胞计数后,进行流式抗体染色。
1.7 流式细胞术检测以各组待测的样品细胞,按每1×106个细胞加入10 μL anti-CD45-APC-Cy7(或anti-CD45-APC)和10 μL anti-EpCAM-FITC抗体,而富集实验中对照组与Percoll组的样品细胞还需加入10 μL anti-I-A/I-E-PerCP和10 μL anti-Ly51-AF647抗体,混匀,4℃避光作用30 min。加入1 mL FACS缓冲液,1650 r·min-1、4℃离心5 min,洗去未结合抗体。弃上清,加入300 μL FACS缓冲液重悬等待流式细胞仪检测(PI抗体于流式细胞仪上机前加入)。对于分离实验,流式细胞术主要检测各分离组所得的单细胞悬液中细胞活力(PI-)以及TSCs(CD45-)比例(即TSCs产量)。对于富集实验,主要检测富集后各组的细胞活力、TSCs比例以及TSCs中TECs(EpCAM+)比例。对照组与Percoll组进行cTECs(Ly51+ MHCⅡ+)和mTECs(Ly51- MHCⅡ+)比例的检测。
1.8 统计学分析采用SPSS17.0软件进行统计学分析。分离实验中消化时间、细胞活力、TSCs产量和富集实验中细胞活力、TSCs及TECs比例均以x±s表示,多组间样本均数比较采用单因素方差分析,两两比较采用SNK-q检验,以α= 0.05为检验水准。
2 结 果 2.1 5个分离组的消化时间、细胞活力以及TSCs产量①消化时间:4个LiberaseTM分离组所用的消化时间明显少于 1.0 g·L-1collagenase Ⅴ组(P<0.05或P<0.01);在4个Liberase TM分离组中,1.0 U·mL-1LiberaseTM组的消化时间明显少于 0.5 U·mL-1LiberaseTM组(P<0.05),而与 0.7和2.0 U·mL-1LiberaseTM组比较差异无统计学意义(P>0.05)。②细胞活力:4个LiberaseTM分离组的细胞活力均较高,但组间比较差异无统计学意义(P>0.05),但其均明显高于1.0 g·L-1collagenase Ⅴ 组(P<0.01)。3③TSCs的产量: 1.0 g·L-1collagenase Ⅴ组与1.0和 2.0 U·mL-1LiberaseTM组中TSCs的产量比较差异无统计学意义(P>0.05),但上述3组TSCs的产量均明显高于 0.5和0.7 U·mL-1LiberaseTM组(P<0.05或P<0.01)。见图 1和表 1。
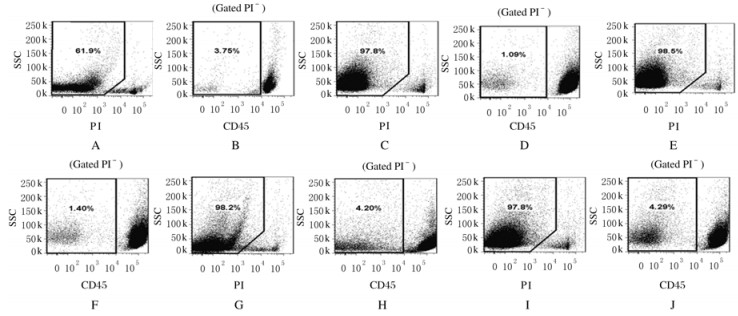
|
| A,B: 1.0 g·L-1 collagenase Ⅴ group;C,D: 0.5 U·mL-1LiberaseTM group;E,F: 0.7 U·mL-1LiberaseTM group;G,H: 1.0 U·mL-1LiberaseTM group;I,J: 2.0 U·mL-1LiberaseTM group;A,C,E,G, I: Cell viability (percentage of live cells);B,D,F,H,J: Yield of TSCs (percentage of TSCs in live cells). 图1 流式细胞术检测5个分离组细胞产生TSCs的能力 Fig.1 Abilities of TSCs production in five isolation groups detected by FACS |
| (n=3,x±s) | |||
| Group | Digestion time(t/min) | Cell viability (η/% ) | TSCs(η/%) |
| *P<0.05,** P<0.01 compared with 1.0 g·L-1 collagenase Ⅴ group;△P<0.05,△△P<0.01 compared with 1.0 U·mL-1LiberaseTM group. | |||
| Collagenase Ⅴ( 1.0 g·L-1 ) | 54.33±3.48 | 70.77±4.45 | 4.04±0.54 |
| LiberaseTM (U·mL-1 ) | |||
| 0.5 | 42.33±1.45*△ | 97.50±0.51** | 1.15±0.06**△△ |
| 0.7 | 39.33±1.76* | 96.53±1.22** | 1.87±0.23*△△ |
| 1.0 | 36.33±1.29** | 96.30±0.44** | 4.27±0.28 |
| 2.0 | 36.00±2.30* | 95.83±1.09** | 3.99±0.19 |
Percoll、MACS、Ficoll富集组和对照组的细胞活力均较高,且组间比较差异均无统计学意义(P>0.05),说明3种富集方法对细胞的破坏均较小。与对照组比较,MACS和Percoll富集组中TSCs比例明显增加(P<0.01),但Ficoll富集组中TSCs比例明显降低(P<0.01)。MACS富集组TSCs比例明显高于Percoll富集组(P<0.01)。
Percoll和Ficoll富集组TSCs中TECs比例均高于对照组和MACS组(P<0.01)。根据活细胞中TSCs比例及其TECs的比例可知活细胞中TECs所占的比例(即富集效果)。与对照组比较,3个富集组活细胞中TECs比例均明显增加(P<0.05或 P<0.01),其中Percoll组TECs比例明显高于MACS和Ficoll组(P<0.01)。见图 2和表 2。
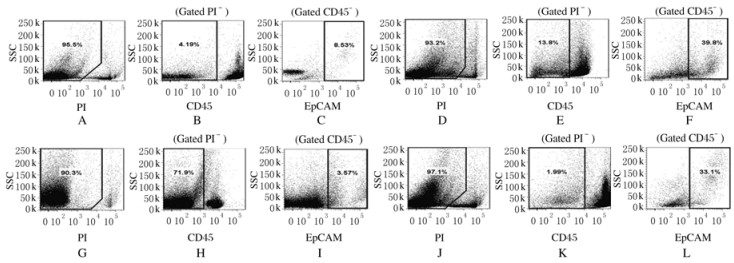
|
| A-C: Control group;D-F: Percoll enrichment group;G-I: MACS enrichment group;J-L: Ficoll enrichment group;A,D,G,J: Cell viability (percentage of live cells);B,E,H,K: Percentage of TSCs in live cells;C,F,I,L: Percentage of TECs (EpCAM+ cells) in TSCs. 图2 流式细胞术检测3种TECs富集方法效果 Fig.2 Effects of three TECs enrichment methods detected by FACS |
| (n=3,x±s,η/%) | ||||
| Group | Cell viability | TSCs in live cells | TECs (EpCAM+ cells)in TSCs | TECs in live cells |
| *P<0.05,** P<0.01 compared with control group;△P<0.01 compared with Percoll enrichment group. | ||||
| Control | 95.33±0.21 | 4.27±0.28 | 8.78±0.12 | 0.37±0.02 |
| Percoll enrichment | 94.67±0.97 | 11.86±1.10 ** | 40.20±2.53** | 4.69±0.33** |
| MACS enrichment | 92.87±1.63 | 71.03±0.82**△ | 2.99±0.30**△ | 2.12±0.24**△ |
| Ficoll enrichment | 96.03±1.16 | 1.61±0.26**△ | 37.83±2.60** | 0.59±0.06*△ |
进一步分析Percoll富集组TECs 2个亚群cTECs和mTECs的表达情况,Percoll富集组中cTECs的比例约为(35.70±1.21)%,与对照组[(28.07±7.47)%]比较差异无统计学意义(P>0.05)。同样,Percoll富集组和对照组中mTECs的比例分别为(54.93±3.26)%和(43.03±13.58)%,组间比较差异也无统计学意义(P>0.05)。此外,对照组和Percoll富集组中cTEC/mTEC的百分比分别为(70.33±10.73)%和(65.33±3.18)%,组间比较差异无统计学意义(P>0.05),说明Percoll富集后并未对TECs亚群细胞的比例产生影响。见图 3。
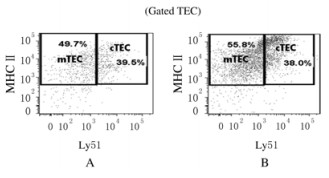
|
| A: Percentage of mTECs (Ly51- MHCⅡ+) and cTECs (Ly51+ MHCⅡ+) from TEC population in control group; B: Percentage of mTECs and cTECs from TEC population in Percoll enrichment group. 图3 流式细胞术检测Percoll富集组和对照组中cTECs和mTECs的百分比 Fig.3 Percentages of cTECs and mTECs in control and Percoll enrichment groups detected by FACS |
与其他上皮细胞不同,TECs以独特的三维网状结构的形式存在,能够极大限度地允许胸腺细胞在其内发生迁移和细胞作用[11],对胸腺细胞的发育以及自身免疫耐受的诱导都起着尤为重要的作用。而TECs构成的胸腺微环境是异源的,使得组织学的方法无法准确定量出TECs的多样性[3]。1982年,Kyewski等[12]开创了用酶消化胸腺组织的方法,首次得到了TSCs和胸腺细胞的混合物。2002年,Gray等[13]通过利用泛造血标志CD45,准确定义出TSC细胞群。同年,Anderson等[14]利用流式细胞术成功纯化出重要的TECs亚群。尽管这些研究为TECs的研究提供了重要信息,但是由于成年小鼠TECs的低频性以及之间的紧密作用,使得其分离纯化过程一直是研究的重点[15]。本研究优化了传统的分离富集协议,有效地富集了成年小鼠TECs,并将细胞活力丢失降到了最低。本实验结果表明:经典消化浓度1.0 g·L-1的collagenase Ⅴ对胸腺组织的消化时间过长,致使细胞活力大量丢失,加之有文献报道[16]胶原酶消化体系很不稳定,常常会导致同生小鼠TSCs的细胞数以及比例变化不定,因此胶原酶对胸腺组织的消化能力欠佳;而LiberaseTM属于温和的混合型胶原酶[17],在实验中显示出较快、较完全和较稳定的胸腺消化能力,并且对忽略不计的外毒素含量可以将细胞活力丢失降到最低,得到活性更高的TSCs。尽管LiberaseTM的传统消化浓度是0.5 U·mL-1[3, 5, 9],但本研究发现:将LiberaseTM的消化浓度增加至1.0 U·mL-1时,TSCs的产量增加;然而,当工作浓度超过1.0 U·mL-1时,TSCs的产量不再增加。因此,1.0 U·mL-1是LiberaseTM消化成年小鼠胸腺组织的最适工作浓度。此外,在TECs分离的过程中,建议注意以下4点:①提取胸腺后要立即进行处理,确保在处理组织的过程中剔除血块及结缔组织,否则在流式细胞术检测过程中会出现自发荧光;②LiberaseTM 和collagenase Ⅴ工作液需要现用现配,否则酶易失活,影响TSCs的产量;③对于汇集胸腺来说,要根据胸腺数量,选用最适的酶溶液体积,首次消化时间段不宜过长,否则TSCs的产量会降低;④在流式细胞术检测过程中确保FSC∶SSC门中要包含淋巴细胞群,否则会漏掉许多淋巴细胞大小的TECs。总之,有效的分离方法可以确保TECs最适的细胞产量及其准确的体内代表性。
本研究的富集实验结果显示:与对照组比较,Percoll、MACS和Ficoll富集组均可以显著增加活细胞中TECs的比例,并且3个富集组细胞活力均较高,说明其富集方法都比较温和,对细胞的伤害较小。MACS富集组虽然可以大量富集TSCs,但是这群TSCs中EpCAM标志的表达丰度较低;Ficoll富集组虽然可以有效地富集TSCs中的TECs,但是富集过程可能会导致大量的TSCs丢失;而Percoll富集组显示出较综合的富集优势,可以同时富集TSCs与TECs,而且所富集的TECs是3个富集组中比例最高的。因此,根据TECs的富集效果,排序应该是:Picoll法 > MACS法 > Ficoll法。此外,Percoll富集后可以捕获高纯度的异源cTECs和mTECs亚群,且未影响2个亚群的比值,甚至更为脆弱的cTECs亚群的比例也仍接近于对照组,说明Percoll富集过程温和,确保了亚群表型的准确性、无偏差性,对后续的实验操作十分有利。
然而,目前的研究仍以MACS法为主要的TECs富集方法[7],本研究证实了MACS法虽可以获得高纯度的TSCs,但是TSCs中TECs的比例较低,而Percoll法可以互补地富集TSCs中的TECs。因此,如果将MACS与Percoll富集法结合使用,可能很大程度地实现对TECs的富集。首先,建议结合方法采用LiberaseTM 1.0 U·mL-1消化胸腺组织;其次,可以先进行MACS分选除去大量的CD45+ 胸腺细胞,富集TSCs,再将得到的TSCs进行Percoll富集,这样可以大大提高TECs的纯度。但是,这个结合方法可否实现无偏差富集,是否引起TECs丢失加倍甚至影响cTECs和mTECs的比例,仍有待深入研究。
综上所述,LiberaseTM非常适用于TECs的分离过程,且1.0 U·mL-1是其分离成年小鼠TECs的最适Liberase工作浓度。此外,本研究中的3种TECs富集方法都可以明显富集TECs且对细胞的破坏均较小,其中Percoll富集法是3种方法中最有效的,而且并未改变TECs亚群的比例,进而可以为下游如Real-time PCR、基因谱系分析等高精度的研究提供高纯度的TECs。
| [1] | Rinke de Wit TF,Izon DJ,Revilla C,et al. Expression of tyrosine kinase gene in mouse thymic stromal cells[J]. Int Immunol,1996,8(11):1787-1795. |
| [2] | Sun L,Li H,Luo H,et al. Thymic epithelial cell development and its dysfunction in human diseases[J]. Biomed Res Int,2014,2014:206929. |
| [3] | Jain R,Gray DH. Isolation of thymic epithelial cells and analysis by flow cytometry[J]. Curr Protoc Immunol,2014.doi: 10.1002/0471142735.im0326s107. |
| [4] | McLelland BT,Gravano D,Castillo J,et al. Enhanced isolation of adult thymic epithelial cell subsets for multiparameter flow cytometry and gene expression analysis[J]. J Immunol Methods,2011,367(1/2):85-94. |
| [5] | Seach N,Wong K,Hammett M,et al. Purified enzymes improve isolation and characterization of the adult thymic epithelium[J]. J Immunol Methods,2012,385(1/2):23-34. |
| [6] | 李倩如,杜 焱,苏艳宾,等. 人CK8&18阳性胸腺上皮细胞对脐血CD34+细胞向T细胞分化的影响[J]. 中国免疫学杂志, 2011(3):200-203. |
| [7] | Gray DH,Fletcher AL,Hammett M,et al. Unbiased analysis,enrichment and purification of thymic stromal cells[J]. J Immunol Methods,2008,329(1/2):56-66. |
| [8] | Stoeckle C,Rota IA,Tolosa E,et al. Isolation of myeloid dendritic cells and epithelial cells from human thymus[J]. J Vis Exp: JoVE,2013(79):e50951. |
| [9] | Seach N,Hammett M,Chidgey A. Isolation,characterization,and reaggregate culture of thymic epithelial cells[J]. Methods Mol Biol,2013,945:251-272. |
| [10] | Scoville SD,Keller KA,Cheng S,et al. Rapid column-free enrichment of mononuclear cells from solid tissues[J]. Sci Rep,2015,5:12490. |
| [11] | Irla M,Guenot J,Sealy G,et al. Three-dimensional visualization of the mouse thymus organization in health and immunodeficiency[J]. J Immunol,2013,190(2):586-596. |
| [12] | Kyewski BA,Rouse RV,Kaplan HS. Thymocyte rosettes: multicellular complexes of lymphocytes and bone marrow-derived stromal cells in the mouse thymus[J]. Proceed Natl Acad Sci USA,1982,79(18):5646-5650. |
| [13] | Gray DH,Chidgey AP,Boyd RL. Analysis of thymic stromal cell populations using flow cytometry[J]. J Immunol Methods,2002,260(1/2):15-28. |
| [14] | Anderson MS,Venanzi ES,Klein L,et al. Projection of an immunological self shadow within the thymus by the aire protein[J]. Science,2002,298(5597):1395-1401. |
| [15] | Williams KM,Mella H,Lucas PJ,et al. Single cell analysis of complex thymus stromal cell populations: rapid thymic epithelia preparation characterizes radiation injury[J]. Clin Transl Sci,2009,2(4):279-285. |
| [16] | Xing Y,Hogquist KA. Isolation,identification,and purification of murine thymic epithelial cells[J]. J Vis Exp,2014(90):e51780. |
| [17] | Lierman S,Tilleman K,Cornelissen M,et al. Follicles of various maturation stages react differently to enzymatic isolation: a comparison of different isolation protocols[J]. Reprod Biomed Online,2015,30(2):181-190. |




