扩展功能
文章信息
- 刘娟娟, 李鹏, 董伟, 冯晓洁, 温黎明, 孙红, 戚孟春
- LIU Juanjuan, LI Peng, DONG Wei, FENG Xiaojie, WEN Liming, SUN Hong, QI Mengchun
- 唑来膦酸对破骨细胞分化中钙调蛋白依赖性激酶Ⅱ和Ⅳ基因表达的影响
- Effects of zoledronate on gene expressions of calmodulin- dependent kinase Ⅱ and Ⅳ in osteoclast differentiation
- 吉林大学学报(医学版), 2016, 42(01): 19-23
- Journal of Jilin University (Medicine Edition), 2016, 42(01): 19-23
- 10.13481/j.1671-587x.20160105
-
文章历史
- 收稿日期: 2015-05-23
2. 华北理工大学基础医学院病理学教研室, 河北唐山 063000
2. Department of Pathology, College of Basic Medical Science, North China University of Science and Technology, Tangshan 063000, China
破骨细胞(osteoclasts,OC)在牙周炎、骨质疏松和骨肿瘤等许多疾病的骨破坏中发挥着关键作用[1]。破骨细胞分化离不开Ca2+-calmodulin-NFATc1(nuclear factor of activated T-cells1)信号通路的调节;而钙调蛋白依赖性激酶(Ca2+/calmodulin-dependent protein kinase,CaMK)Ⅱ、CaMKⅣ则是Calmodulin下游2个关键信号分子,通过调节NFATc1的表达和转录,影响OC的最终形成和功能,对破骨细胞的终末分化和功能的发挥起到重要作用[2, 3]。唑来磷酸(zoledronate,ZOL)广泛用于骨过度吸收性疾病的治疗,主要通过抑制OC生成及功能发挥作用[4],但Ca2+信号及CaMKⅡ和CaMKⅣ是否在其中发挥作用目前尚不清楚。本研究在OC分化的多核化阶段应用ZOL处理,检测其对OC生成及CaMKⅡ和CaMKⅣ基因表达的影响,探讨Ca2+信号通路在ZOL抑制OC生成中的作用。
1 材料与方法 1.1 细胞和主要试剂小鼠白血病单核巨噬细胞株RAW264.7细胞,由中国科学院典型培养物保藏委员会细胞库提供。核因子κB受体激活蛋白配体(receptor activatior of nuclear factor κB ligand,RANKL)和胎牛血清,美国Biovision公司;DMEM培养基,美国Hyclone公司;抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphotase,TRAP)染色试剂盒,美国Sigma公司;兔抗鼠CaMKⅡ和CaMKⅣ多克隆抗体,美国Santa Cruz公司;PCR试剂盒,日本Takara公司。
1.2 细胞分组和处理RAW264.7细胞分为对照组和ZOL组,2组细胞均用50 μg·L-1的RANKL诱导5 d,使细胞向OC分化。ZOL组细胞在RANKL诱导1 d后,用1×10-6mol·L-1 ZOL处理2 d[5]。
1.3 破骨细胞生成和功能检测①TRAP染色:将RAW264.7细胞以1×103 cm-2接种于载玻片,培养过夜;50 μg·L-1RANKL诱导5 d,收获细胞,按照试剂盒说明进行染色,200倍光镜下随机选取6个视野,计数TRAP+多核细胞数目(胞核≥3个),每组检测5个细胞爬片[5]。②骨吸收陷窝检测:用新鲜离体制备牙本质磨片,直径约5 mm、厚度0.4 mm,共10片,高温高压灭菌;细胞接种密度为1×103 cm-2。细胞收获后进行扫描电镜(SEM)观察,500倍下每个磨片上选取6个视野,测量吸收陷窝总数目及总面积,取平均值,作为该磨片的吸收陷窝数目及面积,每组检测5个牙本质磨片[5]。
1.4 CaMKⅡ和CaMKⅣ基因表达检测①免疫荧光化学检测:RAW264.7细胞以1×103cm-2接种于载玻片上,4%多聚甲醛固定30 min后,用0.4%的TritonX-100 PBS室温孵育15 min,兔抗鼠一抗4℃过夜,异硫氰酸荧光素(FITC)标记的羊抗兔IgG为二抗,37℃避光孵育90 min,碘化丙啶(PI)复染胞核,甘油封片,激光共聚焦显微镜观察,每组检测3个细胞爬片,实验重复3次。②Real-time PCR检测:Trizol提取细胞总RNA,反转录合成cDNA,在荧光定量PCR仪上进行检测。CaMKⅡ,上游引物[HQ]5'-TGGTGGAACAAGCCAAGAGT-3',下游引物5'-AGGCTCAACAAGCCAAGAGT-3';CaMKⅣ,上游引物5'-GGGGAAGCATGATATGCACT-3',下游引物5'-CCACCAAAGGCTGAGAATGT-3';β-actin,上游引物5'-GTTG GAGCAAACATCCCCCA3',下游引物5'-CGCGACCATCCTCCTCTTAG-3'。反应条件:95℃、30s,95℃、5s,60℃、15s,40个循环。应用Rotor-Gene软件处理所得数据,每组设3个复孔,实验重复3次。③Western blotting法检测:提取细胞总蛋白,测定蛋白浓度,加入上样缓冲液后,煮沸变性,蛋白上样后,凝胶电泳,转膜,室温封闭1 h,一抗4℃过夜,二抗37℃孵育2 h,ECL显色仪上显色1 min。用Image-Pro Plus分析软件检测膜上条带吸光度(A)值,代表蛋白表达水平。每组设3个复孔,实验重复3次。
1.5 统计学分析采用SPSS13.0软件进行统计学分析。OC数、骨吸收陷窝数和CaMKⅡ及CaMKⅣmRNA和蛋白表达水平以x ±s表示,组间比较采用两独立样本t检验。以α=0.05为检验水准。
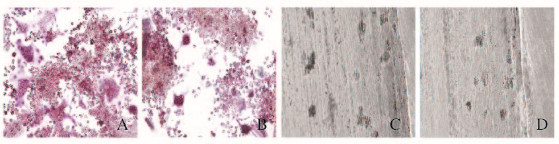
2 结 果 2.1 各组OC生成和骨吸收情况RANKL诱导5d,对照组和ZOL组均出现TRAP+多核OC(胞浆红染)(图 1A和1B,见插页二);与对照组比较,ZOL组多核OC明显减少(P<0.01),ZOL组较对照组减少了50.5%(表 1)。SEM观察,对照组和ZOL组牙本质磨片上均出现不同程度的吸收陷窝(图 1C和D,见插页二);与对照组比较,ZOL组吸收陷窝的数目和面积均明显减少(P<0.05),分别减少了46.6%和56.2%(表 1)。
| (n=5,x ±s) | |||
| *P<0.05,** P<0.01 compared with control group. | |||
| Group | Number of osteoclasts | Size of resorption lacunaes | Area of resorption lacunaes(A/μm2) |
| Control | 66.6±3.2 | 86.0±9.2 | 9 418.3±1 260.8 |
| ZOL | 33.0±1.0** | 46.0±3.5* | 4 125.9±674.8* |
|
| A,C:Control group;B,D:ZOL group;A,B:×200;C,D:×500. 图1 破骨细胞TRAP染色(A,B)及牙本质磨片吸收陷窝扫描电镜观察(C,D) Fig.1 TRAP staining of osteoclasts(A,B) and dentin resorption lacunae observed by scanning electronic microscope(C,D) |
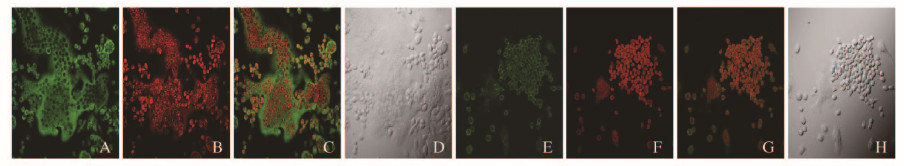
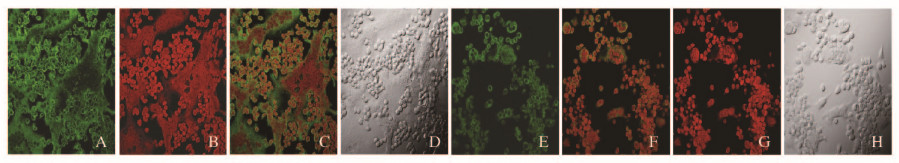
CaMKⅡ和CaMKⅣ在2组OC及其前体细胞胞浆中均呈阳性表达(绿色),而胞核(红色)不表达(图 2和3,见插页二),ZOL组表达强度明显弱于对照组。定量分析结果表明:ZOL组CaMKⅡ和CaMKⅣ荧光强度分别为74 642.5±3 524.2和151 415.7±22 496.7,明显低于对照组的247 209.2±30 868.2和249 706.7±29 611.5(P<0.05),分别下降了69.8%和39.4%。
|
| A, E: CaMKⅡ labeled by FITC (green); B, F:Cell nuclei labeled by PI (red); C,G: Merged image; D,H:Normal vision without fluorescence 图2 免疫荧光化学检测对照组(A-D)和ZOL组(E-H)破骨细胞中CaMKⅡ 的表达(LSCM,×200) Fig.2 Detection of CaMKⅡ expression in osteoclasts in control group (A-D) and ZOL group(E-H) detected by immunofluorescence chemistry(LSCM,×200) |
|
| A,E:CaMKⅣ labeled by FITC (green); B,F: Cell nuclei labeled by PI (red); C,G:Merged image;D,H:Normal vision without fluorescence 图3 免疫荧光化学检测对照组(A-D)和ZOL组(E-H)破骨细胞中CaMKⅣ的表达(LSCM,×200) Fig.3 Detection of CaMKⅣ expressions in osteoclasts in control group (A-D) and ZOL group (E-H) detected by immunofluorescence chemistry(LSCM,×200) |
ZOL组CaMKⅡ和CaMKⅣ的mRNA表达水平分别为0.61±0.02和0.48±0.03,与对照组(均为1.00±0.00)比较分别下降了39.3%和51.7%(P<0.01)。
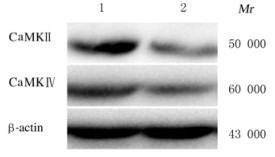
2.4 Western blotting法检测CaMKⅡ和CaMKⅣ蛋白表达水平ZOL组CaMKⅡ和CaMKⅣ蛋白表达水平分别为82.9±13.6和85.2±6.9,对照组分别为201.7±17.2和160.3±13.3。与对照组比较,ZOL组CaMKⅡ和CaMKⅣ蛋白表达水平分别下降了58.9%和46.8%(P<0.05)。见图 4。
|
| Lane 1:Control group;Lane 2:ZOL group. 图4 Western blotting法检测OC中CaMKⅡ和CaMKⅣ蛋白表达电泳图 Fig.4 Electrophoregram of expressions of CaMKⅡ and CaMKⅣ in OC by Westernblotting method |
临床上许多骨过度吸收性疾病,如骨质疏松、牙周炎、种植体周围炎和骨肿瘤等,均与OC的数目及活性异常有关[1];ZOL作为治疗骨过度吸收性疾病的主要药物,主要通过抑制OC分化及功能来发挥作用[4]。在本研究中,2组细胞经RANKL诱导5 d后,均有TRAP+多核OC形成,且具备骨吸收功能;但ZOL组在ZOL处理2d后,TRAP+多核OC生成及骨吸收功能均明显受到抑制,从而进一步证实了ZOL对OC的抑制作用。需要指出的是,ZOL加入的时间为RANKL诱导第2~3天,此时正是单核OC向多核OC分化,即细胞多核化阶段[6],因而上述结果证实:ZOL可以在OC分化早期,即OC多核化阶段发挥对OC的抑制作用,从而影响OC的生成及后期的骨吸收功能。
国内外学者[4]普遍认为:含氮双膦酸盐是通过甲羟戊酸途径来发挥对OC的抑制作用。然而,双膦酸盐能否通过其他信号途径,如Ca2+-calmodulin-NFATc1信号途径,来发挥对OC的抑制作用,目前尚不清楚。
Ca2+是胞内重要第二信使,参与许多信号分子的调控,影响细胞的增殖、分化以及凋亡。国外学者研究[2, 3, 7, 8]发现:Ca2+-calmodulin-NFATc1信号通路对OC分化及骨吸收功能至关重要,该信号通路中许多关键分子基因表达异常会造成OC生成及骨吸收功能严重障碍。OC在RANKL刺激下,胞内Ca2+水平升高并诱发Ca2+低水平震荡(oscillation)[2, 7, 8];随后Ca2+与calmodulin结合,通过激活下游钙调磷酸酶(calcineurin)和CaMKs[7, 8, 9]来传递Ca2+信号,并最终活化NFATc1,使之异位进入细胞核内,调控许多破骨细胞特异性基因的表达,对OC的生成和功能发挥着至关重要的作用[7]。本课题组前期研究[5, 10, 11, 12]发现:ZOL在OC分化中除可明显下调Ca2+信号上游分子Syk基因表达外,还可明显抑制下游分子NFATc1及破骨细胞特异基因TRAP、Atp6v0d2、Cathepsin K和integrinαvβ3等分子的表达,提示Ca2+-Calmodulin-NFATc1信号通路参与了ZOL对OC的抑制。
CaMKs是Calmodulin下游参与Ca2+信号传递的重要分子。研究[3, 6, 13]发现:对OC分化和骨吸收功能发挥重要作用的主要是CaMKⅡ和CaMKⅣ。CaMKⅡ与Ca2+/calmodulin结合后,获得2个特性[7, 8]:①对Calmodulin的亲和力提高1000倍,发生Calmodulin分子捕获;②在Calmodulin解离后,仍保持部分酶活性,在较长时间内调节细胞功能,拥有分子记忆功能(molecular memory)。因而,CaMKⅡ对Ca2+信号传递及OC分化的调控可能极为关键。Park-min等[14]研究显示:在OC分化中,RANKL可促使CaMKⅡ磷酸化;William等[15]也发现:RANKL明显提高了OC中CaMKⅡ的活性。提示CaMKⅡ在OC分化中可能发挥着要作用。
本研究中在OC分化的多核化阶段应用ZOL处理后,发现CaMKⅡ蛋白及mRNA水平均较对照组明显下降,提示CaMKⅡ参与了ZOL对OC生成和骨吸收功能的抑制;Sato等[13]研究也间接发现:CaMKⅡ在OC的分化过程中,不但在早期阶段起作用,而且在OC分化的晚期阶段和骨吸收功能中同样起到重要的调节作用。Chang等[6]发现:CaMKⅡ上有AP-1结合位点,CaMKⅡ可通过激活AP-1来增强NFATc1基因表达,调节OC分化,从而印证了CaMKⅡ-NFATc1在OC分化中的作用。需要指出的是,CaMKⅡ由ɑ、β、γ和δ4种基因编码,即有ɑ、β、γ和δ4种异构体,何种异构体参与了ZOL对OC的抑制,尚需进一步研究。
CaMKⅣ是目前唯一得到证实对OC分化和功能起调节作用的CaMKs,其基因敲除可使骨髓细胞向破骨细胞分化明显下降[3, 7]。研究[6, 13]发现:CaMKⅣ是通过CREB和AP-1发挥对OC分化的调节作用。CaMKⅣ可以使CREB发生磷酸化,进而诱导下游分子c-fos表达;而c-fos对OC分化中转录因子NFATc1的表达调控至关重要[13]。另外,CaMKⅣ基因上也有AP-1结合位点,CaMKⅣ可通过活化AP-1参与NFAT-c1表达调控,影响OC分化[6]。CaMKⅣ对OC的作用主要是在OC的多核化阶段及分化的晚期[3, 6, 13]。本研究中ZOL的早期处理在抑制CaMKⅡ的同时,也下调了CaMKⅣ的基因表达,提示CaMKⅣ也参与了ZOL对OC生成的抑制,这可能与其在OC多核化中的作用及对NFATc1-Atp6v0d2基因表达调节有关。
本研究结果表明:ZOL可明显抑制OC分化及骨吸收,并下调CaMKⅡ和CaMKⅣ基因表达,CaMKⅡ和CaMKⅣ可能是Ca2+信号中参与ZOL对OC抑制的重要信号分子。
| [1] | Edwards JR,Weivoda MM. Osteoclasts: malefactors of disease and targets for treatment[J]. Discov Med,2012,13(70):201-210. |
| [2] | Zhang L,McKenna MA,Said-Al-Naief N,et al. Osteoclastogenesis: the role of calcium and calmodulin[J]. Crit Rev Eukaryot Gene Expr,2005,15(1):1-13. |
| [3] | Yao CH,Zhang P,Zhang L. Differential protein and mRNA expression of CaMKs during osteoclastogenesis and its functional implications[J]. Biochem,Cell Biol,2012,90(4): 532-539. |
| [4] | Roelofs AJ,Thompson K,Ebetino FH,et al.Bisphosphonates:molecular mechanisms of action and effects on bone cells,monocytes and macrophages[J].Curr Pharm Des,2010,16(27):2950-2960. |
| [5] | 林珏杉,董 伟,张 鹏,等.唑来膦酸抑制破骨细胞分化中TRPV5、NFATc1的表达[J]. 南方医科大学学报,2014,34(9):1254-1258. |
| [6] | Chang EJ,Ha J,Huang H,et al. The JNK-dependent CaMK pathway restrains the reversion of committed cells duringosteoclast differentiation[J]. J Cell Sci,2008,121(Pt 15):2555-2564. |
| [7] | Negishi-Koga T,Takayanagi H. Ca2+-NFATc1 signaling is an essential axis of osteoclast differentiation[J]. Immunol Rev,2009,231(1):241-256. |
| [8] | Seales EC,Micoli KJ,McDonald JM. Calmodulin is a critical regulator of osteoclastic differentiation,function,and survival[J]. J Cell Biochem,2006,97(1):45-55. |
| [9] | Kim MS,Yang YM,Son A. RANKL-mediated reactive oxygen species pathway that induces long lasting Ca2+ oscillations essential for osteoclastogenesis[J]. J Biol Chem,2010,285(10): 6913-6921. |
| [10] | 王宏利,李 鹏,刘 强,等.唑来膦酸对破骨细胞生成及Syk基因表达的影响[J].第三军医大学学报,2013,35(16):1667-1670. |
| [11] | 张 鹏,刘 强,董 伟,等.唑来膦酸对成骨细胞单核巨噬细胞共培养体系中Atp6v0d2 基因表达及破骨细胞生成的抑制作用[J]. 实用口腔医学杂志,2013,29(6):766-769. |
| [12] | 林珏杉,董 伟,徐纯峰,等. 唑来膦酸对破骨细胞黏附及整合素αv、β3基因表达的影响[J]. 华西口腔医学杂志,2014,32(6):547-551. |
| [13] | Sato K,Suematsu A,Nakashima T,et al. Regulation of osteoclast differentiation and function by the CaMK-CREB pathway[J]. Nat Med,2006,12(12):1410-1416. |
| [14] | Park-Min KH,Ji JD,Antoniv T,et al. IL-10 suppresses calcium-mediated costimulation of receptor activator NF-kappa B signaling during human osteoclast differentiation by inhibiting TREM-2 expression[J]. J Immunol,2009,183(4):2444-2455. |
| [15] | Williams JP,Micoli K,McDonald JM. Calmodulin-an often ignored signal in osteoclasts[J]. Ann N Y Acad Sci,2010,1192(1):358-364. |




