扩展功能
文章信息
- 方芳, 方青, 赵良中, 李强, 陈爽, 张铎, 王立国
- FANG Fang, FANG Qing, ZHAO Liang-zhong, LI Qiang, CHEN Shuang, ZHANG Duo, WANG Liguo
- CD147通过Beclin-1抑制前列腺癌PC-3细胞自噬
- Iihibition of autophagy of prostate cancer PC-3 cells by CD147 with Beclin-1
- 吉林大学学报(医学版), 2016, 42(01): 15-18
- Journal of Jilin University (Medicine Edition), 2016, 42(01): 15-18
- 10.13481/j.1671-587x.20160104
-
文章历史
- 收稿日期: 2015-03-11
2. 吉林医药学院附属医院泌尿外科, 吉林吉林 132013
2. Department of Urinary Surgery, Affiliated Hospital, Jilin Medical College, Jilin 132013, China
自噬是指细胞在营养缺乏或应激条件下通过消化自身细胞内的蛋白、细胞器和胞质以渡过饥饿的行为,因此自噬被认为是细胞的一种保护性作用[1]。但过度的自噬最终将导致肿瘤细胞死亡,称为自噬性细胞死亡[2]。CD147是一种相对分子质量为50 000~60 000的单次跨膜糖蛋白,属于IgSF成员,在前列腺癌等多种恶性肿瘤细胞中表达增高[3]。CD147可促进肿瘤血管生成,促进细胞侵袭、增殖和药物抵抗进而促进肿瘤细胞生长[4, 5, 6]。研究[7]表明:CD147在肝癌细胞中能够抑制自噬的发生,防止过度自噬导致的细胞死亡,对肿瘤细胞具有保护作用。Beclin-1作为首个发现介导哺乳动物自噬的基因,在自噬启动过程中发挥关键作用。肿瘤细胞发生自噬后会出现2种不同的结果,一种是保护细胞防止周围环境带来的损害,另一种是启动自噬性细胞死亡程序[8]。目前,对于这2种不同结果的产生尚未发现特定的规律。自噬在肿瘤中的作用机制非常复杂,在同一或不同肿瘤的不同阶段发挥的作用不同。本研究旨在通过siRNA沉默CD147的表达,研究其对前列腺癌自噬生物学行为的影响。
1 材料与方法 1.1 主要试剂和仪器干扰CD147的激素非依赖性前列腺癌PC-3(PC-3/shCD147)细胞、PC-3/Scramble细胞和GFP-LC3质粒由吉林医药学院王立国博士提供[9]。DMEM-F12 培养液购自美国Gibco公司,胎牛血清购自美国Hyclone公司,LipofectamineTM2000和EBSS(Earle’s Balanced Salt Solution)缓冲液购自美国Invitrogen公司,兔抗LC-3、Beclin-1和β-actin抗体购自GeneTex公司,辣根过氧化物酶(HRP) 标记山羊抗兔IgG购自北京中杉金桥生物技术有限公司,RIPA、PMSF、BSA和Bradford法蛋白测定试剂盒均购自江苏省海门市碧云天生物技术研究所。荧光倒置显微镜(日本Olympus公司),化学发光检测仪(中国天能公司),二氧化碳细胞培养箱(美国Thermo公司)。
1.2 前列腺癌饥饿诱导自噬细胞模型建立PC-3细胞接种到6孔板,37℃、5%CO2条件下孵育4h后,细胞用EBSS缓冲液洗涤2次,加入2 mL EBSS缓冲液,在37℃、5%CO2条件下培养12 h,建立饥饿缺乏诱导的自噬细胞模型。
1.3 自噬检测用脂质体作为转染试剂将pGFP-LC3表达载体分别转染人前列腺癌PC-3/shCD147和PC-3/Scramble细胞(阴性对照组)中,应用荧光显微镜观察,如发生自噬则细胞内绿色荧光呈点状分布,否则呈现弥漫性绿色荧光。每组在高倍镜下计数50个含有点状分布绿色荧光的GFP-LC3细胞,每组设3个复孔,统计不同组细胞平均亮点数[10]。
1.4 Western blotting法检测Beclin-1和LC3蛋白表达水平取30 μg蛋白SDS-PAGE 凝胶电泳,将凝胶上蛋白移至醋酸纤维素膜,于50 g·L-1 脱脂奶粉中4℃封闭过夜,加兔抗Beclin-1和LC3抗体( 1∶1000),小鼠抗β-actin抗体(1∶3000),4℃过夜。TBST洗膜,分别加HRP标记的山羊抗兔抗体(1∶3000),室温避光孵育2h。TBST洗膜后,加底物发光显影。使用Quantity One软件扫描并进行灰度分析。蛋白表达水平以吸光度(A)值表示,按照下列公式计算蛋白表达水平。蛋白表达水平=每个样本条带A值/β-actin A值。
1.5 细胞死亡率检测将细胞接种到24孔培养板中,加入EBSS缓冲液,37℃、5%CO2条件下培养12h。将培养板中细胞用消化液消化并离心收集细胞,取100 μL细胞悬液,加0.8%台盼蓝溶液100 μL,混匀,每个样品至少计数200个细胞,并重复3次,蓝色的细胞被记为死亡的细胞,迅速用计数板计数细胞死亡数,计算细胞死亡率。实验重复3次。
1.6 统计学分析采用SPSS11.0统计软件进行统计学分析。GFP-LC3斑点细胞数、Beclin-1和LC3蛋白表达水平及细胞死亡率以x ±s表示,组间比较采用t检验。以P<0.05 为差异有统计学意义。
2 结 果 2.1 各组前列腺癌PC-3细胞的自噬情况细胞在EBSS中培养12 h后,干扰CD147分子表达的PC-3/shCD147细胞内出现明显的自噬小体样点状荧光。与阴性对照组GFP-LC3斑点细胞数(8.7%±1.8%)比较,PC-3/shCD147组GFP-LC3斑点细胞数(17.7%±2.2%)明显增加(P<0.01)(图 1,见插页二)。Western blotting法检测显示:与阴性对照组(1.00±0.00)比较,PC-3/shCD147组细胞中LC3-Ⅱ蛋白表达水平(3.2±0.23)明显升高(P<0.01),LC3-Ⅱ/LC3-Ⅰ比值(5.90±0.31)明显增加(P<0.01)。见图 2。
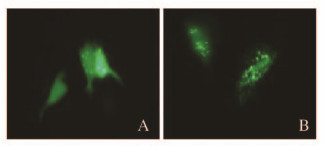
|
| A: Negative control group; B: PC-3/shCD147 group. 图1 荧光显微镜下观察PC-3细胞内自噬体(×100) Fig.1 Autophagosomes in PC-3 cells observed by fluroesence microscope(×100) |
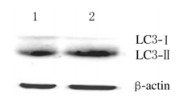
|
| Lane 1: Negative control group;Lane 2: PC-3/shCD147 group. 图2 Western blotting法检测LC3蛋白表达电泳图 Fig.2 Electrophoregram of LC3 protein expression detected by Western blotting method |
与阴性对照组(0.37±0.01)比较,PC-3/shCD147组PC-3细胞Beclin-1蛋白表达水平(0.57±0.03)明显升高(P<0.05)。见图 3。

|
| Lane1: Negative control group;Lane 2: PC-3/shCD147 group. 图3 Western blotting法检测PC-3细胞中Beclin-1蛋白表达电泳图 Fig.3 Electrophoregram of Beclin-1 protein expression detected by Western blotting method |
PC-3细胞在EBSS培养12 h后,通过台盼蓝排斥实验检测饥饿诱导的细胞死亡率。阴性对照组和PC-3/shCD147组细胞死亡率分别为(22.3±3.5)%和(38.4±3.1)%,组间比较差异有统计学意义(P<0.05)。提示在饥饿诱导的自噬中CD147能增强细胞存活。
3 讨 论CD147作为基质金属蛋白酶的诱导因子促进肿瘤的侵袭和转移,并且参与肿瘤细胞的能量代谢和物质代谢,对肿瘤的生存具有保护作用。因此,CD147被认为是肿瘤发展进程中一个重要的分子。LC3蛋白是酵母自噬相关蛋白(Atg8)的同源蛋白,在合成后其C末端即被Atg4蛋白酶切割转变为LC3-Ⅰ并散在分布于细胞质内,当自噬被诱导后,LC3-Ⅰ和磷脂酰乙醇胺偶联形成LC3-Ⅱ并始终稳定地锚定于自噬体膜上直至与溶酶体融合,因此LC3-Ⅰ与LC3-Ⅱ 通常被认为自噬标志物[11]。本研究在饥饿诱导的自噬模型中通过GFP-LC3实验和Western blotting法检测LC3的表达显示:干扰CD147表达后GFP-LC3融合蛋白从细胞浆中转位到自噬体膜,发生聚集,出现明亮的绿色荧光斑点,并且LC3-Ⅱ表达水平升高,说明自噬活性增加[12]。
研究[13]表明:自噬途径的功能缺失或突变与肿瘤发生存在关联。Beclin-1 是酵母自噬相关基因Atg6 ( autophagy-relatedgenes 6)的哺乳动物同源基因,是自噬过程中一个正调控分子,在40%~75%的乳腺癌、卵巢癌、前列腺癌中存在自噬相关基因Beclin-1的单基因缺失,Beclin-1缺陷的小鼠更易发生淋巴瘤、肺癌和乳腺癌等,说明Beclin-1蛋白作为肿瘤抑制剂发挥着特殊作用[14]。本实验结果显示:干扰CD147表达后细胞自噬增加,同时Beclin-1表达水平也升高,表明CD147抑制饥饿诱导的自噬是通过 Beclin-1调节的。进一步利用MTT检测细胞增殖,结果表明:通过RNA干涉降低前列腺癌细胞CD147表达导致细胞存活率下降,并且与自噬的增加呈正相关关系。提示CD147可以阻止饥饿诱导的细胞死亡,这与CD147在肝癌中抑制自噬的发生相一致。
前列腺癌是男性最常见的恶性肿瘤,通常分为雄激素依赖型和雄激素非依赖型前列腺癌,激素依赖性前列腺癌在接受雄激素阻断疗法后的2~3年转化为雄激素非依赖性前列腺癌,继而引起肿瘤复发和转移,导致患者死亡。研究[15, 16, 17, 18]表明:在非激素依赖性前列腺癌细胞中诱导自噬可增加细胞对凋亡应激原和放疗的敏感性。目前研究[9]表明:CD147在激素非依赖性前列腺癌PC-3细胞中具有抑制自噬的作用,因此在前列腺癌治疗中CD147成为一个很好的靶点,在激素非依赖性前列腺癌中通过抑制CD147的表达诱导自噬的发生,能够抑制肿瘤的生长或者可以增强多化疗药物的敏感性。
| [1] | Mizushima N,Levine,B,Cuervo AM,et al. Autophagy fights disease through cellular self-digestion[J]. Nature,2008,451(7182):1069-1075. |
| [2] | Kondo Y,Kanzawa T,Saways R,et al.The role of autophagy in cancer development and response to therapy[J]. Nat Rev Cancer,2005,5(9):726-734. |
| [3] | Bi XC,Liu JM,Zheng XG,et al. Over-expression of extracellular matrix metalloproteinase inducer in prostate cancer is associated with high risk of prostate-specific antigen relapse after radical prostatectomy[J]. Clin invest Med,2011,34(6): E358. |
| [4] | Szubert S,Szpurek D,Moszynski R,et al. Extracellular matrix metalloproteinase inducer (EMMPRIN)expression correlates positively with active angiogenesis and negatively with basic fibroblast growth factor expression in epithelial ovarian cancer[J]. J Cancer Res Clin Oncol,2014,140(3): 361-369. |
| [5] | Arendt BK,Walters DK,Wu X,et al. Multiple myeloma dell-derived microvesicles are enriched in CD147 expression and enhance tumor cell proliferation[J]. Oncotarget,2014,5(14): 5686-5699. |
| [6] | Grass GD,Dai L,Qin Z,et al. CD147: regulator of hyaluronan signaling in invasiveness and chemoresistance[J]. Adv Cancer Res,2014,123:351-373. |
| [7] | Gou XC,Ru Q,Zhang HX,et al. HAb18G/CD147 inhibits starvation-induced autophagy in human hepatoma cell SMMC7721 with an involvement of Beclin 1 down-regulation[J]. Cancer Sci,2009,100(5): 837-843. |
| [8] | 邢国胜,贺桂泉,赵文君. 药物对细胞自噬性死亡的干预作用[J]. 天津药学,2011,23(3):56-59. |
| [9] | Wang L,Wu G,Yu L,et al. Inhibition of CD147 expression reduces tumor cell invasion in human prostate cancer cell line via RNA interference[J]. Cancer Biol Ther,2006,6(5): 608-614. |
| [10] | Klionsky DJ,Abeliovich H,Agostinis P,et al.Guidelines for the use and interpretation of assays for monitoring autophagy in higher eukaryotees[J]. Autophagy,2008,4(2): 151-175. |
| [11] | Karim MR,Kawanago H,Kadowaki M. A quick signal of starvation induced autophagy: Transcription versus post-translational modification of LC3[J]. Anal Biochem,2014,22(465C): 28-34. |
| [12] | Bampton Edward TW,Goemans CG,Niranjan D,et al. The dynamics of autophagy visualized in live cells: from autophagosome formation to fusion with endo/lysosomes[J]. Autophagy,2005,1(1): 26-36. |
| [13] | 王 宠,张 萍,朱卫国. 细胞自噬与肿瘤发生的关系[J]. 中国生物化学与分子生物学报,2010,26(11): 988-997. |
| [14] | Qu X,Yu J,Bhagat G,et al. Promotion of tumorigenesis by heterozygous disruption of the beclin 1 autophagy gene[J]. J Chin Invest,2003,112(12):1809-1820. |
| [15] | Tai S,Sun Y,Liu N,et al. Combination of Rad001 (everollimus)and progachlor synergistically induces apoptosis through enhanced autophagy in prostate cancer cells[J]. Mol Cancer Ther,2012,11(6): 1320-1331. |
| [16] | He Z,Mangala LS,Theriot CA,et al. Cell killing and radiosensitizing effects of atorvastatin in PC3 prostate cancer cells[J]. J Radiot Res,2012,53(2):225-233. |
| [17] | 崔功廷,袁 铭.地奥司明对盆腔淤血所致大鼠慢性非细菌性前列腺炎的影响[J]. 解放军医学杂志,2014,39(6):444-447. |
| [18] | 杨 辉,高晓刚,傅志仁.自噬在肝脏免疫耐受中作用机制研究进展[J]. 解放军医学杂志,2014,39(6):503-506. |




