扩展功能
文章信息
- 齐玲, 王玮瑶, 郑中华, 张以忠, 赵丽微, 钟秀宏, 赵东海, 杨淑艳, 杨宁江, 任旷, 于洪泉
- QI Ling, WANG Weiyao, ZHENG Zhonghua, ZHANG Yizhong, ZHAO Liwei, ZHONG Xiuhong, ZHAO Donghai, YANG Shuyan, YANG Ningjiang, REN Kuang, YU Hongquan
- SUMO及SUMO化修饰蛋白在恶性胶质瘤发生中的作用
- Effects of SUMO and proteins modified by SUMO on occurrence of malignant gliomas
- 吉林大学学报(医学版), 2016, 42(01): 7-10
- Journal of Jilin University (Medicine Edition), 2016, 42(01): 7-10
- 10.13481/j.1671-587x.20160102
-
文章历史
- 收稿日期: 2015-07-01
2. 吉林医药学院药理教研室, 吉林吉林 132013;
3. 吉林大学第一医院神经外科, 吉林长春 130021
2. Department of Pharmacology, Jilin Medical University, Jilin 132013, China;
3. Department of Neurosurgery, First Hospital, Jilin University, Changchun 130021, China
脑肿瘤位于颅内,一旦发生很容易危及患者的生命。脑肿瘤以胶质瘤最为常见,恶性居多[1]。但迄今为止,恶性胶质瘤的发生机制及病因还不明确。小泛素化相关修饰蛋白质类(small ubiquitin-related modifier protein,SUMO)是一类广泛存在于真核生物细胞中且高度保守的蛋白质家族[2],SUMO与肿瘤的关系极为密切,SUMO会引起蛋白SUMO化或去SUMO化,从而影响肿瘤的发生、发展以及对治疗的反应。有研究[2, 3]显示:SUMO对胶质瘤有一定的影响,但SUMO化及相关修饰蛋白与胶质瘤间的关系尚不清楚。本研究通过检测恶性胶质瘤组织中SUMO和SUMO化修饰相关蛋白的变化,初步探讨SUMO与恶性胶质瘤发生发展的关系。
1 材料与方法 1.1 细胞、主要试剂和仪器人正常脑组织和恶性胶质瘤组织(分别为正常对照组和恶性胶质瘤组),由吉林大学第一医院神经外科提供,病理诊断均为Ⅲ-Ⅳ级恶性胶质瘤。Bradford蛋白浓度测定试剂盒(美国Pierce公司),SUMO1、SUMO2抗体和ECL发光液(美国Invitrogen公司),Aos1和Uba2抗体(美国Imgenex公司),UBC9抗体(美国Zymed公司),β-actin、PIAS1、PIAS2、PIAS3和Pc2抗体(美国Santa Cruz公司)。J-26XP超低温高速离心机(美国贝克曼公司),DNA蛋白电泳系统(美国Bio-Rad公司),Image-Pro Plus 图像分析管理系统(美国Media Cybernetics公司)。
1.2 样品的准备将人正常脑组织和恶性胶质瘤组织样本各2个在冰上进行破碎,破碎后的组织样品中加入50 μL SUMO蛋白裂解液(裂解液含20 nmol·L-1蛋白抑制剂、20 nmol·L-1NEM和1%PMSF),冰浴10 min,4℃、12 000 r·min-1离心15 min,留上清,Bradford法测定样品蛋白浓度后计算所需样本量。
1.3 SUMO相关蛋白检测蛋白免疫印迹(Western blotting)法:准备聚丙烯酰胺凝胶,电泳分离样品,转膜封闭,加入不同第一抗体(稀释度均为1:1000),4℃孵育过夜,第二抗体(稀释度均为1:5000)室温孵育1h,胶片曝光拍照。采用Image-Pro Plus图像分析管理系统对免疫印迹结果进行半定量分析,蛋白表达水平以蛋白质条带积分光密度(IA)值表示。
1.4 统计学分析采用SPSS 17.0 统计软件进行统计学分析。不同组织中SUMO和SUMO化修饰相关蛋白表达水平以x±s表示,两组样本间均数比较采用t检验。以P<0.05为差异有统计学意义。
2 结 果 2.1 不同组织中SUMO蛋白表达水平与正常对照组比较,恶性胶质瘤组织中SUMO1和SUMO2蛋白表达水平均明显升高(P<0.01)。见图 1和表 1。
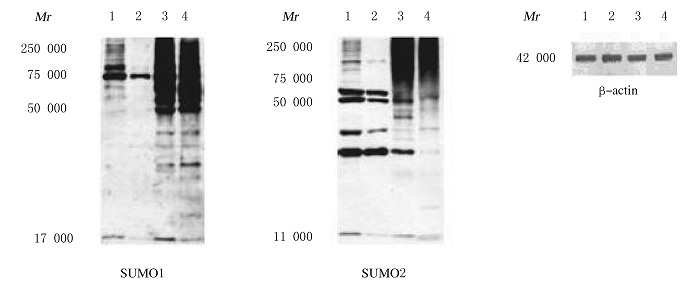
|
| Lane 1,2: Control group;Lane 3,4: Malignant glioma group. 图 1 不同组织中SUMO表达电泳图 Fig.1 Electrophoregram of SUMO expression in different tissues |
| (n=3,x ±s) | |||||||||
| *P<0.01 vs control group. | |||||||||
| Group | SUMO1 | SUMO2 | Aos1 | Uba2 | UBC9 | PIAS1 | PIAS2 | PIAS3 | Pc2 |
| Control | 0.35±0.16 | 0.36±0.13 | 0.35±0.25 | 1.04±0.19 | 0.04±0.01 | 0.56±0.19 | 0.87±0.05 | 0.25±0.10 | 0.66±0.04 |
| Malignant glioma | 1.06±0.01* | 0.72±0.07* | 1.04±0.03* | 0.02±0.01* | 0.77±0.40* | 0.28±0.15* | 0.46±0.23* | 0.54±0.13* | 0.71±0.10 |
与正常对照组比较,恶性胶质瘤组织中Aos1蛋白表达水平明显升高,Uba2蛋白表达水平明显降低(P<0.01)。见图 2和表 1。
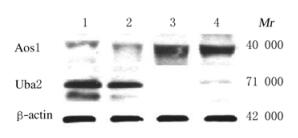
|
| Lane 1,2: Control group;Lane 3,4: Malignant glioma group. 图 2 不同组织中 SUMO活化酶蛋白表达电泳图 Fig.2 Electrophoregram of SUMO activating enzyme protein expression in different tissues |
与正常对照组比较,恶性胶质瘤组织中UBC9蛋白表达水平明显升高(P<0.01)。见图 3和表 1。
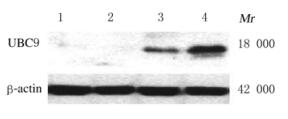
|
| Lane 1,2: Control group;Lane 3,4: Malignant glioma group. 图 3 不同组织中SUMO结合酶蛋白表达电泳图 Fig.3 Electrophoregram of SUMO conjugating enzyme protein expression in different tissues |
与正常对照组比较,恶性胶质瘤组织中PIAS1和PIAS2蛋白表达水平明显降低(P<0.01),PIAS3蛋白表达水平明显升高(P<0.01),Pc2蛋白表达水平无明显变化(P>0.05)。见图 4和表 1。
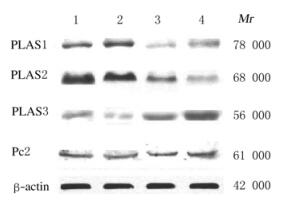
|
| Lane 1,2: Control group;Lane 3,4: Malignant glioma group. 图 4 不同组织中SUMO连接酶蛋白表达电泳图 Fig.4 Electrophoregram of SUMO ligases protein expression in different tissues |
人类肿瘤的发生与SUMO及细胞内底物蛋白的SUMO化密不可分[5, 6]。基因芯片分析[7, 8, 9, 10]发现:低存活率的肝癌患者中SUMO活化酶的表达水平上调,腺癌和卵巢癌细胞UBC9表达水平增加,肺癌、乳腺癌、前列腺癌和结直肠癌中PIAS3也存在不同程度的表达上调。但对SUMO的系统研究还少有报道,恶性胶质瘤中SUMO化所起的作用也未知。
人类SUMO 家族共有4个成员,其中SUMO1、SUMO2和SUMO3发挥了主要的作用,而SUMO2和SUMO3具有极高的同源性[11, 12]。有研究[13]表明:SUMO在星形胶质细胞瘤和胶质母细胞瘤的发生中起一定的作用。本实验采用Western blotting法检测恶性胶质瘤组织中SUMO蛋白表达水平显示:恶性胶质瘤组织中SUMO1和SUMO2蛋白表达水平明显升高,表明在恶性胶质瘤的发生过程中,肿瘤组织中存在着过量的SUMO蛋白,这就为SUMO蛋白参与恶性胶质瘤的发生提供了有力的证据。
在体内,无活性的SUMO前体在ATP存在时,会经SUMO活化酶E1、SUMO结合酶E2、SUMO连接酶E3作用,使底物蛋白发生SUMO化。E1是由Aos1和Uba22个亚基构成的异源二聚体,2个亚基的功能不同,须共存才能发挥作用;E2仅有1个UBC9;E3由PIAS(proteininhibitor of the activator of STAT)家族、RanBP2/Nup358和Pc2(polycomb group protein)组成[14]。本研究结果显示:恶性胶质瘤Aos1和Uba2表达水平明显不同,Aos1表达水平明显升高,而Uba2表达水平明显降低,UBC9表达水平明显升高,PIAS1、PIAS2和PIAS3表达水平升高,Pc2无明显变化,说明在恶性胶质瘤发生中SUMO化修饰蛋白所起的作用是不同的。
在E1活化过程中Aos1可能起主导作用,启动了E1酶对底物蛋白发挥作用;UBC9表达进一步促进肿瘤发生时底物蛋白发生了SUMO化;而PIAS3增加最后决定了与肿瘤发生相关底物SUMO化完成。以上结果表明:在恶性胶质瘤的发生过程中,SUMO化修饰可能起到了极为重要的促进作用,但其具体机制目前尚不清楚。泛素化与SUMO化是互相影响、互为相反的两个过程。在脑肿瘤中caspase 8的表达与细胞凋亡发生与否密切相关[15],而caspase 8泛素化和SUMO化与肿瘤细胞的生长密切相关[16, 17, 18, 19]。但具体SUMO化修饰在恶性胶质瘤的发生过程中所起的作用,还需在今后的实验中进一步深入探讨。
| [1] | Qi L,Bellail AC,Rossi MR,et al. Heterogeneity of primary glioblastoma cells in the expression of caspase-8 and the response to TRAIL-induced apoptosis[J].Apoptosis,2011,16(11): 1150-1164. |
| [2] | 齐 玲,沈 楠,王玮瑶,等. SENP蛋白在胶质瘤中表达与临床病理分级相关性[J]. 中国公共卫生,2015,31 (9): 1219-1221. |
| [3] | 范阳华,叶敏华,吴 雷,等.人脑胶质瘤中RSUME的SUMO化与 HIF-1α/VEGF 通路的相关性[J]. 安交通大学学报:医学版,2015,36(4):472-478. |
| [4] | Bellail AC,Olson JJ,Hao C.SUMO1 modification stabilizes CDK6 protein and drives the cell cycle and glioblastoma progression[J].Nat Commun,2014,23(5):4234. |
| [5] | González-Santamaría J,Campagna M,Ortega-Molina A,et al. Regulation of the tumor suppressor PTEN by SUMO[J].Cell Death Dis,2012,27(3):e393. |
| [6] | Qin Y,Bao H,Pan Y,et al. SUMOylation alterations are associated with multidrug resistance in hepatocellular carcinoma[J].Mol Med Rep,2014,9(3):877-881. |
| [7] | Lee JS,Thorgeirsson SS. Genome-scale profiling of gene expression in hepatocellular carcinoma: classification,survival prediction,and identification of therapeutic targets[J].Gastroenterology,2004,127(5 Suppl 1): S51-55. |
| [8] | Han JY,Lee GK,Yoo SY,et al. Association of SUMO1 and UBC9 genotypes with tumor response in non-small-celllung cancer treated with irinotecan-based chemotherapy[J].Pharmacogenomics J,2010,10(2):86-93. |
| [9] | Hsieh YL,Kuo HY,Chang CC,et al. Ubc9 acetylation modulates distinct SUMO target modification and hypoxia response[J].EMBO J,2013,32(6):791-804. |
| [10] | Cao Q,Li YY,He WF,et al. Interplay between microRNAs and the STAT3 signaling pathway in human cancers[J].Physiol Genomics,2013,45(24):1206-1214. |
| [11] | Sozen S,Horozoglu C,Bireller ES,et al. Association of SUMO4 M55V and -94ins/del gene variants with type-2 diabetes[J].In Vivo 2014,28(5):919-923. |
| [12] | Sriramachandran AM,Dohmen RJ. SUMO-targeted ubiquitin ligases[J]. Biochim Biophys Acta,2014,1843(1):75-85. |
| [13] | Yang W,Wang L,Roehn G,et al. Small ubiquitin-like modifier 1-3 conjugation [corrected] is activated in human astrocytic brain tumors and is required for glioblastoma cell survival[J]. Cancer Sci,2013,104(1):70-77. |
| [14] | Johnson ES. Protein modification by SUMO[J]. Annu Rev Biochem,2004,73:355-382. |
| [15] | 齐 玲,于洪泉,丁丽娟,等. Caspase-8在胶质母细胞瘤抵抗TRAIL诱导凋亡中的作用[J]. 吉林大学学报:医学版,2011,37(4): 612-616. |
| [16] | Li Y,Kong Y,Zhou Z,et al. The HECTD3 E3 ubiquitin ligase facilitates cancer cell survival by promoting K63-linked polyubiquitination of caspase-8[J].Cell Death Dis,2013,28(4):e935. |
| [17] | Delfino DV,Spinicelli S,Pozzesi N,et al. Glucocorticoid-induced activation of caspase-8 protects the glucocorticoid-induced protein Gilz from proteasomal degradation and induces its binding to SUMO-1 in murine thymocytes[J]. Cell Death Differ,2011,18(1):183-190. |
| [18] | 王新军,杨如意,周少龙,等.胶质瘤相关性癫痫致痫灶组织中高迁移率族蛋白B1的表达[J].郑州大学学报:医学版,2015,50(5):634-637. |
| [19] | 王凤伟,牛光明,张鹏远,等.脑胶质瘤组织中Beclin-1的表达及与预后的关系[J].郑州大学学报:医学版,2014,49(4):472-475. |
 2016, Vol. 42
2016, Vol. 42


