扩展功能
文章信息
- 夏海坚, CHEN Qiao, BO Xuenong, 孙晓川, 钟东, 夏永智
- XIA Haijian, CHEN Qiao, BO Xuenong, SUN Xiaochuan, ZHONG Dong, XIA Yongzhi
- 大鼠原代背根神经元和雪旺细胞在随机及有序排列聚甲基丙烯酸甲酯电纺纳米纤维上共培养的形态学
- Morphology of rat dorsal root ganglion neurons and Schwann cells cocultured on polymethylmethacrylate electrospun nanofibers with different topographic features
- 吉林大学学报(医学版), 2016, 42(01): 1-6
- Journal of Jilin University (Medicine Edition), 2016, 42(01): 1-6
- 10.13481/j.1671-587x.20160101
-
文章历史
- 收稿日期: 2015-05-24
2. 英国萨塞克斯大学生命科学院, 英国布莱顿 BN1 9QJ;
3. 英国伦敦大学皇后玛丽学院Blizard研究所, 英国伦敦 E1 2AT
2. School of Life Sciences, University of Sussex, Brighton, BN1 9QJ, UK;
3. Blizard Institute, Queen Mary, University of London, London E1 2AT, UK
急性创伤性脊髓损伤(spinal cord injury,SCI)好发于青壮年,其高致残及致死率给患者及其家庭带来了生理、心理、社会及经济的巨大负担[1]。影响SCI后神经再生的2个重要因素是SCI后的生长抑制环境以及自SCI亚急性期开始逐渐形成的胶质瘢痕及空洞[2]。动物实验[3]显示:通过分子生物学手段阻断伤后生长抑制因子的胞内传导通路,可在一定程度上促进SCI后神经突的再生,对动物肢体功能的恢复有促进作用;但神经示踪技术发现再生神经突主要集中于致伤灶瘢痕空洞的一侧,致伤灶空洞内的坏死物质及积液难以给再生神经突提供必需的依附环境,下行的再生神经突难于穿越致伤灶胶质空洞而到达远端。因此,SCI后可植入性的组织工程支架的设计是伤后神经再生的一个重要策略[4]。
静电纺丝纳米纤维是极具潜力的组织工程材料,电纺纳米纤维在创伤后的生物应用研究是国际组织工程学界的一个热点。本课题组前期研究[5, 6, 7, 8]成功构建PMMA电纺纳米纤维,发现该电纺纳米纤维对于神经细胞系及多种原代神经细胞具有良好生物相容性,且无细胞毒性,能够为神经细胞的生长提供必需的胞外基质支持,且其拓扑结构能够明显影响神经细胞的生长特点,具有作为神经损伤后植入性支架材料的应用潜力。
神经突的有效再生是SCI后神经再生的重要环节。研究[4]发现:多种胶质细胞的再生对于促进神经突再生及功能重建有重要意义,其中雪旺细胞(schwann cells,SCs)被认为是SCI后最具移植意义的细胞类型之一,因移植的SCs能够改善SCI后局部的生长微环境,且能够促进神经突的再髓鞘化。本研究拟利用静电纺丝技术构建具有随机分布或轴向有序排列拓扑结构的PMMA电纺纳米纤维支架材料,以其为培养基质进行大鼠原代背根神经元(dorsal root ganglion neurons,DRGn)的培养及其与SCs的共培养,旨在观察PMMA纳米纤维的拓扑线索同时对DRGn神经突及SCs突起生长的影响,为后续在体实验提供前期基础。
1 材料与方法 1.1 主要试剂和仪器二甲基甲酰胺、PMMA、DAPI、胰酶、forskolin、胰岛素、层黏连蛋白和多聚赖氨酸溶液购自美国Sigma公司,F-12培养基购自美国Gibco公司,N-2 补充剂、牛血白蛋白(BSA)、L15培养基购自美国Invitrogen公司,Ⅱ型胶原蛋白酶购自英国Worthington公司,β-heregulin购自英国R&D Systems公司,成纤维细胞生长因子购自英国PeproTech公司,兔抗βⅢ Tubulin抗体和抗S100抗体购自美国Abcam公司,Alexa Fluor 488和Alexa Fluor 568抗体购自美国Molecular Probes公司,硅胶隔离片购自美国Grace公司,生物实验用润滑油购自英国Dow Corning公司。TE2000-S倒置荧光显微镜购自日本 Nikon公司,解剖显微镜购自德国Leica公司。
1.2 随机或有序电纺纳米纤维的构建利用二甲基甲酰胺溶解PMMA获得6.5%(质量体积百分比)的PMMA溶液,通过配有30G 针尖的微量泵以0.3 mL·h-1的速度释出。电纺电压为10 kV。为获得具有随机分布或轴向有序排列拓扑结构的电纺纤维,微量泵针尖和收集系统的距离分别设置为12和20 cm。电纺纤维的收集系统为长方体形,可沿长轴在电机驱动下转动,在4个收集面的边缘设有卡槽,15 mm×15 mm盖玻片通过卡槽固定其上,电纺纤维最终收集在盖玻片上供后续实验使用。根据构建随机或有序纳米纤维的不同目的,收集系统的转速分别为400 r·min-1和1200 r·min-1。对照组采用的PMMA薄膜,为将6.5%的PMMA溶液覆于15mm×15 mm盖玻片上制备而成。上述材料的制备环境,湿度小于60%,温度22~24℃。材料构建完毕后,真空烘箱内室温烘干以除去残留二甲基甲酰胺,另用250 nm波长的紫外线照射1 min,以改善材料亲水性。电纺纤维制作完毕后,以之为基底构建细胞培养系统,将细胞培养用硅胶隔离片通过生物实验用润滑油贴附在制备有电纺纤维或薄膜的盖玻片上,从而获得内径13 mm、容积0.5 mL的细胞培养系统,该系统在紫外消毒后,放置于细胞培养皿中待用。
1.3 PMMA电纺纳米纤维的表观鉴定①纤维形态观察:利用TE2000-S倒置显微镜进行纤维形态及排列方向的观察;②纤维直径测定:对于随机或有序PMMA电纺纤维,分别随机选取并测量150根纤维的直径(ImageJ软件),计算得到各自的平均直径。
1.4 慢病毒载体(lentivirus,LV)的构建绿色荧光蛋白(GFP)和mCherry慢病毒载体(LV-GFP和LV-mCherry)的构建同既往实验[5, 6, 7, 8]步骤,GFP或mCherry的cDNA经亚克隆而进入pRRL转移载体,该载体转染HEK293细胞系,由转染的HEK293细胞分泌得到LV-GFP和LV-mCherry病毒颗粒,培养上清液中的病毒颗粒最后通过超速离心浓聚。所得LV-GFP和LV-mCherry再通过梯度浓度法转染新鲜HEK293细胞,根据荧光表达量分别计算得到LV-GFP和LV-mCherry病毒滴度。本实验中所制备的LV-GFP和LV-mCherry其滴度分别为7.0×1010 TU·mL-1和3.7×1010 TU·mL-1。
1.5 DRGn的纯化及鉴定大鼠DRGn分离纯化的主要步骤:①选取第2~3代(P2~3)Wistar大鼠,麻醉后断头处死;②咬除椎板,游离各节段的背根神经节,置于0℃的F-12培养基中;③解剖显微镜下去除神经节外膜及神经根;④37℃、5%CO2孵箱消化2h(含0.125%胶原蛋白酶的F-12培养基);⑤转入500 μL DRGn培养基中(BSF2 培养基:F-12500 mL,N-2 补充剂5 mL,30% BSA5 mL,100 g·L-1的青/链霉素5 mL),吹打后静置1min,将除底部组织沉淀外的其余液体小心转移至15% BSA溶液中(即1mLBSF2 +1mL 30% BSA),700 r·min-1下离心5 min;⑥去掉上清液,用DRGn培养基BSF2吹打均匀;⑦细胞计数后候用。分离纯化后的鉴定采用抗βⅢ Tubulin及DAPI的双重免疫染色。DRGn经多聚甲醛固定后,选取1∶500的兔抗βⅢ Tubulin为一抗,1∶1000的羊抗兔Alexa Fluor 488为二抗,最后用含有1mg·L-1 DAPI的甘油溶液封片。荧光显微镜(×20及×40物镜)立即观察。大鼠SCs作为 DRGn鉴定的阴性对照。
1.6 大鼠SCs的纯化及鉴定大鼠SCs的分离纯化方法:①取Wistar大鼠(P2-3),在CO2吸入麻醉后,断头处死,游离坐骨神经和臂丛神经并去除神经外膜;②在37℃孵箱中用含0.125%的胰酶和0.02%的Ⅱ型胶原蛋白酶的L15培养基消化45 min,反复吹打均匀后,加入含血清培养基和胰酶中,孔径70 μm滤纸滤除组织碎片,滤出液1000 r·min-1离心10 min,移除上清液;③底部的细胞块用SCs培养基(DMEM,10%胎牛血清,100 U·mL-1 青霉素,100 mg·L-1庆大霉素,25 μg·L-1 β-heregulin,2 μmol·L-1 forskolin,25μg·L-1成纤维细胞生长因子和 5 mg·L-1 胰岛素)小心吹打均匀后待用。分离所得的SCs通过抗S100及DAPI的双重免疫染色鉴定。荧光显微镜(×20及×40物镜)立即观察。将大鼠DRGn作为SCs鉴定的阴性对照。
1.7 DRGn在PMMA材料上的培养及形态学观察以PMMA电纺纳米纤维为基底的细胞培养体系构建后,先后用多聚赖氨酸及10 mg·L-1的层黏连蛋白溶液包被。PMMA薄膜为对照组。分别将3×103 DRGn置于各型PMMA材料上,植入同时利用LV-GFP同时转染GFP荧光报道基因(感染复数为500)。用GFP/DRGn指代转染GFP的DRGn,培养基使用BSF2。
用LV-GFP行病毒转染后约36 h,GFP表达强度满意,故本研究将培养第2天作为检查时间点,分析DRGn神经突的数量及长度。培养的第2天,在每个样本随机选取5个视野进行GFP荧光图像的取图(×20物镜)。只有长度超过神经元直径的细胞突起才被认定为神经突(采用ImageJ软件测量神经突尖端至胞体外缘的距离),而其中最长的一个神经突被视为该GFP/DRGn神经突的长度。
1.8 大鼠DRGn和SCs在PMMA电纺纳米纤维上的共培养本研究拟重点观察PMMA电纺纤维的拓扑结构对DRGn和SCs生长的协同作用。因SCs的生长速度超过DRGn,若同时接种2种细胞,易造成SCs占绝对主要的局面,不利于观察,故本研究选择先行培养DRGn 2 d,在神经突生长开始明显时,再添加SCs。将纯化的SCs用LV-GFP转染GFP荧光报道基因(感染复数为500),以下用GFP/SCs指代LV-GFP转染的SCs,形成稳定传代的GFP/SCs后待用。
以电纺纤维为基底的细胞培养体系包被方法同前,培养基仍为BSF2。分别将3×103个大鼠DRGn置于PMMA薄膜、随机或有序PMMA电纺纳米纤维,在放置细胞同时用LV-mCherry转染mCherry红色荧光蛋白报道基因(感染复数为500)。以下用mCherry/DRGn指代LV-mCherry转染的DRGn。培养过程中,每天更换半量培养基。在mCherry/DRGn培养第3天,加入4×103个GFP/SCs,培养基保持使用BSF2培养基。在培养第4天,即GFP/SCs加入后24 h在倒置荧光显微镜下提取图片进行分析。共培养的图像分析方法:分别对在PMMA薄膜、随机或有序PMMA电纺纤维上的共培养体系,随机选取7个视野,采用倒置荧光显微镜分别截取mCherry/DRGn的红色荧光图像和GFP/SCs 的绿色荧光图像(×10物镜下),采用ImageJ软件进行快速傅立叶转换(fast fourier transform,FFT),得到二维的FFT图像,然后,利用MATLAB软件编程对其进行半高全宽值(Full-width/Half maximum,FWHM)的计算,从而定量分析mCherry/DRGn神经突和GFP/SCs的有序排列程度。
1.9 统计学分析采用SPSS 13.0软件进行统计学分析。随机及有序PMMA电纺纳米纤维的直径,各组GFP/DRGn的神经突数量及神经突长度,基质纤维和各组mCherry/DRGn和GFP/SCs的FWHM值均以x ±s表示,随机及有序PMMA电纺纳米纤维的直径组间比较采用t检验,其他多组间比较采用单因素方差分析(Student-Newman-Keuls法)。以P<0.05为差异有统计学意义。
2 结 果 2.1 电纺纳米纤维的形态学观察在随机和轴向有序电纺纤维上,纤维形态均良好,随机PMMA电纺纳米纤维上的纤维排列是随机无序的,而有序纤维上的纤维排列具有明显的方向性(图 1,见插页一)。本研究中随机和有序PMMA电纺纳米纤维的直径分别为(0.49±0.04)和(0.47±0.03)μm,两者比较差异无统计学意义(P>0.05)。

|
| 图1 倒置显微镜下观察随机(A)和有序(B)PMMA电纺纳米纤维(Bar=100μm) Fig.1 PMMA electrospun nanofibers with random(A)and aligned (B)topographic features under inverted microscope(Bar=100 μm) |
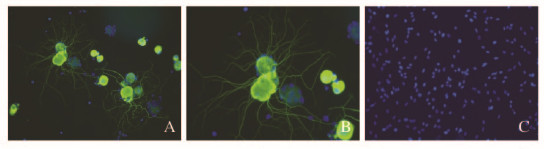
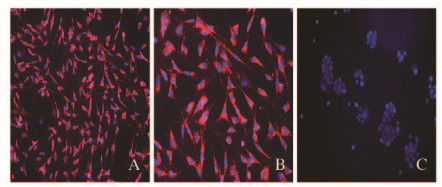
DRGn抗βⅢ Tubulin染色为阳性。在盖玻片平面环境上,DRGn的神经突在空间上是随机无序的(图 2,见插页一)。SCs的抗S-100染色为阳性,绝大多数细胞呈双极形细胞形态(图 3,见插页一)。
|
| A, B: DRGn staining; C: SCs staining (using same antibodies as negative control); A, C: ×200; B: ×400. 图2 纯化大鼠DRGn的鉴定 Fig.2 Identification of purified rat DRGn |
|
| A, B: SCs staining; C: DRGn staining (using same antibodies as negative control); A, C: ×200; B: ×400. 图3 纯化大鼠SCs的鉴定 Fig.3 Identification of purified rat SCs |
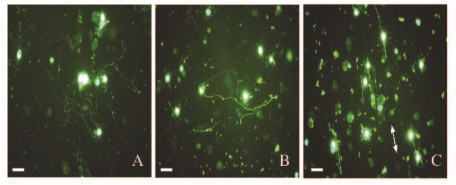
在培养第2天,培养在PMMA薄膜、随机和有序PMMA电纺纳米纤维上的GFP/DRGn平均生成(3.3±1.6)、(2.9±1.2)和(3.1±1.3)个神经突,平均神经突长度分别为(143.7±45.2)、(134.2±38.7)和 (138.4±40.6)μm,平均神经突数量及平均神经突长度组间比较差异均无统计学意义(P>0.05)。在PMMA薄膜和随机PMMA电纺纳米纤维上,GFP/DRGn的神经突是随机无序分布的,与培养在盖玻片上相仿;在有序PMMA电纺纳米纤维上,GFP/DRGn神经突的生长方向则能够和基质纤维的延伸方向保持一致(图 4,见插页一)。
|
| A: PMMA film; B: Randomly oriented PMMA nanofibers; C: Aligned PMMA nanofibers; The arrow showed the direction of alignment of the nanofibers; Bar = 100μm 图4 在PMMA材料上生长的GFP/DRGn Fig.4 Growth of GFP/DRGn cultured on PMMA materials |
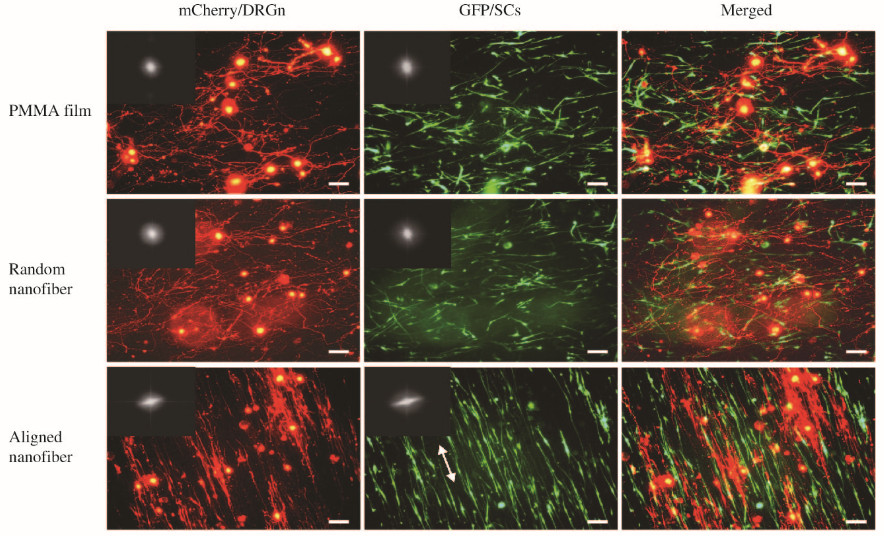
mCherry/DRGn和GFP/SCs在PMMA薄膜、随机和有序PMMA电纺纳米纤维上均能贴壁并生长。至取图时间点,mCherry/DRGn的神经突已形成较为复杂的网络,GFP/SCs则呈现出典型的双极型细胞形态(图 5,见插页一)。在随机PMMA电纺纳米纤维组,mCherry/DRGn的神经突和GFP/SCs的生长形态学与在PMMA薄膜上类似,从细胞形态学上观察2种细胞生长均良好,但2种细胞均倾向于各自无序的生长,在空间分布上未见有确切的联系形成。而在有序PMMA电纺纳米纤维组,可见mCherry/DRGn神经突和GFP/SCs细胞突起均沿基质纤维的方向生长,故2种细胞的空间分布均具有高度有序的特点,在较多部位,可见mCherry/DRGn神经突和GFP/SCs细胞突起同时接受了同一纳米纤维的接触引导作用,从而形成共定位,此种共定位在PMMA薄膜或随机PMMA电纺纳米纤维上难以见到。
|
| The insets in the upper left corner of panels of left and middle columns showed their FFT patterns; Double headed arrows represented the orientation of the aligned nanofibers; Bar=100 μm. 图5 mCherry/DRGn和GFP/SCs在PMMA材料上的共培养 Fig.5 Coculture of mCherry/DRGn and GFP/SCs on PMMA materials |
随机和有序PMMA电纺纳米纤维组的平均FWHM值分别为79.1±7.8 和 23.8±2.5,其中高FWHM值意味着随机排列,而低FWHM值意味着有序排列。培养在PMMA薄膜、随机和有序PMMA电纺纳米纤维上的mCherry/DRGn,其FWHM值分别为76.5±7.2、76.1±8.3 和27.3±3.5,培养在有序PMMA电纺纤维上的mCherry/DRGn有序排列性最强(P<0.01)。而培养在PMMA薄膜、随机和有序PMMA电纺纳米纤维上的GFP/SCs,其FWHM值分别为75.1±7.4、 75.5±6.2 和 26.5±2.7,培养在有序PMMA电纺纤维上的GFP/SCs有序排列性最强(P<0.01)。另外,在有序PMMA电纺纳米纤维上,纤维结构、mCherry/DRGn 和 GFP/SCs的FWHM值比较差异无统计学意义(P>0.05),提示2种细胞类型均严格在电纺纤维提供的接触引导作用下生长,两者产生共定位的根源在于轴向有序排列PMMA电纺纳米纤维所具有的拓扑线索。
3 讨 论静电纺丝技术源于工业领域,最近发现采用多种天然或合成高分子原料所构建的电纺纳米纤维具有重要的生物工程学价值[5, 6, 7, 8, 9]。相比于研究较多的凝胶植入系统,电纺纤维具有以下优势:①电纺纤维能够模仿天然的胞外基质,因其纳米层级的纤维尺寸和天然胞外基质的尺寸非常类似;②作为植入支架,电纺纤维能够为靶细胞提供充裕的贴壁空间,因其具有优良的表面面积/体积比;③作为植入支架,电纺纤维有利代谢物质的进出,因其具有天然的多孔性特点。因此,电纺纳米纤维作为SCI后植入性支架的研究,是现今国际组织工程学界的一个热点,初步的研究提示构建良好的电纺纤维具有作为SCI后植入性支架的潜力,能够为伤后的新生组织提供基质支持[5, 6, 7, 8, 9];但对于哺乳动物神经元和胶质细胞同时在不同拓扑结构电纺纤维上培养的生物学行为,值得深入探讨。
本课题旨在分析电纺纤维的拓扑结构在体外对神经元及胶质细胞生长的影响,故选取PMMA作为电纺原料,该物质是多种临床植入性材料的原料,具有稳定的理化性质及良好的生物相容性,不会对培养环境造成负面影响。
DRGn是常用的原代神经元类型,从组织来源分析兼具周围神经系统和中枢神经系统的特点,而SCs是SCI后最具移植潜力的细胞类型之一,能够促进神经突的再髓鞘化,故本研究选择DRGn和SCs作为实验对象。对于GFP/DRGn在电纺纤维上的单独培养,本研究未见平均神经突数量和长度有明显区别,证实PMMA电纺纳米纤维能够给予神经元必要的胞外基质支持,在前期的纤维构建过程无化学溶剂残留,所制备的材料具有良好生物相容性。
对于共培养,本研究结果显示:mCherry/DRGn 和 GFP/SCs在PMMA电纺纳米纤维上的生长状况良好,mCherry/DRGn生成明显的神经突,GFP/SCs呈现出明显的双极型细胞形态。但2种细胞在不同拓扑结构电纺纤维上的生长特点截然不同:在PMMA薄膜和随机PMMA电纺纳米纤维上,mCherry/DRGn 神经突的和 GFP/SCs细胞突起的生长和在盖玻片上类似,均呈随机无序的状态,至检查时间点两者生长在空间上未见有确切联系形成;而在有序PMMA电纺纳米纤维上的mCherry/DRGn 和 GFP/SCs均接受有序纤维的接触引导作用,神经突或细胞突起的生长均严格沿基质纤维的延伸方向生长,形成高度的有序分布,在高倍镜下可见较多mCherry/DRGn和 GFP/SCs形成共定位,产生GFP/SCs细胞突起沿mCherry/DRGn神经突走行的现象[10, 11]。
本研究针对有序排列性对mCherry/DRGn 和 GFP/SCs的生长进行了分析,通过FFT后的FWHM计算,结果显示:有序PMMA电纺纳米纤维组mCherry/DRGn 或 GFP/SCs的FWHM值均明显低于PMMA薄膜组和随机PMMA电纺纳米纤维组;而在有序纤维系统上,基质纤维、mCherry/DRGn 和 GFP/SCs之间FWHM值无明显差别,证明2种细胞类型均严格遵循了有序纤维的拓扑线索,有序电纺纤维能够在空间上促成mCherry/DRGn 和 GFP/SCs建立共定位。
本研究结果提示:有序PMMA电纺纳米纤维作为SCI后植入性支架的意义为:①由于脊髓上下行传导束在解剖上具有高度的各向异性,SCI后理想的神经修复不但要求神经突的再生,还希望再生的神经纤维延续既往的轨道而避免向各向延伸,因此有序PMMA电纺纳米纤维的拓扑线索有望将伤后有限的神经突再生实现效率的最大化[12, 13]。②神经突再生后的髓鞘化对于促进伤后神经功能的恢复具有重要作用,SCs髓鞘化轴突的过程包含了SCs和神经突共定位、SCs突起延长、包裹轴突、髓磷脂形成等重要步骤,本研究结果提示有序纤维的拓扑线索有可能加速SCs的髓鞘化进程[14]。
综上所述,本研究发现:PMMA电纺纳米纤维的拓扑线索对于DRGn 和 SCs均具有明显的接触引导作用,培养在PMMA电纺纳米纤维上的DRGn至检查时间点未见平均神经突数量及平均神经突长度的明显差异,有序PMMA电纺纳米纤维有助于mCherry/DRGn神经突和GFP/SCs细胞突起建立共定位,具有作为SCI后植入性支架的潜力。关于有序PMMA电纺纳米纤维在SCI后的活体应用及其内在机制值得后续深入研究。
| [1] | Chen Y,Tang Y,Vogel LC,et al. Causes of spinal cord injury[J]. Top Spinal Cord Inj Rehabil,2013,19(1):1-8. |
| [2] | Thuret S,Moon LD,Gage FH. Therapeutic interventions after spinal cord injury[J]. Nat Rev Neurosci,2006,7(8):628-643. |
| [3] | Wu D,Yang P,Zhang X,et al. Targeting a dominant negative rho kinase to neurons promotes axonal outgrowth and partial functional recovery after rat rubrospinal tract lesion[J]. Mol Ther,2009,17(12):2020-2030. |
| [4] | Pêgo AP,Kubinova S,Cizkova D,et al. Regenerative medicine for the treatment of spinal cord injury: more than just promises?[J]. J Cell Mol Med,2012,16(11):2564-2582. |
| [5] | 夏海坚,刘 丹,钟 东,等.具备不同拓扑结构的聚甲基丙烯酸甲酯静电纺丝纳米纤维细胞支架的构建及鉴定[J].重庆医科大学学报,2014,39(4):515-519. |
| [6] | 夏海坚,刘 丹,钟 东,等.聚甲基丙烯酸甲酯静电纺丝纳米纤维的拓扑结构对于PC12细胞神经突生长能力和方向的影响[J].第三军医大学学报,2014,36(4):351-354. |
| [7] | 夏海坚,刘 丹,钟 东,等.有序聚甲基丙烯酸甲酯电纺纳米纤维作为大鼠背根神经元负载支架的可行性研究[J]. 第三军医大学学报,2015,37(4):335-339. |
| [8] | 夏海坚,刘 丹,钟 东,等. 聚甲基丙烯酸甲酯静电纺丝纳米纤维对大鼠原代星形胶质细胞生长的影响[J]. 南方医科大学学报,2014,34(11):1569-1573. |
| [9] | Xie J,Li X,Xia Y. Putting Electrospun Nanofibers to Work for Biomedical Research[J]. Macromol Rapid Commun,2008,29(22):1775-1792. |
| [10] | Li Z,Gong Y,Sun S,et al. Differential regulation of stiffness,topography,and dimension of substrates in rat mesenchymal stem cells[J]. Biomaterials,2013,34(31):7616-7625. |
| [11] | Hoffman-Kim D,Mitchel JA,Bellamkonda RV. Topography,cell response,and nerve regeneration[J]. Annu Rev Biomed Eng,2010,12:203-231. |
| [12] | Ciobanasu C,Faivre B,Le Clainche C. Integrating actin dynamics,mechanotransduction and integrin activation: the multiple functions of actin binding proteins in focal adhesions[J]. Eur J Cell Biol,2013,92(10/11):339-348. |
| [13] | McCormick AM,Leipzig ND. Neural regenerative strategies incorporating biomolecular axon guidance signals[J]. Ann Biomed Eng,2012,40(3):578-597. |
| [14] | von der Mark K,Park J,Bauer S,et al. Nanoscale engineering of biomimetic surfaces: cues from the extracellular matrix[J]. Cell Tissue Res,2010,339(1):131-153. |
 2016, Vol. 42
2016, Vol. 42


