扩展功能
文章信息
- 曲萌, 于春艳, 翁诗雅, 高润泽, 王珍霞, 宋宇, 李旭甡, 郑鸿, 尹含钰, 董志恒
- QU Meng, YU Chunyan, WENG Shiya, GAO Runze, WANG Zhenxia, SONG Yu, LI Xushen, ZHENG Hong, YIN Hanyu, DONG Zhiheng
- 北五味子提取物对糖尿病大鼠心肌组织中NOX2和p47phox表达的影响
- Effect of Schisandrae Chinensis extracts on expressions of NOX2 and p47phox in myocardium tissue of diabetic rats
- 吉林大学学报(医学版), 2020, 46(05): 1029-1035
- Journal of Jilin University (Medicine Edition), 2020, 46(05): 1029-1035
- 10.13481/j.1671-587x.20200521
-
文章历史
- 收稿日期: 2020-01-16
2. 北华大学医学院病理学教研室, 吉林 吉林 132013;
3. 吉林省长春市中心医院老年病科, 吉林 长春 130051
2. Department of Pathology, College of Medical Sciences, Beihua University, Jilin 132013, China;
3. Department of Geriatrics, Changchun Central Hospital, Jilin Province Changchun 130051, China
糖尿病心肌病(diabetic cardiomyopathy,DCM)是独立于高血压和冠心病等已知心脏疾病的糖尿病患者的一种特异性心肌结构与功能的异常,以心肌肥大、纤维化、缩舒功能障碍和心力衰竭为其主要特征,现已成为糖尿病患者致死致残的主要原因[1-3]。研究[4-5]表明:DCM的发病是糖脂代谢紊乱及其氧化应激和细胞因子活化等多种因素综合作用的结果,其中氧化应激(oxidative stress,OS)在DCM的发生发展中起着重要作用。OS是指机体氧化系统和抗氧化系统之间失衡,机体内活性氧簇(reactive oxygen species,ROS)和活性氮(reactive nitrogen species,RNS)等高活性分子生成过多,进而导致组织损伤的一种状态[6]。还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶是由催化亚基和调控亚基组成的酶复合体,是体内ROS的重要来源,降低NADPH氧化酶活性,抑制OS反应是防治DCM的有效方法[7]。北五味子为木兰科植物五味子的成熟果实,含有木脂素、多糖、皂苷和黄酮等多种成分,具有收敛固涩、益气生津和补肾宁心等作用。近年来随着对北五味子化学成分和药理作用深入研究及开发利用,其降血脂、抗血小板聚集和抗氧自由基等作用逐渐成为学者们研究与开发的热点[8-9],而有关五味子及其提取物对DCM影响的报道较少。本研究旨在观察糖尿病大鼠心肌组织OS水平,并采用不同剂量北五味子提取物(Schisandrae Chinensis extracts,SCE)进行干预,探讨SCE对糖尿病大鼠心肌OS水平的影响及其心肌保护作用,为进一步研究北五味子的药效和药物作用机制提供实验依据,也为DCM的临床防治提供新的靶标和方法。
1 材料与方法 1.1 实验动物、主要试剂和仪器6周龄清洁级健康雄性Wistar大鼠59只,体质量(210±20)g,由吉林大学实验动物中心提供,动物生产许可证号:SCXK(吉)2007-0003。实验期间,室温控制在(19±1)℃,湿度48%,所有大鼠均单笼饲养,自由饮食水。SCE由吉林大学药学院提供(每克提取物中含五味子甲素0.3 mg和五味子乙素0.4 mg),链脲佐菌素(STZ,美国Sigma公司),肌酸激酶(CK)和乳酸脱氢酶(LDH)测试盒(上海华臣生化试剂有限公司),丙二醛(MDA)、超氧化物歧化酶(SOD)和谷胱甘肽激酶(GSH)测试盒(南京建成生物工程研究所),荧光实时定量PCR试剂盒(日本TaKaRa公司),NADPH氧化酶亚单位NOX2和p47phox及内参引物由生工生物工程(上海)有限公司合成,鼠抗NOX2、p47phox、β-actin抗体和羊抗鼠二抗及增强发光(ECL)试剂盒(美国Santa Cruz公司),其他试剂均为国产分析纯。日立7150全自动生化分析仪(日本日立公司),ABI实时定量PCR扩增仪(美国应用生物系统公司),电泳仪、转膜仪和凝胶成像仪(美国Biobad公司)。
1.2 糖尿病大鼠模型的制备、实验动物分组及给药所有大鼠适应性喂养1周,空腹血糖(FBG)均正常。随机选取其中49只大鼠禁食12 h后,在空腹状态下,按55 mg•kg-1腹腔单次注射STZ(临用前溶于0.1 mol•L-1、pH4.2无菌柠檬酸盐缓冲液中,终浓度为2%),分别于注射3和7 d后,鼠尾静脉取血测定FBG及尿糖定性,连续3次FBG≥16.7 mmol•L-1,尿糖定性≥+++,且伴有多饮、多食和多尿者确定为糖尿病模型大鼠。除去4只因FBG急骤升高而死亡的大鼠,剩余45只大鼠造模成功并纳入实验。同时设立正常对照组(n=10),仅腹腔注射等体积的无菌柠檬酸盐缓冲液。造模成功的大鼠随机分4组:模型组(n=12)、低剂量SCE组(n=11)、中剂量SCE组(n=11)和高剂量SCE组(n=11)。低、中和高剂量SCE组分别给予100、200和400 mg•kg-1的SCE混悬液灌胃,正常对照组和模型组大鼠给予等量生理盐水灌胃,每天1次。每周称体质量1次,调整用药剂量,持续观察12周。实验期间所有大鼠未使用胰岛素治疗。
1.3 标本留取12周末,各组大鼠禁食,称体质量,按3 mL•kg-1剂量腹腔注射10%水合氯醛溶液麻醉。在无菌条件下腹主动脉取血,分离血清用于测定FBG和心肌酶水平。剪取心脏,冰生理盐水冲洗后,滤纸拭干,剪去心房和右心室游离壁,称取左心室质量,用于计算左心室质量指数(left ventricular mass index,LVMI)(LVMI=左心室湿质量/体质量)。取左心室心尖部组织固定于10%中性甲醛,常规脱水、浸蜡和包埋,制成4 μm厚度切片,用于HE染色。剩余左心室组织置于-80℃冰箱保存,待测心肌组织MDA水平,SOD和GSH活性,荧光实时定量PCR法检测各组大鼠心肌组织中NOX2和p47phox mRNA表达水平,Western blotting法检测各组大鼠心肌组织中NOX2和p47phox蛋白表达水平。
1.4 实验室指标检测应用全自动分析仪检测FBG和心肌损伤标志物(CK和LDH)水平。采用比色法测定心肌组织中MDA水平及SOD和GSH活性,采用考马斯亮蓝法测定组织蛋白水平。所有测定步骤严格按照试剂说明书操作。
1.5 实时荧光定量PCR法检测大鼠心肌组织中NOX2和p47phox mRNA表达水平Trizol法提取心肌组织总RNA,逆转录合成cDNA,应用实时荧光定量PCR仪进行扩增反应,反应总体积20 μL,反应条件:95℃预变性10 min,(95℃、15 s,60℃、30 s,72℃、30 s)×40个循环,每个样本设6个复孔。NOX2:上游引物5'-GTGTGTGAATGCCAGAGTCG-3',下游引物5'-TTCAAAGTAAGACCTCCGAATGG-3'p47phox:上游引物5'-TCAGAATGTTGCCTGGTTGGT-3',下游引物5'-GCCGACCTTGAACGTAACAG-3';β-actin:上游引物5'-AGCGGGAAATCGTGCGTG-3',下游引物5'-GGGTACATGGTGGTGCCG-3'。采用2-ΔΔCt法(ΔΔCt =试验样品ΔCt-基准样品ΔCt)计算各组心肌组织中目的基因mRNA表达水平;若2-ΔΔCt>1,提示目的基因表达水平升高;若2-ΔΔCt < 1,提示目的基因表达水平降低。
1.6 Western blotting法检测大鼠心肌组织中NOX2和p47phox蛋白表达低温提取大鼠心肌组织蛋白,BCA法测定蛋白浓度。每孔上样50 μg蛋白,10% SDS-PAGE电泳分离样品,转膜,封闭,分别滴加β-actin(1:2 000)、NOX2(1:200)和p47phox(1:200)一抗,4℃过夜。洗膜,滴加二抗(1:2 000),37℃孵育2 h,洗膜;与ECL发光反应液反应,化学发光成像系统显色并分析各条带灰度值。目的蛋白表达水平=目的蛋白条带灰度值/β-actin条带灰度值。
1.7 统计学分析采用SPSS 19.0统计软件进行统计学分析。各组大鼠血清中FBG、CK和LDH水平,LVMI,心肌组织中MDA水平,SOD和GSH活性,心肌组织中NOX2和p47phox mRNA及蛋白表达水平均符合正态分布,以(x±s)表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q法。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠一般情况、血清FBG、心肌酶水平及LVMI实验期间,正常对照组大鼠身体状况和精神状态良好,未发生死亡;模型组大鼠早期多动,后期反应迟钝,精神萎靡,动作迟缓,体瘦背弓,毛竖而无光泽,多饮、多食和多尿症状明显,体质量减轻,部分大鼠出现尾和趾溃烂,皮下脓肿及白内障等症状。与模型组比较,低、中和高剂量SCE组大鼠饮水量、食量和尿量均明显减少,精神状态、行动及毛色、体态均有所好转,尤其是高剂量SCE组最为明显。除正常对照组外,其余各组大鼠均有死亡,其中模型组4只大鼠和低剂量SCE组2只大鼠因FBG过高或感染死亡;高剂量SCE组1只大鼠死于胸部皮下感染;低、中和高剂量SCE组各有1只大鼠死于灌胃窒息。
与正常对照组比较,各组糖尿病大鼠FBG水平明显升高(P < 0.05或P < 0.01);与模型组比较,低、中和高剂量SCE组大鼠FBG均明显降低(P < 0.05或P < 0.01),且呈一定的剂量依赖性。各组糖尿病大鼠心肌损伤标志物CK和LDH水平及LVMI均明显高于正常对照组(P < 0.05或P < 0.01);与模型组比较,各剂量SCE组大鼠血清中CK和LDH水平及LVMI均有不同程度降低(P < 0.05或P < 0.01),其中高剂量SCE组大鼠CK和LDH水平及LVMI降低最明显。见表 1。
| (x±s) | |||||||||||||||||||||||||||||
| Group | n | FBG[cB/(mmol•L-1)] | CK[λB/(U•L-1)] | LDH[λB/(U•L-1)] | LVMI[wB/(mg•g-1) | ||||||||||||||||||||||||
| Normal control | 10 | 5.69±1.39 | 145.77±12.94 | 201.43±24.68 | 2.04±0.18 | ||||||||||||||||||||||||
| Model | 8 | 25.90±3.79** | 2 475.67±291.92** | 686.83±26.78** | 3.77±0.23** | ||||||||||||||||||||||||
| SCE | |||||||||||||||||||||||||||||
| Low dose | 8 | 15.06±3.51**△ | 1 899.67±264.01** | 576.25±34.28**△△ | 3.26±0.22**△ | ||||||||||||||||||||||||
| Medium dose | 10 | 12.81±2.37**△ | 1 820.65±158.03**△ | 544.32±27.60**△△ | 2.84±0.20**△△ | ||||||||||||||||||||||||
| High dose | 9 | 10.48±3.76**△△ | 1 747.01±281.09**△ | 492.94±34.81**△△ | 2.64±0.20*△△ | ||||||||||||||||||||||||
| *P < 0.05,** P < 0.01 vs normal control group;△P < 0.05,△△P < 0.01 vs model group. | |||||||||||||||||||||||||||||
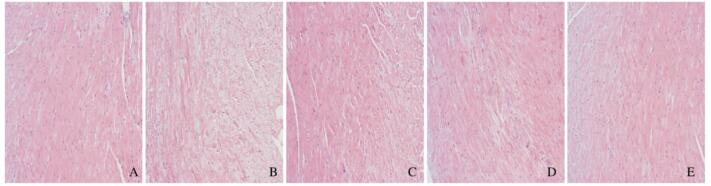
HE染色结果显示:正常对照组大鼠心肌细胞排列整齐,细胞核明显,大小较均匀。模型组大鼠心肌细胞排列紊乱,细胞核周围可见空泡性病变,核固缩增多,细胞坏死,纤维化,局部可见炎细胞浸润。与模型组比较,低、中和高剂量SCE组大鼠心肌组织中上述病理变化均有不同程度的改善,见图 1(插页六)。
|
| A: Normal control group; B: Model group; C: Low dose of SCE group; D: Medium dose of SCE group; E: High dose of SCE group. 图 1 各组大鼠心肌组织病理形态表现 (HE, ×200) Fig. 1 Pathomorphology of myocardium tissue of rats 1n var1ous groups (HE, ×200) |
|
|
与正常对照组比较,12周末模型组和低、中及高剂量SCE组大鼠心肌组织中MDA水平明显升高(P < 0.05),SOD和GSH活性明显降低(P < 0.05)。与模型组比较,低、中和高剂量SCE组大鼠心肌组织中MDA水平明显降低(P < 0.05),SOD和GSH活性明显升高(P < 0.05或P < 0.01),其中高剂量SCE组干预效果更明显。见表 2。
| (x±s) | |||||||||||||||||||||||||||||
| Group | n | MDA[mB/(μmol•g-1)] | SOD[λB/(U•mg-1)] | GSH[λB/(U•mg-1)] | |||||||||||||||||||||||||
| Normal control | 10 | 3.93±0.59 | 149.50±12.16 | 0.340±0.040 | |||||||||||||||||||||||||
| Model | 8 | 12.56±0.94* | 111.43±13.82* | 0.120±0.046* | |||||||||||||||||||||||||
| SCE | |||||||||||||||||||||||||||||
| Low dose | 8 | 9.67±0.93*△ | 157.93±12.93△△ | 0.190±0.021* | |||||||||||||||||||||||||
| Medium dose | 10 | 9.01±0.97*△ | 172.57±16.16△△ | 0.220±0.030*△ | |||||||||||||||||||||||||
| High dose | 9 | 7.33±1.15*△ | 181.59±8.92△△ | 0.230±0.035*△ | |||||||||||||||||||||||||
| *P < 0.05,** P < 0.01 vs normal control group;△P < 0.05,△△P < 0.01 vs model group. | |||||||||||||||||||||||||||||
12周末,模型组和低、中及高剂量SCE组大鼠心肌组织中NOX2和p47phox mRNA表达水平较正常对照组明显升高(P < 0.01);与模型组比较,低、中和高剂量SCE组大鼠心肌组织中NOX2和p47phox mRNA表达水平明显降低(P < 0.01);高剂量SCE组降低效果更明显。见表 3。
| (x±s) | |||||||||||||||||||||||||||||
| Group | n | NOX2 mRNA | p47phox mRNA | ||||||||||||||||||||||||||
| Normal control | 10 | 1.00±0.00 | 1.00±0.00 | ||||||||||||||||||||||||||
| Model | 8 | 3.60±0.09* | 3.30±0.17* | ||||||||||||||||||||||||||
| SCE | |||||||||||||||||||||||||||||
| Low dose | 8 | 2.58±0.07*△ | 2.86±0.14*△ | ||||||||||||||||||||||||||
| Medium dose | 10 | 2.39±0.04*△ | 2.69±0.05*△ | ||||||||||||||||||||||||||
| High dose | 9 | 2.23±0.09*△ | 2.55±0.06*△ | ||||||||||||||||||||||||||
| * P < 0.01 vs normal control group;△P < 0.01 vs model group. | |||||||||||||||||||||||||||||
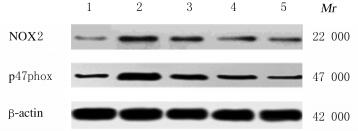
12周末,与正常对照组比较,模型组大鼠心肌组织中NOX2和p47phox蛋白表达水平明显升高(P < 0.01);与模型组比较,低、中和高剂量SCE组大鼠心肌组织中NOX2和p47phox蛋白表达水平明显降低(P < 0.05或P < 0.01),其中高剂量SCE组降低效果更明显。见表 4和图 2。
| (x±s) | |||||||||||||||||||||||||||||
| Group | n | NOX2 protein | p47phox protein | ||||||||||||||||||||||||||
| Normal control | 10 | 0.21±0.04 | 0.34±0.03 | ||||||||||||||||||||||||||
| Model | 8 | 0.58±0.05* | 0.72±0.04* | ||||||||||||||||||||||||||
| SCE | |||||||||||||||||||||||||||||
| Low dose | 8 | 0.46±0.03*△ | 0.62±0.04*△△ | ||||||||||||||||||||||||||
| Medium dose | 10 | 0.35±0.04*△△ | 0.51±0.03*△△ | ||||||||||||||||||||||||||
| High dose | 9 | 0.28±0.03*△△ | 0.46±0.04*△△ | ||||||||||||||||||||||||||
| * P < 0.01 vs normal control group;△P < 0.05, △△P < 0.01 vs model group. | |||||||||||||||||||||||||||||
|
| Lane 1: Normal control group; Lane 2: Model group; Lane 3: Low dose of SCE group; Lane 4: Medium dose of SCE group; Lane 5: High dose of SCE group. 图 2 各组大鼠心肌组织中NOX2和p47phox蛋白表达电泳图 Fig. 2 Electrophoretogram of expressions of NOX2 and p47phox proteins in myocardium tissue of rats in various groups |
|
|
DCM是糖尿病常见慢性并发症之一,是一种独立的特异性心肌损伤,主要表现为心肌细胞代谢紊乱、心肌间质纤维化并伴有心脏微血管病变,最终引起左室壁肥厚,心脏舒缩功能减退。本研究采用单次腹腔注射STZ制备糖尿病模型,造模大鼠FBG水平明显升高,出现多饮、多食和多尿及体质量减轻症状,表明糖尿病模型建立成功。本研究结果显示:模型组大鼠LVMI增加,血清中心肌酶CK和LDH水平明显升高,心肌细胞胞质出现空泡变,核固缩增多,间质纤维化,表明12周末糖尿病大鼠已出现明显的心肌损伤;而经SCE干预后,上述表现均有不同程度改善,尤其是高剂量SCE组,提示SCE可降低FBG水平,减轻糖尿病模型大鼠心肌组织的异常变化,具有良好的心肌保护作用。
DCM发病机制复杂,越来越多的研究[10-11]证实:高血糖所诱导的OS是糖尿病心血管慢性并发症发病进程中的高危险因素。研究[12]表明:高血糖可导致线粒体功能紊乱,产生过量的过氧化物,继而诱导心肌细胞代谢障碍,引起心肌肥厚和间质纤维化,因此糖尿病大鼠体内ROS的增多是引起糖尿病心肌损伤的一个重要促发因素。NADPH氧化酶是体内组织细胞ROS的主要来源,主要由位于细胞膜的p22phox和gp91phox、胞质的p47phox及p67phox构成[13-14]。NOX是催化亚基gp91phox的同源物,广泛存在于多种非吞噬细胞,主要包括NOX 1~5、Duox1和Duox2,是线粒体外ROS的主要来源[15]。研究[16-17]证实:NOX亚单位NOX2和p47phox的活化对NADPH氧化酶产生ROS起着至关重要的作用。NADPH氧化酶的激活及其组成亚基的表达上调参与了糖尿病心血管并发症的发生[18]。研究[19]显示:糖尿病动物模型体内氧自由基损伤组织的重要标志物MDA水平早期明显升高,12周可达到最高水平。与此同时,体内还存在抗氧化损伤的防御系统,其中SOD和GSH是体内清除ROS的主要抗氧化酶,SOD可将体内氧自由基转化成H2O2,后者在过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的作用下再转变成H2O,进而消除氧自由基对机体组织的损伤[20]。本研究结果显示:12周末,糖尿病大鼠心肌组织中NOX2和p47phox mRNA及蛋白表达水平上调,MDA水平升高,抗氧化酶SOD和GSH活性明显下降,表明在长期高血糖环境下,糖尿病大鼠心肌组织氧化作用增强,抗氧化作用降低,氧化和抗氧化系统失衡,导致ROS大量蓄积,OS水平增强,进而造成脂类等生物大分子氧化损伤,导致脂质过氧化终产物MDA水平升高,提示糖尿病高血糖状态下心肌损伤的发生与心肌组织OS水平增强有关,NOX2和p47phox的活化在DCM的发生发展中起重要的作用。
北五味子主产于我国东北地区,是长白山特产的常用中药材,具有改善血液循环、增强免疫力、抗衰老和抗氧化等作用[21-23]。本研究结果显示:SCE干预12周,可以明显降低糖尿病大鼠心肌组织中NOX2和p47phox mRNA及蛋白表达水平,增加SOD和GSH活性,降低MDA水平,且存在一定的剂量依赖性,表明SCE是通过调控心肌组织OS水平而在DCM发展进程中发挥作用。
综上所述,SCE可能通过降低FBG、抑制糖尿病模型大鼠心肌组织中NADPH氧化酶表达,增加抗氧化酶活性,降低心肌OS水平,进而对糖尿病大鼠心肌起到保护作用,但其具体有效成分的作用以及对细胞外信号通路的影响尚有待进一步研究。
| [1] |
潘大彬, 汪旻晖, 曹蘅. 糖尿病心肌病发病机制的研究进展[J]. 中国临床药理学与治疗学, 2013, 18(7): 831-836. |
| [2] |
CHIU A P, WAN A, RODRIGUES B. Cardiomyocyte-endothelial cell control of lipoprotein lipase[J]. Biochim Biophys Acta, 2016, 1861(10): 1434-1441. DOI:10.1016/j.bbalip.2016.03.016 |
| [3] |
汪晓霞, 王婵媛, 林颖慧, 等. 缬沙坦对糖尿病大鼠心肌保护作用以及氧化应激的影响[J]. 现代生物医学进展, 2015, 15(24): 4627-4630. |
| [4] |
JOSHI M, KOTHA S R, MALIREDDY S, et al. Conundrum of pathogenesis of diabetic cardiomyopathy:role of vascular endothelial dysfunction, reactive oxygen species, and mitochondria[J]. Mol Cell Biochem, 2014, 386(1/2): 233-249. |
| [5] |
OGAWA S, MORI T, NAKO K, et al. Angiotensin Ⅱ type 1 receptor blockers reduce urinary oxidative stress markers in hypertensive diabetic nephropathy[J]. Hypertension, 2006, 47(4): 699-705. DOI:10.1161/01.HYP.0000203826.15076.4b |
| [6] |
YERRA V G, KALVALA A K, KUMAR A. Is oliquiritigenin reduces oxidative damage and alleviates mitochondrial impairment by SIRT1 activation in experimental diabetic neuropathy[J]. J Nutr Biochem, 2017, 47: 41-52. DOI:10.1016/j.jnutbio.2017.05.001 |
| [7] |
李佳伟, 郭志新. 替米沙坦对2型糖尿病大鼠心肌NADPH氧化酶亚单位表达的影响[J]. 解放军医学杂志, 2011, 36(10): 1037-1040. |
| [8] |
王瑶, 张彦飞, 贡济宇. 五味子多糖质量浓度测定及生物活性研究[J]. 长春中医药大学学报, 2013, 29(4): 733-734. |
| [9] |
蒋军辉, 徐小娜, 王辉, 等. 五味子抗氧化作用研究[J]. 海峡药学, 2015, 27(1): 30-32. |
| [10] |
许文奇, 李先伟, 郝伟, 等. 红杉醇对2型糖尿病大鼠心肌NADPH氧化酶亚单位p22phox、P47phox及iNOS蛋白表达的影响[J]. 中国临床药理学与治疗学, 2014, 19(6): 626-631. |
| [11] |
金海英, 王萍. 糖尿病患者血清VEGF、KIM-1、IL-6及NADPH浓度的变化及其意义[J]. 现代医学, 2019, 47(1): 63-66. |
| [12] |
HUYNH K, BERNARDO B C, MCMULLEN J R, et al. Diabetic cardiomyopathy:Mechanisms and new treatment strategies targeting antioxidant signaling pathways[J]. Pharmacol Ther, 2014, 142(3): 375-415. DOI:10.1016/j.pharmthera.2014.01.003 |
| [13] |
SUN X, CHEN R C, YANG Z H, et al. Taxifolin prevents diabetic cardiomyopathy in vivo and in vitro by inhibition of oxidative stress and cell apoptosis[J]. Food Chem Toxicol, 2014, 63: 221-232. DOI:10.1016/j.fct.2013.11.013 |
| [14] |
HUYNH K, KIRIAZIS H, DU X J, et al. Targeting the upregulation of reactive oxygen species subsequent to hyperglycemia prevents type 1 diabetic cardiomyopathy in mice[J]. Free Radic Biol Med, 2013, 60: 307-317. DOI:10.1016/j.freeradbiomed.2013.02.021 |
| [15] |
BELAMBRI S A, ROLAS L, RAAD H, et al. NADPH oxidase activation in neutrophils:Role of the phosphorylation of its subunits[J]. Eur J Clin Invest, 2018, 48(Suppl 2): e12951. |
| [16] |
KUMAR R, THOMAS C M, YONG Q C, et al. The intracrine renin-angiotensin system[J]. Clin Sci, 2012, 123(5): 273-284. DOI:10.1042/CS20120089 |
| [17] |
陈祥攀, 杨解人, 李先伟, 等. 红杉醇对2型糖尿病大鼠肝病NADPH氧化酶亚单位p22phox和p47phox表达的影响[J]. 药学学报, 2013, 48(4): 489-494. |
| [18] |
成扶雨, 余琪琪, 袁伟. NADPH氧化酶在糖尿病心血管并发症中的研究进展[J]. 实用医学杂志, 2019, 35(14): 2342-2346. |
| [19] |
贾奇, 邓健锟, 冯振东, 等. 蝉花通过抑制肾小管NADPH氧化酶/氧化应激治疗糖尿病肾病的研究[J]. 中国中西医结合肾病杂志, 2018, 19(12): 1043-1047. |
| [20] |
刘江月. 梓醇抑制NADPH氧化酶保护2型糖尿病早期血管内皮功能[J]. 中国中药杂志, 2014, 39(15): 2936-2941. |
| [21] |
李宜轩, 陈建光, 李凤, 等. 北五味子提取物对实验性肝纤维化大鼠肝损伤的保护作用[J]. 吉林大学学报(医学版), 2014, 40(2): 285-288. |
| [22] |
杨江辉, 孙成博, 耿嘉男, 等. 五味子提取物对糖尿病大鼠肾脏组织中基质金属蛋白酶表达的影响及其肾脏保护作用[J]. 吉林大学学报(医学版), 2017, 43(3): 512-517. |
| [23] |
黄妍, 刘秀, 陶薇, 等. 五味子化学成分及抗2型糖尿病活性研究进展[J]. 中草药, 2019, 50(7): 1739-1744. |
 2020, Vol. 46
2020, Vol. 46


