扩展功能
文章信息
- 葛静, 谢磊, 李林, 魏旭静, 陈然, 王娜
- GE Jing, XIE Lei, LI Lin, WEI Xujing, CHEN Ran, WANG Na
- 整合素连接激酶在子宫内膜癌组织中的表达及其对细胞迁移和侵袭能力的影响
- Expression of integrin-linked kinase in endometrial carcinoma tissue and its effects on migration and invasion abilities of cells
- 吉林大学学报(医学版), 2020, 46(05): 1011-1015
- Journal of Jilin University (Medicine Edition), 2020, 46(05): 1011-1015
- 10.13481/j.1671-587x.20200518
-
文章历史
- 收稿日期: 2019-08-30
子宫内膜癌是常见的妇科恶性肿瘤,其发病率高,占女性生殖系统恶性肿瘤的25%~35%[1]。临床上对子宫内膜癌的治疗手段主要有手术治疗、孕激素治疗和化学药物治疗等[2-4],多数子宫内膜癌患者经过治疗后预后良好,但仍有部分晚期患者出现复发,且复发患者预后较差[5]。研究[6]表明:子宫内膜癌患者预后不良的主要原因是出现癌细胞侵袭和转移。因此,对子宫内膜癌细胞侵袭和转移的生物学指标展开研究具有重要意义。基因靶向治疗是近年来有效治疗恶性肿瘤的方法,具有靶向性强和不良反应少的特点。整合素连接激酶(integrin-linked kinase,ILK)是一种丝氨酸/苏氨酸蛋白激酶,在多种恶性肿瘤组织中其表达水平均明显升高,可通过多条信号转导途径参与肿瘤细胞的增殖、侵袭和转移等生物行为过程[7-8]。目前,国内外关于ILK与子宫内膜癌关系方面的研究较少。本研究旨在观察ILK在子宫内膜癌组织和细胞中的表达情况,分析其对子宫内膜癌细胞侵袭和转移的影响及其可能的作用机制,为寻求抑制子宫内膜癌细胞侵袭和转移提供新靶点。
1 材料与方法 1.1 细胞、主要试剂和仪器人子宫内膜癌HEC-1B细胞购自中科院上海细胞库。DMEM培养基购自美国Sigma公司,胰蛋白酶购自美国Gibco公司,ILK siRNA由武汉晶赛公司提供,免疫组织化学SP试剂盒购自福州迈新生物技术开发有限公司,二喹啉甲酸(bicinchoninic acid disodium,BCA)蛋白定量试剂盒购自北京普利莱基因技术有限公司,鼠抗人ILK单克隆抗体购自美国Santa Cruz公司,兔抗人蛋白激酶B(protein kinase B,Akt)和糖原合成酶激酶3β(glycogen synthase kinase-3β,GSK-3β)多克隆抗体、磷酸化Akt(p-Akt)和磷酸化GSK-3β(p-GSK-3β)多克隆抗体及GAPDH多克隆抗体均购自美国Abcam公司,辣根过氧化物酶标记羊抗兔IgG购自北京中杉金桥公司。MM-800型光学显微镜(日本尼康公司),DYCZ-24KS型双板垂直电泳仪(北京六一生物科技有限公司)。
1.2 标本收集选取2018年1月-2019年1月本院收治的29例手术切除子宫内膜癌患者,所有患者病理诊断明确,术前均未接受过放化疗或药物干预治疗,患者年龄35~74岁,平均年龄(51.37 ± 10.30)岁。取子宫内膜癌组织和癌旁正常组织置于-80℃冰箱中保存。本研究经本院伦理委员会批准,并取得患者知情同意。
1.3 免疫组织化学SP法检测子宫内膜癌细胞中ILK阳性表达率取子宫内膜癌组织和癌旁正常组织,采用免疫组织化学SP法染色,严格按说明书操作。阳性判断标准:每张切片随机取5个视野计数100个肿瘤细胞,按其着色强度与阳性细胞数评分并求均值。着色强度评分标准:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞百分率:无阳性细胞为0分,0% < 阳性细胞数≤4%为1分,4% < 阳性细胞数≤24%为2分,24% < 阳性细胞数≤49%为3分,阳性细胞数>49%为4分。以两者得分乘积>3分为(+),表示该病例显示阳性反应。
1.4 细胞培养将子宫内膜癌HEC-1B细胞接种于含10%胎牛血清的DMEM培养液,于37℃、饱和湿度及5% CO2培养箱中培养。当细胞密度达到80%时,用0.25%的胰蛋白酶消化传代。细胞培养至对数生长期后,胰蛋白酶消化,采用细胞培养液调整细胞浓度为每毫升3 × 104个细胞,以每孔1 mL接种于6孔细胞培养板中,细胞生长至融合度为80%时,采用Lipofectamine 2000转染细胞,分别作为干扰组和空载组,同时以转染的细胞为对照组,转染48 h。
1.5 Western blotting法检测HEC-1B细胞中ILK、Akt、p-Akt、GSK-3β和p-GSK-3β蛋白表达水平用细胞裂解液裂解细胞20 min,12 000 r•min-1离心15 min,提取各组细胞总蛋白,BCA法测定蛋白含量。酶标仪测定各组蛋白含量并配平,使各组蛋白终浓度为5 g • L–1。每个加样孔加样50 μg,采用SDS-PAGE凝胶电泳分离蛋白,电泳,转膜。于37℃封闭2 h,采用鼠抗人ILK单克隆抗体(1︰300)和兔抗人Akt多克隆抗体(1︰1 000)、p-Akt多克隆抗体(1︰1 000)、GSK-3β多克隆抗体(1︰1 000)、磷酸化的GSK-3β(p-GSK-3β)(1︰1 000)和GAPDH(1︰10 000),4℃孵育过夜,TBST漂洗,37℃孵育山羊抗兔IgG(1︰10 000)二抗20 min,TBST漂洗,ECL试剂显色,Bio-Rad发光系统呈像,检测分析条带灰度值,目的蛋白相对表达水平=目的蛋白条带灰度值/ GAPDH条带灰度值。
1.6 细胞划痕实验检测细胞迁移距离干扰组、空载组和对照组细胞培养至对数生长期后,以每毫升2 × 105个细胞铺于6孔细胞培养板,培养过夜,待细胞完全贴壁后,吸除上清液,用200 μL移液枪枪头划出细胞刮痕,用无血清培养基洗涤划下的细胞。加入细胞培养液,置于37℃、5% CO2培养箱中培养24 h。在倒置显微镜下观察0和24 h划痕宽度,计算细胞迁移距离。细胞迁移距离=0 h划痕宽度-24 h划痕宽度。
1.7 Transwell小室法检测细胞侵袭数将基质胶加入到24孔Transwell小室中,并将其小室置于37℃培养箱中湿化3 h,待基质胶凝固后,加入不含胎牛血清的细胞培养液继续孵育40 min。取细胞悬浮液加入小室的上室,在小室的下室加入750 μL含有胎牛血清的细胞培养液。培养24 h后,取出小室,用棉签将非入侵性细胞擦掉,采用甲醇和苏木素染色将通过膜和黏膜下表面迁移的细胞固定。在显微镜下随机选取6个视野,观察侵袭细胞数,以侵袭细胞数反映细胞侵袭能力。
1.8 统计学分析采用SPSS 20.0统计软件进行统计学分析。子宫内膜癌和癌旁正常组织中ILK阳性表达率以百分率(%)表示,2组间百分率比较采用χ2检验。各组细胞中ILK、Akt、p-Akt、GSK-3β和p-GSK-3β蛋白表达水平,细胞迁移距离及侵袭细胞数均符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 子宫内膜癌组织和癌旁正常组织中ILK阳性表达率29例子宫内膜癌和癌旁正常组织中,23例癌组织ILK为(+),阳性表达率为79.3%;3例癌旁正常组织ILK为(+),阳性表达率为10.3%,ILK在子宫内膜癌组织中的阳性表达率明显高于癌旁正常组织(P < 0.05)。
2.2 各组细胞中ILK蛋白表达水平与对照组和空载组比较,干扰组细胞ILK蛋白的表达水平明显降低,约降低60%。见图 1。
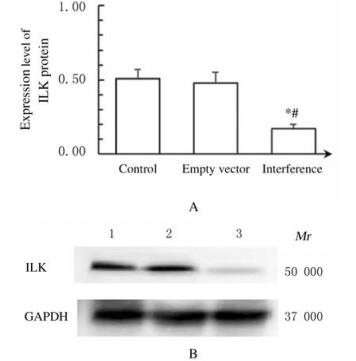
|
| Lane 1 : Control group; Lane 2 : Empty vector group; Lane 3 : Interference group.*P < 0.05 vs control group; #P < 0.05 vs empty vector group. 图 1 各组细胞中ILK蛋白表达电泳图 Fig. 1 Electrophoregram of expressions of ILK protein in cells in various groups |
|
|
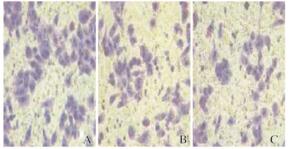
与对照组和空载组比较,干扰组细胞迁移距离明显缩短(P < 0.05),表明干扰组细胞迁移能力明显降低;与对照组和空载组比较,干扰组侵袭细胞数明显减少(P < 0.05),表明干扰组细胞侵袭能力明显降低。见表 1、图 2和图 3(插页五)。
| (n=3, x±s) | |||||||||||||||||||||||||||||
| Group | Migration distance (l/μm) | Number of invasion cells | |||||||||||||||||||||||||||
| Control | 87.34±15.23 | 431.56±24.78 | |||||||||||||||||||||||||||
| Empty vector | 84.62±14.74 | 416.45±30.80 | |||||||||||||||||||||||||||
| Interference | 25.47±15.37*△ | 194.59±15.37*△ | |||||||||||||||||||||||||||
| *P < 0.05 vs control group; △P < 0.05 vs empty vector group. | |||||||||||||||||||||||||||||

|
| A-C:0 h; D-F:24 h.A, D: Control group; B, E: Empty vector group; C, F: Interference group. 图 2 细胞划痕实验检测各组细胞迁移情况(×100) Fig. 2 Migration of cells in various groups detected by cell scratch test (×100) |
|
|
|
| A: Control group; B: Empty vector group; C: Interference group. 图 3 各组细胞 Transwell 小室实验结果(甲醇和苏木素, ×200) Fig. 3 Results of Transwell chamber assay of cells in various groups ( Methanol and hematoxylin, × 200) |
|
|
与对照组和空载组比较,干扰组p-Akt和p-GSK-3β蛋白表达水平明显降低(P < 0.05),Akt和GSK-3β蛋白表达水平差异无统计学意义(P>0.05)。见表 2和图 4。
| (n=3, x±s) | |||||||||||||||||||||||||||||
| Group | Akt | p-Akt | GSK-3β | p-GSK-3β | |||||||||||||||||||||||||
| Control | 0.73±0.08 | 0.97±0.08 | 0.81±0.09 | 0.70±0.07 | |||||||||||||||||||||||||
| Empty vector | 0.75±0.08 | 0.92±0.10 | 0.76±0.08 | 0.68±0.08 | |||||||||||||||||||||||||
| Interference | 0.71±0.09 | 0.41±0.06*△ | 0.78±0.09 | 0.31±0.05*△ | |||||||||||||||||||||||||
| *P < 0.05 vs control group; △P < 0.05 vs empty vector group. | |||||||||||||||||||||||||||||
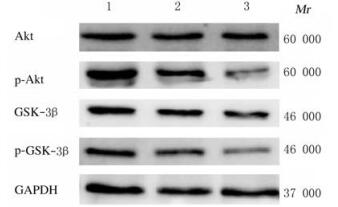
|
| Lane 1 : Control group; Lane 2 : Empty vector group; Lane 3 : Interference group. 图 4 各组细胞中Akt、p-Akt、GSK-3β和p-GSK-3β蛋白表达电泳图 Fig. 4 Electrophoregram of expressions of Akt, p-Akt, GSK-3β, and p-GSK-3β proteins in cells in various groups |
|
|
ILK是一种多功能的细胞内信号蛋白,能协调细胞外基质和生长因子的信号转导,调控细胞的增殖、分化、迁移、侵袭和血管生成[9-11]。上皮-间质细胞转化(epithelial-mesenchymal transition,EMT)是导致子宫内膜癌发生转移的直接原因,ILK蛋白作为EMT调控蛋白,主要通过诱导肿瘤细胞的EMT过程介导肿瘤细胞的迁移和侵袭[12]。研究[8, 13-15]表明:ILK蛋白在上皮性卵巢癌、子宫颈癌和胰腺癌等癌组织中过度表达,其患者预后差。本研究结果显示:在子宫内膜癌患者组织中ILK蛋白阳性表达率明显高于癌旁正常组织,与同类型研究[16]结果一致。
Akt是一种丝氨酸/苏氨酸激酶,是PI3K/Akt通路中的主要活性物质,参与血管形成、基因转录、细胞迁移和细胞周期调控等生物过程,与其下游调节因子GSK-3β共同参与细胞凋亡过程。p-GSK-3β可通过抑制促凋亡蛋白的蛋白线粒体转位,从而抑制细胞凋亡,促进肿瘤的发生发展[17]。研究[18-19]表明:ILK能够结合并磷酸化整合素β1亚单位,激活PIK3/Akt信号通路,磷酸化Akt。p-Akt能够降低GSK-3β活性,改变细胞周期,抑制细胞凋亡。本研究结果显示:沉默ILK基因后,p-Akt和p-GSK3β表达水平明显降低,GSK-3β的表达水平升高但差异无统计学意义。本研究结果表明:抑制ILK蛋白的表达能够阻断Akt/GSK-3β信号通路相关蛋白磷酸化,调控细胞周期,促进细胞凋亡。另外,siRNA沉默ILK基因后子宫内膜癌HEC-1B细胞的迁移和侵袭能力明显下降,与前期研究[20]结果一致,表明抑制ILK表达能够抑制肿瘤的发生和转移。
综上所述,ILK蛋白在子宫内膜癌患者组织中呈高水平表达,抑制子宫内膜癌HEC-1B细胞中ILK蛋白表达能够抑制细胞的迁移和侵袭能力,其机制可能与通过调控Akt/GSK-3β途径抑制Akt和GSK-3磷酸化有关。本研究结果将为ILK作为子宫内膜癌新的抗肿瘤治疗靶基因提供实验依据。
| [1] |
DOCKERY L E, TANAKA T T, ZHANG R, et al. Incidence and implications of circulating tumor cells in endometrial cancer[J]. Gynecol Oncol, 2019, 154(1): 24-27. |
| [2] |
POOKUNJU A P, AYYAPPAN S. Technique of laparoscopic hysterectomy and pelvic lymphadenectomy for endometrial cancer[J]. Indian J Surg Oncol, 2018, 9(2): 290-293. DOI:10.1007/s13193-017-0690-x |
| [3] |
顾超, 李斌. 子宫内膜癌激素替代治疗[J]. 中国实用妇科与产科杂志, 2011, 27(11): 823-825. |
| [4] |
COWAN M, STRAUSS J B, BARBER E L, et al. Updates on adjuvant chemotherapy and radiation therapy for endometrial cancer[J]. Curr Opin Obstet Gynecol, 2019, 31(1): 31-37. DOI:10.1097/GCO.0000000000000506 |
| [5] |
DABI Y, U ZAN J, BENDIFALLAH S, et al. Prognostic value of local relapse for patients with endometrial cancer[J]. Eur J Surg Oncol, 2017, 43(11): 2143-2149. DOI:10.1016/j.ejso.2017.08.004 |
| [6] |
佐晶, 安菊生, 宋艳, 等. 子宫内膜癌淋巴结转移及临床病理因素与预后的相关性[J]. 基础医学与临床, 2016, 36(6): 840-845. |
| [7] |
邢雷, 庄翔, 陈俊霞. 核糖核酸酶抑制因子与整合素连接激酶相互作用通过ILK/AKT/mTOR通路抑制膀胱癌体内外生长[J]. 中国癌症杂志, 2018, 28(1): 30-37. |
| [8] |
CHU P C, KULP S K, BEKAII-SAAB T, et al. Targeting integrin-linked kinase to suppress oncogenic KRAS signaling in pancreatic cancer[J]. Small Gtpases, 2018, 9(6): 452-456. DOI:10.1080/21541248.2016.1251383 |
| [9] |
李菁菁, 刘玉, 赵娟, 等. 过表达整合素连接激酶促进心脏c-Kit+细胞的存活和增殖[J]. 中国病理生理杂志, 2017, 33(9): 1537-1543. |
| [10] |
O'MEARA R W, CUMMINGS S E, MICHALSKI J P, et al. A new in vitro mouse oligodendrocyte precursor cell migration assay reveals a role for integrin-linked kinase in cell motility[J]. BMC Neurosci, 2016, 17(1): 7-22. |
| [11] |
MABETA P. 3P Anti-VEGF and integrin-linked kinase knockdown inhibit angiogenesis in vitro and suppress vascular tumor growth in vivo[J]. Ann Oncol, 2016, 27(9): 573-575. |
| [12] |
QI F H, CAI P P, LIU X, et al. Adenovirus-mediated P311 ameliorates renal fibrosis through inhibition of epithelial-mesenchymal transition via TGF-β1-Smad-ILK pathway in unilateral ureteral obstruction rats[J]. Int J Mol Med, 2018, 41(5): 3015-3023. |
| [13] |
邓樑卿, 周龙书, 史文静. 整合素连接激酶在上皮性卵巢癌中的表达及其临床意义[J]. 实用医学杂志, 2013, 29(12): 1953-1955. |
| [14] |
MAITY G, FAHREEN S, BANERJI A, et al. Fibronectin-integrin mediated signaling in human cervical cancer cells (SiHa)[J]. Mol Cell Biochem, 2010, 336(1/2): 65-74. |
| [15] |
李春玲, 刘春在, 李胜水, 等. ILK、ER在子宫内膜癌组织中的表达及相关性分析[J]. 中国当代医药, 2010, 17(9): 39-41. |
| [16] |
石雪萍, 李静, 冉建华, 等. 人参皂苷Rh2调控PI3K/AKT/GSK-3β信号通路诱导人结肠癌细胞凋亡[J]. 中国药理学通报, 2017, 33(1): 114-119. |
| [17] |
DEHGHANY A M, ABOEE M F, MORADI P. SiO2@antisense molecules covered by nepetalactone, extracted from Nepeta gloeocephala, inhibits ILK phosphorylation and downstream PKB/AKT signaling in HeLa cells[J]. Cancer Gene Ther, 2017, 24(1): 28-32. |
| [18] |
杨群, 李丽. 下调高迁移率族蛋白B1对宫颈癌细胞侵袭、迁移的影响及机制[J]. 山东医药, 2018, 58(26): 27-30. |
| [19] |
庄翔, 朱军, 吕梦欣, 等. 特异性ILK siRNA对膀胱癌EJ细胞EMT及移植瘤生长的影响[J]. 基础医学与临床, 2016, 36(2): 191-198. |
| [20] |
SHIRLEY L A, MCCARTY S, YANG M C, et al. Integrin-linked kinase affects signaling pathways and migration in thyroid cancer cells and is a potential therapeutic target[J]. Surgery, 2015, 159(1): 163-170. |
 2020, Vol. 46
2020, Vol. 46


