扩展功能
文章信息
- 李伟, 张海峰, 王淼, 霍静, 张颖, 赵翠
- LI Wei, ZHANG Haifeng, WANG Miao, HUO Jing, ZHANG Ying, ZHAO Cui
- 黄芪注射液对睡眠剥夺大鼠心脏的保护作用及其机制
- Protective effect of Astragalus Injection on heart of rats with sleep deprivation and its mechanism
- 吉林大学学报(医学版), 2020, 46(05): 998-1003
- Journal of Jilin University (Medicine Edition), 2020, 46(05): 998-1003
- 10.13481/j.1671-587x.20200516
-
文章历史
- 收稿日期: 2019-12-02
2. 解放军第三〇九医院心理医学科, 北京 100080
2. Department of Psychological Medicine, No. 309 Hospital of PLA, Beijing 100080, China
睡眠剥夺是指一段时间内完全缺乏或少于最佳睡眠的时间[1]。充足的睡眠是确保机体健康的基础,睡眠剥夺会导致神经功能障碍,免疫功能下降,代谢性疾病、心血管疾病和癌症等发生,严重者甚至可引起死亡[2]。研究[3]显示:睡眠剥夺是心血管疾病风险的独立预测因子,睡眠持续时间与心脏疾病的发生有密切关联,主要表现为氧化应激损伤和心肌细胞炎症反应。心肌内皮细胞损伤促进单核细胞黏附并聚集于细胞内膜,诱导细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)和血管细胞黏附分子1(vascular cell adhesion molecule-1,VCAM-1)等的表达,参与组织炎症反应的发生发展[4]。黄芪是豆科植物黄芪和内蒙黄芪干燥根,具有补气升阳和利水消肿的功效[5]。研究[6]表明:黄芪制剂黄芪注射液有增强机体免疫能力、减少自由基生成和减轻组织炎症反应的活性。目前国内已有研究[7]表明:黄芪注射液具有改善生化代谢作用,可通过减少脑组织氧自由基减轻睡眠剥夺对机体的损害。但近年来尚未发现黄芪注射液对睡眠剥夺大鼠心脏保护作用的相关研究。本研究采用改良多平台水环境法(modified multiple platform water environmental method,MMPWM)建立睡眠剥夺大鼠模型,观察睡眠剥夺对大鼠心肌氧化应激和炎症反应指标的影响,探讨黄芪注射液对大鼠心肌组织的保护作用及其机制。
1 材料与方法 1.1 实验动物、试剂和主要仪器健康雄性SD大鼠40只,购自河北省实验动物中心,动物生产许可证号:SCXK(冀)2018-003。黄芪注射液购自神威药业集团有限公司,国药准字:Z13020999,每毫升含2 g生药量;超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和丙二醛(malondialdehyde,MDA)检测试剂盒购自广州菲博生物科技有限公司;肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)和白细胞介素6(interleukin-6,IL-6)ELISA试剂盒,B淋巴细胞瘤2(B lymphoblastoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 related X protein,Bax)、ICAM-1、VCAM-1和Caspase-3及GAPDH抗体购自英国Abcam公司。BX53型奥林巴斯光学显微镜购于郑州朋来仪器有限公司,DR700半自动生化分析仪购于长春迪瑞医疗科技股份有限公司。
1.2 实验动物分组及动物模型建立40只SD大鼠随机分为对照组、模型组、低和高剂量黄芪注射液组,每组10只。低和高剂量黄芪注射液组大鼠分别腹腔注射0.2和0.8 mL•kg-1黄芪注射液,每天给药1次,对照组和模型组给予生理盐水1 mL•100 g-1,连续给药2周。2周后,采用MMPWM建立大鼠睡眠剥夺模型[8]。模型组和低及高剂量黄芪注射液大鼠组采用小平台造模,其原理为:由于平台(直径6.5 cm,高度8.0 cm)较小,若大鼠进入睡眠,会由于全身肌张力下降而导致垂头触水并惊醒,多次反复使得睡眠剥夺连续72 h。对照组采用大平台,大鼠可自由活动和休息。
1.3 苏木精-伊红(HE)染色观察大鼠心肌组织形态表现取大鼠心脏,清洗,采用10%的甲醛浸泡固定48 h,逐级乙醇脱水,二甲苯透明,石蜡包埋,进行组织切片,切片厚度4 μm,清洗,采用苏木精染色,清洗,采用1% HCl的无水乙醇固定,用伊红染色,置于光学显微镜下观察,包括大鼠心肌组织结构、细胞排列状态、有无炎细胞浸润及有无心肌间质水肿。
1.4 TUNEL法检测大鼠心肌细胞凋亡指数(apoptotic index,AI)取大鼠心脏组织切片,乙醇梯度脱水,二甲苯透明处理,石蜡包埋,脱蜡至水,PBS缓冲液清洗,蛋白激酶K工作液处理15 min,PBS缓冲液清洗;加入山羊非免疫血清封闭30 min,去血清,加兔来源cTnI一抗(1︰100),于4℃过夜;室温复温后,PBS缓冲液冲洗3次,加入山羊抗兔FITC二抗,置于湿盒中37℃避光孵育1 h,PBS缓冲液冲洗3次。加入新配制的TUNEL反应液,于37℃避光孵育1 h。阳性对照加入100 μL DNase 1室温处理15 min,滴加荧光标记dUTP液,PBS缓冲液清洗。采用100 μg•L-1 DAPI复染10 min,PBS缓冲液冲洗3次,封片液封片,共聚焦显微镜观察,阳性细胞胞核呈棕褐色。每张切片随机选取5个视野,于400倍显微镜下计数凋亡细胞,计算AI,AI=阳性细胞数/ 4’,6-二脒基-2-苯基吲哚(DAPI)数×100%。
1.5 生化分析仪检测各组大鼠血清中LDH、CK、α-HBDH和ALT活性各组大鼠在末次给药后从眼眶后静脉丛各取血5 mL,静置1 h后,离心并分离血清,采用DR700半自动生化分析仪检测LDH、CK、α-HBDH和ALT活性。
1.6 ELISA法检测各组大鼠心肌组织中SOD和GSH-Px活性及MDA水平大鼠在末次给药后用2%戊巴比妥钠(0.3 mL•100 g-1)经腹腔注射麻醉,取各组大鼠心肌组织称质量,按V︰W=9︰1的比例加入生理盐水,剪碎组织,冰上稀释匀浆,离心并分离上清,按照试剂盒说明书检测SOD和GSH-Px活性及MDA水平。
1.7 ELISA法检测各组大鼠心肌组织中IL-1β、IL-6和TNF-α水平剪碎大鼠心脏组织,冰上稀释匀浆,离心并分离上清,按照ELISA试剂盒说明书检测大鼠心肌组织中IL-1β、IL-6和TNF-α水平。
1.8 Western blotting法检测各组大鼠心肌组织中Bcl-2、Bax、ICAM-1、VCAM-1和Caspase-3蛋白表达水平收集各组大鼠待测心肌细胞,用RIPA裂解细胞并提取总蛋白,SDS-PAGE凝胶电泳分离各组蛋白并转至PVDF膜。用5%BSA封闭2 h后更换为相应的Bcl-2、Bax、ICAM-1、VCAM-1和Caspase-3一抗,4℃孵育过夜。第2天加入二抗室温孵育1 h,最后加入显色液于凝胶成像仪曝影。以GAPDH为内参,对蛋白条带进行半定量分析。目的蛋白相对表达水平=目的蛋白条带灰度值/GAPDH条带灰度值。
1.9 统计学分析采用SPSS 19.0统计软件进行统计学分析。各组大鼠心肌细胞AI,血清中LDH、CK、α-HBDH和ALT活性,心肌组织中SOD和GSH-Px活性及MDA、IL-1β、IL-6和TNF-α水平,心肌组织中ICAM-1、VCAM-1、Bcl-2、Bax和Caspase-3蛋白表达水平,均符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠心肌组织形态表现假手术组大鼠心肌组织结构正常,心肌细胞排列整齐,无炎性细胞浸润;模型组大鼠心肌间质水肿,出现大量炎性细胞浸润;与模型组比较,低剂量黄芪注射液组大鼠炎性细胞浸润明显减轻,间质水肿程度减轻;高剂量黄芪注射液组大鼠心肌细胞胞核大小均匀,无明显水肿,少量炎性细胞浸润。见图 1(插页四)。
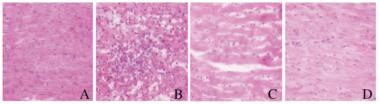
|
| A: Sham operation group; B: Model group; C: Low dose of Astragalus Injection group; D: High dose of Astragalus Injection group. 图 1 各组大鼠心肌组织形态表现(HE, ×400) Fig. 1 Morphology of myocardium tissue of rats in var1ous groups( HE, ×400) |
|
|
与假手术组比较,模型组大鼠心肌细胞AI明显升高(P < 0.05);与模型组比较,低和高剂量黄芪注射液组大鼠心肌细胞AI明显降低(P < 0.05);高剂量黄芪注射液组大鼠心肌细胞AI明显低于低剂量黄芪注射液组(P < 0.05)。见表 1和图 2(插页四)。
| (n=10, x±s, η/%) | |||||||||||||||||||||||||||||
| Group | AI | ||||||||||||||||||||||||||||
| Sham operation | 6.08±0.62 | ||||||||||||||||||||||||||||
| Model | 44.20±5.17* | ||||||||||||||||||||||||||||
| Astragalus Injection | |||||||||||||||||||||||||||||
| Low dose | 23.41±4.26△ | ||||||||||||||||||||||||||||
| Hihg dose | 12.29±3.10△# | ||||||||||||||||||||||||||||
| *P < 0.05 compared with sham operation group; △P < 0.05 compared with model group; #P < 0.05 compared with low dose of Astragalus Injection group. | |||||||||||||||||||||||||||||
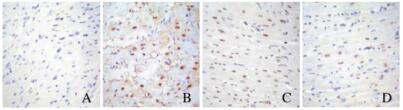
|
| A: Sham operation group; B: Model group; C: Low dose of Astragalus Injection group; D: High dose of Astragalus Injection group. 图 2 各组大鼠心肌细胞凋亡情况(TUNEL, ×400) Fig. 2 Apoptosis of myocardiocytes of rats in various groups( TUNEL, ×400) |
|
|
与对照组比较,模型组大鼠血清中LDH、CK、α-HBDH和ALT活性明显升高(P < 0.05);与模型组比较,低和高剂量黄芪注射液组大鼠血清中LDH、CK、α-HBDH和ALT水平均明显降低(P < 0.05);高剂量黄芪注射液组大鼠血清中LDH、CK、α-HBDH和ALT活性均明显低于低剂量黄芪注射液组(P < 0.05)。见表 2。
| Group | LDH[λB/(U•L-1)] | CK[λB/(U•L-1)] | α-HBDH[λB/(U•L-1)] | ALT[λB/(U•L-1)] | SOD[λB/(U•mg-1)] |
| Sham operation | 697.2±91.1 | 497.2±21.9 | 94.3±27.4 | 54.0±10.5 | 77.2±12.2 |
| Model | 3 283.4±227.3* | 4 183.4±317.3* | 1 023.1±133.5* | 323.0±33.7* | 23.2±7.4* |
| Astragalus Injection | |||||
| Low dose | 1 975.3±124.5△ | 3 275.5±221.4△ | 735.6±125.7△ | 235.0±25.3△ | 45.7±11.6△ |
| High dose | 1 179.8±119.2△# | 2 179.8±129.7△# | 333.5±102.2△# | 143.0±22.1△# | 69.6±13.1△# |
| F | 45.368 | 39.125 | 47.036 | 26.179 | 51.462 |
| P | < 0.05 | < 0.05 | < 0.05 | < 0.05 | < 0.05 |
| Group | GSH-Px[λB/(U•mg-1)] | MDA[mB/(μmol•g -1)] | IL-1β[ρB/(ng•L-1)] | IL-6[ρB/(ng•L-1)] | TNF-α[ρB/(ng•L-1)] |
| Sham operation | 297.2±21.3 | 4.33±0.74 | 57.1±8.2 | 47.6±6.1 | 63.5±7.8 |
| Model | 123.4±17.5* | 8.15±0.49* | 121.4±11.5* | 163.9±11.5* | 181.5±10.9* |
| Astragalus Injection | |||||
| Low dose | 175.5±16.5△ | 6.65±0.77△ | 85.5±10.6△ | 85.8±15.4△ | 123.5±11.7△ |
| High dose | 239.8±21.2△# | 5.23±0.32△# | 63.8±12.4△# | 59.1±8.6△# | 87.3±11.4△# |
| F | 41.561 | 36.724 | 45.947 | 57.402 | 43.864 |
| P | < 0.05 | < 0.05 | < .05 | < 0.05 | < 0.05 |
| *P < 0.05 compared with sham operation group; △P < 0.05 compared with model group; #P < 0.05 compared with low dose of Astragalus Injection group. | |||||
与对照组比较,模型组大鼠心肌组织中SOD和GSH-Px活性明显降低(P < 0.05),MDA水平明显升高(P < 0.05);与模型组比较,低和高剂量黄芪注射液组大鼠心肌组织中SOD和GSH-Px活性明显升高(P < 0.05),MDA水平明显降低(P < 0.05);与低剂量黄芪注射液组比较,高剂量黄芪注射液组大鼠心肌组织中SOD和GSH-Px活性明显升高(P < 0.05),MDA水平明显降低(P < 0.05)。见表 2。
2.5 各组大鼠心肌组织中IL-1β、IL-6和TNF-α水平与对照组比较,模型组大鼠心肌组织中IL-1β、IL-6和TNF-α水平明显升高(P < 0.05);与模型组比较,低和高剂量黄芪注射液组大鼠心肌组织中IL-1β、IL-6和TNF-α水平明显降低(P < 0.05);高剂量黄芪注射液组大鼠心肌组织中IL-1β、IL-6和TNF-α水平明显低于低剂量黄芪注射液组(P < 0.05)。见表 2。
2.6 各组大鼠心肌组织中ICAM-1、VCAM-1、Bcl-2、Bax和Caspase-3蛋白表达水平与对照组比较,模型组大鼠心肌组织中Bax、ICAM-1、VCAM-1和Caspase-3蛋白表达水平明显升高(P < 0.05),Bcl-2蛋白表达水平明显降低(P < 0.05);与模型组比较,低和高剂量黄芪注射液组大鼠心肌组织中Bax、ICAM-1、VCAM-1和Caspase-3蛋白表达水平明显降低(P < 0.05),Bcl-2蛋白表达水平明显升高(P < 0.05);与低剂量黄芪注射液组比较,高剂量黄芪注射液组大鼠心肌组织中Bax、ICAM-1、VCAM-1和Caspase-3蛋白表达水平明显降低(P < 0.05),Bcl-2蛋白表达水平明显升高(P < 0.05)。见图 3和表 3。
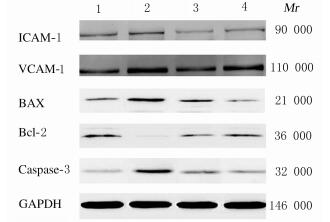
|
| Lane 1:Sham operation group; Lane 2: Model group; Lane 3: Low dose of Astragalus injection group; Lane 4:High dose of Astragalus injection group. 图 3 各组大鼠心肌组织中细胞凋亡相关蛋白表达电泳图 Fig. 3 Electrophoregram of apoptosis-related proteins in myocardium tissue of rats in various groups |
|
|
| Group | ICAM-1/GAPDH | VCAM-1/GAPDH | Bax/GAPDH | Bcl-2/GAPDH | Caspase-3/GAPDH |
| Sham operation | 0.267±0.032 | 0.722±0.045 | 0.184±0.032 | 0.472±0.037 | 0.127±0.021 |
| Model | 0.526±0.035* | 0.978±0.065* | 0.342±0.029* | 0.096±0.012* | 0.514±0.041* |
| Astragalus Injection | |||||
| Low dose | 0.311±0.030△ | 0.803±0.051△ | 0.190±0.025△ | 0.364±0.032△ | 0.325±0.036△ |
| High dose | 0.289±0.031△# | 0.765±0.055△# | 0.168±0.024△# | 0.420±0.038△# | 0.486±0.033△# |
| *P < 0.05 compared with sham operation group; △P < 0.05 compared with model group; #P < 0.05 compared with low dose of Astragalus Injection group. | |||||
睡眠剥夺类似于缺氧和低温等刺激,可对心血管系统产生一系列的负向调控,如氧化应激和炎症反应[1, 9]、交感神经激活[1, 10]、血管内皮功能紊乱[11]和内分泌代谢紊乱[12]等,尤其是氧化应激及炎症反应是睡眠剥夺影响心血管系统的重要因素。研究[1-2]显示:睡眠剥夺不仅对中枢神经系统造成显著影响,同时也与心血管疾病关系密切。流行病学研究[3]显示:心血管疾病的发病率与睡眠持续时间有密切关联,睡眠剥夺更被认为是心血管疾病风险的独立预测因子。黄芪在降血糖和血脂、抗肿瘤、抑菌、抗炎、抗病毒、保护心血管系统、延缓衰老和提高机体免疫力等方面起到重要作用。但黄芪注射液对睡眠剥夺诱导心肌损伤的作用少有报道。本研究采用MMPWM建立睡眠剥夺大鼠模型,探讨黄芪注射液对睡眠剥夺诱导心肌损伤的保护机制。心肌酶主要包括LDH、CK、α-HBDH和ALT,心肌组织损伤或坏死后心肌酶会不同程度地释放到血液中,其活性可反映心肌细胞的受损程度[13-14]。本研究中,与模型组比较,低和高剂量黄芪注射液组大鼠血清中LDH、CK、α-HBDH和ALT活性均明显降低,且高剂量黄芪注射液组大鼠血清中上述心肌酶活性下降更明显,表明黄芪注射液可减少心肌酶的释放,减轻心肌细胞的损伤,且其作用效果与剂量有关。ICAM-1和VCAM-1为炎症主要黏附分子,主要在内皮细胞和心肌细胞等细胞中表达。生理状态下,ICAM-1和VCAM-1呈低水平表达,但受到各种炎症因素刺激后其蛋白表达水平可上调[15],导致组织器官结构和功能的损伤。本研究中,睡眠剥夺模型大鼠心肌组织中ICAM-1和VCAM-1表达水平升高,诱导白细胞集聚和黏附,引起多种炎症因子释放,IL-1β、IL-6和TNF-α水平升高进一步诱发微循环障碍,产生持续心肌损害。TNF-α可通过细胞信号通路进一步引起氧化应激,IL-1β及IL-6是促炎症反应的细胞因子,可由TNF-α诱导产生,从而引起炎症级联反应[16-17]。本研究中,低和高剂量黄芪注射液组大鼠心肌组织中炎症因子IL-1β、IL-6和TNF-α的释放明显减少;另一方面,ICAM-1和VCAM-1的释放亦会诱发自由基释放增加,加剧心肌损伤;SOD和GSH-Px是机体中具有重要抗氧化作用的酶,其水平直接反映机体清除活性氧簇的能力[18-20];MDA是脂质过氧化的重要产物,其水平高低与机体内自由基水平有关联,主要反映机体受自由基损伤的程度[21-22];本研究中,低和高剂量黄芪注射液组大鼠心肌组织中SOD及GSH-Px活性均不同程度升高、MDA水平则明显下降,表明黄芪注射液具有较好的抗氧化能力。黄芪还能上调大鼠心肌组织中抗凋亡蛋白Bcl-2的表达,并下调促凋亡蛋白Bax和Caspase-3表达,表明黄芪注射液可减少心肌细胞凋亡,从而起到保护睡眠剥夺大鼠心肌组织的作用,且高剂量黄芪注射液组大鼠心肌细胞损伤的改善情况优于低剂量黄芪注射液组。
综上所述,黄芪注射液可保护睡眠剥夺导致的大鼠心肌组织损伤,其作用机制可能与减轻氧化应激、下调黏附分子和凋亡蛋白表达、减少心肌细胞凋亡和炎症因子释放有关,且在一定范围内呈剂量-效应依赖性。
| [1] |
SHOKRI-KOJORI E, WANG G J, WIERS C E, et al. β-Amyloid accumulation in the human brain after one night of sleep deprivation[J]. Proc Natl Acad Sci U S A, 2018, 115(17): 4483-4488. DOI:10.1073/pnas.1721694115 |
| [2] |
CHENG T O. Effect of sleep deprivation on cardiovascular health[J]. Int J Cardiol, 2009, 134(3): 293-294. DOI:10.1016/j.ijcard.2008.11.046 |
| [3] |
CAPPUCCIO F P, COOPER D, D'ELIA L STRAZZULLO P, et al. Sleep duration predicts cardiovascular outcomes:a systematic review and Meta-analysis of prospective studies[J]. Eur Heart J, 2011, 32(12): 1484-1492. DOI:10.1093/eurheartj/ehr007 |
| [4] |
李文蕾, 孙丽丽, 霍洪亮. 内脂素对心肌细胞ICAM-1和VCAM-1及相关因子的影响[J]. 东北师大学报(自然科学版), 2013, 45(1): 113-116. |
| [5] |
聂娟, 谢丽华, 马港圆, 等. 中药黄芪的化学成分及药理作用研究进展[J]. 湖南中医杂志, 2018, 34(7): 228-231. |
| [6] |
梁瑞国. 黄芪注射液联合丹参注射液治疗慢性阻塞性肺疾病的临床效果及对氧化应激水平的影响分析[J]. 当代医学, 2019, 25(17): 40-43. |
| [7] |
吴兴曲, 杨来启, 李拴德, 等. 黄芪注射液对大鼠睡眠剥夺后脑组织NO含量和SOD活性的影响[J]. 解放军药学学报, 2002, 18(5): 274-276. |
| [8] |
PHILIPS T, BENTO-ABREU A, NONNEMAN A, et al. Oligodendrocyte dysfunction in the pathogenesis of amyotrophic lateral sclerosis[J]. Brain, 2013, 136(Pt 2): 471-482. |
| [9] |
VAN LEEUWEN W M, LEHTO M, KARISOLA P, et al. Sleep restriction increases the risk of developing cardiovascular diseases by augmenting proinflammatory responses through IL-17 and CRP[J]. PLoS One, 2009, 4(2): e4589. DOI:10.1371/journal.pone.0004589 |
| [10] |
ALMEIDA F R, PERRY J C, FUTURO NETO H A, et al. Cardiovascular function alterations induced by acute paradoxical sleep deprivation in rats[J]. Clin Exp Hypertens, 2014, 36(8): 567-571. DOI:10.3109/10641963.2014.881843 |
| [11] |
PALMA B D, GABRIEL A, BIGNOTTO M, et al. Paradoxical sleep deprivation increases plasma endothelin levels[J]. Braz J Med Biol Res, 2002, 35(1): 75-79. DOI:10.1590/S0100-879X2002000100011 |
| [12] |
SUN X Y, DAI X Y, YANG T S, et al. Effects of mental resilience on neuroendocrine hormones level changes induced by sleep deprivation in servicemen[J]. Endocrine, 2014, 47(3): 884-888. DOI:10.1007/s12020-014-0228-8 |
| [13] |
郑小燕, 冉建华, 刘刚, 等. 睡眠剥夺小鼠肝脏中肿瘤坏死因子α表达上调[J]. 中国组织化学与细胞化学杂志, 2017, 26(4): 354-359. |
| [14] |
TENG X, EMMETT M J, LAZAR M A, et al. Lactate dehydrogenase C produces S-2-hydroxyglutarate in mouse testis[J]. ACS Chem Biol, 2016, 11(9): 2420-2427. DOI:10.1021/acschembio.6b00290 |
| [15] |
BROOKS W W, CONRAD C H. Isoproterenol-induced myocardial injury and diastolic dysfunction in mice:structural and functional correlates[J]. Comp Med, 2009, 59(4): 339-343. |
| [16] |
ZHAO S J, GUO S N, ZHU Q L, et al. Heat-induced oxidative stress and inflammation involve in cadmium pollution history in the spleen of zebrafish[J]. Fish Shellfish Immunol, 2018, 72: 1-8. DOI:10.1016/j.fsi.2017.09.077 |
| [17] |
程江霞, 彭晓红, 秦汉, 等. 缺血后处理对大鼠心肌缺血再灌注时血清TNF-α、L-1β和IL-6浓度的影响[J]. 武汉大学学报(医学版), 2008, 29(5): 576-578. |
| [18] |
刘永强, 刘辉, 韩培立, 等. 银杏内酯通过抗炎和抗氧化保护缺血再灌注导致的大鼠心肌损伤[J]. 中国药理学与毒理学杂志, 2019, 33(4): 241-249. |
| [19] |
吴华英, 夏帅帅, 黄惠勇, 等. 加味生脉补心丹对2型糖尿病大鼠心肌损伤的保护作用[J]. 湖南中医药大学学报, 2019, 39(4): 453-458. |
| [20] |
吴东垣, 刘炜, 李双斌, 等. 黄芪多糖对5-氟尿嘧啶诱导心肌损伤的干预作用研究[J]. 中国实验诊断学, 2018, 22(11): 1995-1998. |
| [21] |
HEGAB Z, MOHAMED T M A, STAFFORD N, et al. Advanced glycation end products reduce the calcium transient in cardiomyocytes by increasing production of reactive oxygen species and nitric oxide[J]. FEBS Open Biol, 2017, 7(11): 1672-1685. DOI:10.1002/2211-5463.12284 |
| [22] |
贺瑞, 甘杨子, 黄凌. 有氧运动预干预对睡眠剥夺大鼠氧化应激水平的影响[J]. 生物化工, 2019, 5(3): 39-41. |
 2020, Vol. 46
2020, Vol. 46


