扩展功能
文章信息
- 隋欣, 徐岩, 周佳, 王伟楠, 张明天, 韩冬, 李娜, 杨擎, 曲晓波, 黄晓巍
- SUI Xin, XU Yan, ZHOU Jia, WANG Weinan, ZHANG Mingtian, HAN Dong, LI Na, YANG Qing, QU Xiaobo, HUANG Xiaowei
- 鹿茸Ⅰ型胶原对骨髓间充质干细胞增殖的影响及其与Ⅱ型胶原和聚集蛋白聚糖表达的关系
- Effects of velvet antler collagen typeⅠ on proliferation of bone marrow mesenchymal stem cells and its relationships with type Ⅱ collagen and aggrecan expressions
- 吉林大学学报(医学版), 2020, 46(05): 992-997
- Journal of Jilin University (Medicine Edition), 2020, 46(05): 992-997
- 10.13481/j.1671-587x.20200515
-
文章历史
- 收稿日期: 2020-01-05
2. 长春中医药大学药学院临床药学与中药药理教研室, 吉林 长春 130117;
3. 长春中医药大学药学院药物化学与中药化学教研室, 吉林 长春 130117;
4. 长春中医药大学吉林省人参科学研究院药理组, 吉林 长春 130117
2. Department of Clinical Pharmacy and Pharmacology of Chinese Medicine, School of Pharmacy, Changchun University of Chinese Medicine, Changchun 130117, China;
3. Department of Medicinal Chemistry and Chinese Medicine Chemistry, School of Pharmacy, Changchun University of Chinese Medicine, Changchun 130117, China;
4. Department of Pharmacology, Jilin Ginseng Academy, Changchun University of Chinese Medicine, Changchun 130117, China
随着现代社会人口老龄化问题的日益加剧,软骨损伤因具有难以修复、病程长且易反复等特点,现已成为影响老年人生活质量的主要因素之一[1-2]。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是一类具有多向分化潜能的多能干细胞,可在特定条件下分化为成骨细胞、软骨细胞和脂肪细胞等,转化生长因子和黄酮类化合物等诱导剂可以促进这一过程的发生,甚至产生靶向作用[3-5]。梅花鹿鹿茸是吉林省道地优势药材,具有“强筋骨”之功效,近千年来一直被广泛应用于各类骨病治疗[6]。鹿茸中含有大量的胶原蛋白,其中Ⅰ型胶原蛋白约占90%,已被证实作为医用生物材料对缺损组织修复、再生和重建具有重要意义[7]。但鹿茸Ⅰ型胶原(velvet antler collagen type Ⅰ,VACTⅠ)是否具有诱导BMSCs成软骨分化的作用目前尚无报道。本研究通过体外细胞实验,观察VACTⅠ对BMSCs增殖、细胞周期以及成软骨相关因子骨形态生成蛋白4(BMP-4)、转录因子Sox9、Ⅱ型胶原(type Ⅱ collagen)和聚集蛋白聚糖(aggrecan)的影响,探讨其诱导BMSCs成软骨化的潜在可能及其机制。
1 材料与方法 1.1 实验动物、主要试剂和仪器4周龄SD大鼠,雄性,清洁级,由长春亿斯实验动物技术有限责任公司提供,动物生产许可证号:SCXK(吉)2016-0003。VACTⅠ由长春中医药大学提供;兔抗大鼠Ⅱ型胶原(货号:15943-1-AP)、兔抗大鼠聚集蛋白聚糖(货号:13880-1-AP)和山羊抗兔二抗HRP(货号:SA00001-2)购于武汉三鹰生物技术有限公司,SDS-PAGE凝胶制备试剂盒(货号:P1200)、全蛋白提取试剂盒(货号:BC3711)、BCA蛋白浓度测定试剂盒(货号:PC0020)、ECL化学发光法检测试剂盒(货号:SW2010)和彩虹245广谱蛋白Marker(货号:PR1920)购于北京索莱宝科技有限公司,增强型CCK-8试剂盒(货号:BA00208)购于北京博奥森生物技术有限公司。Multiskan FC型酶标仪(美国Thermo公司),Alliance Q9型凝胶成像仪(英国UVItec公司),Gallios型流式细胞仪(美国Beckman Coulter公司),Nanodrop 2000型微量分光光度计(美国Thermo公司),CFX Connect型荧光定量PCR仪和CFX Manager型采集及分析软件(美国Bio-Rad公司)。
1.2 大鼠BMSCs的原代及传代培养大鼠脱颈椎处死后75%酒精浸泡10 min,超净工作台中切取双侧股骨,75%酒精浸泡2 min,移入新的超净工作台中,剪去两端干骺端用PBS缓冲液反复冲洗出骨髓细胞至离心管中,800 r•min-1离心5 min,收集BMSCs,接种于含10%FBS和100 U • mL-1双抗的DMEM培养基中,在37℃、5% CO2和饱和湿度条件下培养,差时贴壁法纯化细胞,待细胞生长至80%~90%时,使用含EDTA的0.25%胰酶消化传代,取第3~5代细胞用于实验。
1.3 CCK-8法检测BMSCs增殖率取第3代BMSCs,用胰蛋白酶消化后以每孔3 × 104个细胞的密度接种于96孔细胞培养板中,每孔1 mL,孵育24 h后分别加入条件培养液。实验分为空白对照组、转化生长因子β3(TGF-β3)组(给予浓度为10 μg•L-1 TGF-β3)和不同浓度VACTⅠ(给药浓度分别为1.25、2.50、5.00、10.00和20.00 g • L-1)组。连续培养24、48和72 h后,弃去培养液,每孔加入CCK-8 10 µL和DMEM 190 µL,孵育4 h,酶标仪检测450 nm处吸光度(A)值。细胞增殖率=实验组A值/空白对照组A值。
1.4 ELISA法检测细胞上清液中BMP-4和Sox9水平按照武汉酶免生物科技有限公司ELISA试剂盒说明书检测各组细胞上清液中BMP-4和Sox9水平,于450 nm波长处依次读取各孔的A值。以标准品浓度为横坐标,A值为纵坐标制作标准曲线,求出回归方程,计算各样品水平。
1.5 流式细胞术检测各组不同细胞周期细胞百分率制备浓度为1 × 106 mL-1的细胞悬液1 mL,离心后去上清,在细胞中加入70%预冷乙醇500 μL固定2 h,4℃保存,染色前用PBS缓冲液洗去固定液。加入100 μL RNase A溶液,重悬细胞,37℃水浴30 min,再加入400 μL PI染色液混匀,4℃避光孵育30 min,流式细胞术检测各组不同细胞周期细胞百分率。
1.6 RT-PCR法检测各组细胞中Ⅱ型胶原和聚集蛋白聚糖mRNA表达水平按美国Axygen公司提供的AxyPrep总RNA小量制备试剂盒提取各组细胞总RNA,NanoDrop 2000超微量分光光度计测定总RNA浓度。按照日本TaKaRa公司提供的逆转录试剂盒操作规程逆转录合成cDNA第一链,‒20℃储存备用。以cDNA链作为模板,进行PCR扩增反应,反应体系:5×iScript Reaction Mixture 4 μL,iScript Reverse Transcriptase 1 μL,RNA template 1 μg,加Nuclease-free water至20 μL;反应条件:37℃孵育60 min,85℃孵育5 min,冰浴5 min,合成的cDNA于‒20℃储存备用。以cDNA链作为模板,进行PCR扩增反应,20 μL反应体系:iTaqTM universal SYBR Green supermix(2×)10 μL,Forward and reverse primers 1.8 μL,DNA template 1 μL,加H2O至20 μL。反应条件:95℃预变性5 min;95℃变性10 s,60℃退火30 s,72℃延伸1 min,40循环扩增反应后,72℃、5 min。将96孔细胞培养板放入荧光定量PCR仪中,并在Bio-Rad CFX Manager软件上设定检测。PCR引物序列见表 1。
| Primer | Sequence(5'-3') |
| Aggrecan | F:GAACCTACGGCATCCGGGACA |
| R:CCTCACCGCCCACTCCAAAGA | |
| Type Ⅱ collagen | F:ACGCCACGCTCAAGTCCCTCAA |
| R:TGTGTTTCGTGCAGCCATCCTG | |
| β-actin | F:CTGTGTGGATTGGTGGCTCT |
| R:CAGCTCAGTAACAGTCCGCC |
提取各组细胞总蛋白,采用BCA蛋白浓度测定试剂盒检测样品蛋白浓度,调节浓度为2 g•L-1,将蛋白样品与2×样品缓冲液按体积比1:4混合后,100℃水浴5 min;制备SDS-PAGE凝胶,每孔加样20 μL,280 mA恒定电流转膜60 min。转膜结束后,取出PVDF膜,采用TBST洗涤3次,每次5 min,之后将膜放入5%脱脂奶粉中,水平摇床,室温下封闭2 h。封闭结束后,TBST浸洗3次,每次5 min,分别加入Ⅱ型胶原和聚集蛋白聚糖一抗(1:1 000)稀释液,4℃储存,过夜。加HRP标记二抗(1:2 000),水平摇床,室温封闭2 h。加入ECL发光显色液后将膜正面朝上放到凝胶成像仪内,记录结果。对电泳条带进行灰度值扫描,对各目的蛋白进行半定量分析。以目的蛋白条带灰度值与内参条带灰度值比值表示目的蛋白表达水平。
1.8 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组BMSCs增殖率,细胞中BMP-4和Sox9水平,不同细胞周期细胞百分率,细胞中Ⅱ型胶原和聚集蛋白聚糖mRNA及蛋白表达水平以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。检验水准为α=0.05。
2 结果 2.1 各组BMSCs增殖率与空白对照组比较,1.25 g • L-1 VACTⅠ组大鼠BMSCs增殖率差异无统计学意义(P>0.05),2.50~20.00 g•L-1 VACTⅠ组大鼠BMSCs增殖率明显降低(P < 0.05或P < 0.01),并呈时间剂量依赖性;与TGF-β3组比较,2.50 g•L-1 VACTⅠ组大鼠BMSCs增殖率差异无统计学意义(P >0.05),故选用2.5和5.0 g • L-1 VACTⅠ组进行后续实验。见表 2。
| (n=5, x±s) | |||||||||||||||||||||||||||||
| Group | Proliferation rate | ||||||||||||||||||||||||||||
| (t/h) | 24 | 48 | 72 | ||||||||||||||||||||||||||
| Blank control | 1.152±0.036 | 1.276±0.045 | 1.380±0.051 | ||||||||||||||||||||||||||
| TGF-β3 | 0.995±0.027** | 1.087±0.058** | 1.195±0.059** | ||||||||||||||||||||||||||
| VACTⅠ(g•L-1) | |||||||||||||||||||||||||||||
| 1.25 | 1.178±0.040 | 1.275±0.061 | 1.362±0.075 | ||||||||||||||||||||||||||
| 2.50 | 1.038±0.034** | 1.115±0.056* | 1.193±0.068* | ||||||||||||||||||||||||||
| 5.00 | 0.917±0.031** | 1.026±0.051** | 1.104±0.062** | ||||||||||||||||||||||||||
| 10.00 | 0.795±0.040** | 0.872±0.048** | 0.955±0.059** | ||||||||||||||||||||||||||
| 20.00 | 0.624±0.028** | 0.733±0.039** | 0.829±0.043** | ||||||||||||||||||||||||||
| *P < 0.05, **P < 0.01 compared with blank control group. | |||||||||||||||||||||||||||||
与空白对照组比较,TGF-β3组和不同浓度VACTⅠ组细胞上清液中BMP-4和Sox9水平明显升高(P < 0.05或P < 0.01)。见表 3。
| [n=5, x±s, ρB/(ng•L-1)] | |||||||||||||||||||||||||||||
| Group | BMP-4 | Sox9 | |||||||||||||||||||||||||||
| Blank control | 225.82±30.45 | 98.48±10.85 | |||||||||||||||||||||||||||
| TGF-β3 | 298.42±32.18* | 150.28±12.48** | |||||||||||||||||||||||||||
| VACTⅠ(g•L-1) | |||||||||||||||||||||||||||||
| 2.5 | 295.58±29.80* | 153.18±14.29** | |||||||||||||||||||||||||||
| 5.0 | 310.68±42.25* | 189.05±19.62** | |||||||||||||||||||||||||||
| *P < 0.05, **P < 0.01 compared with blank control group. | |||||||||||||||||||||||||||||
与空白对照组比较,TGF-β3组和不同浓度VACTⅠ组不同细胞周期BMSCs百分率比较差异无统计学意义(P>0.05)。见表 4和图 1(插页四)。
| (n=5, x±s, η/%) | |||||||||||||||||||||||||||||
| Group | Percentage of BMSCs | ||||||||||||||||||||||||||||
| G0/G1 | S | G2/M | |||||||||||||||||||||||||||
| Blank control | 46.59±5.29 | 38.20±2.59 | 15.21±2.08 | ||||||||||||||||||||||||||
| TGF-β3 | 46.04±4.26 | 37.41±3.09 | 16.55±1.98 | ||||||||||||||||||||||||||
| VACTⅠ(g•L-1) | |||||||||||||||||||||||||||||
| 2.5 | 45.25±3.95 | 39.01±3.85 | 15.74±1.65 | ||||||||||||||||||||||||||
| 5.0 | 47.72±4.08 | 39.23±2.96 | 13.05±3.15 | ||||||||||||||||||||||||||

|
| A: Blank group; B: TGF-β3 group;C:2.50 g·L1 VACT group; D:5.00 g.L1 VACT group. 图 1 流式细胞术检测各组不同细胞周期BMSCs百分率 Fig. 1 Percentages of BMSCs in different cell cycles in various groups detected by flow cytometry |
|
|
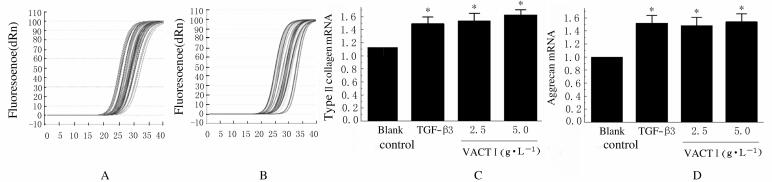
与空白对照组比较,TGF-β3组和不同浓度VACTⅠ组细胞中Ⅱ型胶原和聚集蛋白聚糖mRNA表达水平明显升高(P < 0.05)。见图 2和表 5。
|
| A:Amplification curve of type Ⅱ collagen; B:Amplification curve of aggrecan; C:Relative mRNA expression of type Ⅱ collagen; D:Relative mRNA expression of aggrecan.*P < 0.05 compared with blank control group. 图 2 RT-PCR法检测各组细胞中Ⅱ型胶原和聚集蛋白聚糖mRNA表达水平 Fig. 2 Expression levels of type Ⅱ collagen and aggrecan mRNA in cells in various groups detected by RT-PCR method |
|
|
| (n=5, x±s) | |||||||||||||||||||||||||||||
| Group | Type Ⅱ collagen /β-actin | Aggrecan /β-actin | |||||||||||||||||||||||||||
| Blank control | 1.00 | 1.00 | |||||||||||||||||||||||||||
| TGF-β3 | 1.31±0.11* | 1.52±0.12* | |||||||||||||||||||||||||||
| VACTⅠ(g•L-1) | |||||||||||||||||||||||||||||
| 2.5 | 1.38±0.12* | 1.48±0.13* | |||||||||||||||||||||||||||
| 5.0 | 1.46±0.10* | 1.54±0.12* | |||||||||||||||||||||||||||
| *P < 0.01 compared with blank control group. | |||||||||||||||||||||||||||||
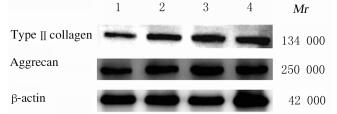
与空白对照组比较,TGF-β3组和不同浓度VACTⅠ组细胞中Ⅱ型胶原和聚集蛋白聚糖蛋白表达水平明显升高(P < 0.05或P < 0.01)。见表 6和图 3。
| (n=5, x±s) | |||||||||||||||||||||||||||||
| Group | Type Ⅱ collagen /β-actin | Aggrecan /β-actin | |||||||||||||||||||||||||||
| Blank control | 0.322±0.042 | 0.581±0.053 | |||||||||||||||||||||||||||
| TGF-β3 | 0.520±0.051** | 0.789±0.081* | |||||||||||||||||||||||||||
| VACTⅠ(g•L-1) | |||||||||||||||||||||||||||||
| 2.5 | 0.583±0.060** | 0.872±0.102* | |||||||||||||||||||||||||||
| 5.0 | 0.601±0.052** | 0.820±0.092* | |||||||||||||||||||||||||||
| *P < 0.05,**P < 0.01 compared with blank control group. | |||||||||||||||||||||||||||||
|
| Blank control group; Lane 2: TGF-β3 group; Lane 3, 4: 2.5 and 5.0 g•L-1 VACT Ⅰ groups. 图 3 Western blotting法检测各组细胞中Ⅱ型胶原和聚集蛋白聚糖蛋白表达电泳图 Fig. 3 Electrophoregram of expressions of type Ⅱ collagen and aggrecan proteins in cells in various groups detected by Western blotting method |
|
|
骨折是骨质疏松最严重的并发症,严重影响老年人生活质量,其愈合过程及机制不同于一般骨折,在手术治疗的同时应给予必要的抗骨质疏松治疗及促软骨生成[8-9]。BMSCs具有来源广、多向分化潜能且应用技术成熟等特点,是软骨组织工程修复最理想的工具。通过诱导剂靶向诱导BMSCs成软骨分化是现代研究的热点,目前常用的诱导剂包括骨形态发生蛋白2(BMP-2)、地塞米松和TGF-β3等;此外巴戟天多糖、柚皮苷和淫羊藿苷等中药提取物也具有诱导剂的潜质[10-13]。鹿茸作为中药传统名贵药材,具有壮肾阳、益精血、强筋骨、调冲任和托疮毒之功效,一直以来作为宫廷药膳食材应用历史悠久[14]。研究[15]表明:胶原是哺乳动物体内含量最多的一类蛋白质,具有很高的生物学活性,鹿茸中含有丰富的Ⅰ型胶原,已被证实对多种骨病具有治疗作用。
本研究结果表明:2.5~20.0 g • L-1 VACTⅠ对大鼠BMSCs增殖率起到不同程度的抑制作用,且细胞增殖率与时间和剂量呈负相关关系。BMP-4在肥大软骨细胞和成熟的骨细胞中广泛表达,可以促进软骨组织早期形成,而Sox9是软骨发育形成中的重要转录因子,在软骨的发育成熟等过程中发挥重要的调节作用[16-17]。本研究中ELISA法检测结果表明:VACTⅠ诱导可促进细胞释放BMP-4和Sox9,VACTⅠ在抑制BMSCs增殖的同时具有诱导其向软骨细胞分化的潜质。Ⅱ型胶原和聚集蛋白聚糖蛋白是Sox9调控的下游靶点蛋白,也是软骨组织的特征性蛋白,二者表达增加是软骨组织修复的标志过程[18-20]。本研究中RT-PCR法和Western blotting法检测结果表明:VACTⅠ可上调BMSCs中Ⅱ型胶原和聚集蛋白聚糖的表达水平,但诱导过程中各组细胞周期未发生明显变化。
综上所述,VACTⅠ可通过提高BMSCs中Ⅱ型胶原和聚集蛋白聚糖表达水平抑制其增殖,是一种潜在的成软骨分化诱导剂。
| [1] |
陈子秋, 刘顺贵, 刘义, 等. 微骨折术结合自体滑膜间充质干细胞移植修复关节软骨损伤的临床效果[J]. 中国骨与关节杂志, 2019, 8(7): 552-555. |
| [2] |
周云烽, 张正政, 陈仲, 等. 关节镜下钻孔术与微骨折锥术治疗距骨骨软骨损伤的疗效比较[J]. 中华创伤骨科杂志, 2020, 22(1): 13-19. |
| [3] |
SHEN J J, ZHANG C H, CHEN Z W, et al. LncRNA HOTAIR inhibited osteogenic differentiation of BMSCs by regulating Wnt/β-catenin pathway[J]. Eur Rev Med Pharmacol Sci, 2019, 23(17): 7232-7246. |
| [4] |
WANG B, LIN J, ZHANG Q, et al. αCGRP affects BMSCs' migration and osteogenesis via the hippo-YAP pathway[J]. Cell Transplant, 2019, 28(11): 1420-1431. DOI:10.1177/0963689719871000 |
| [5] |
张志达, 沈耿杨, 任辉, 等. 木通皂苷D促进糖皮质激素环境下小鼠骨髓间充质干细胞成骨分化[J]. 中国骨质疏松杂志, 2020, 26(4): 529-533. |
| [6] |
牛维, 孙志涛, 曹学伟, 等. 单味药鹿茸调控大鼠骨关节炎软骨组织Smad2、3表达的研究[J]. 中国中西医结合杂志, 2014, 34(2): 209-213. |
| [7] |
胡康, 张伟. 胶原蛋白作为医用生物材料对缺损组织修复、再生及重建的作用与意义[J]. 中国组织工程研究, 2019, 23(2): 317-322. |
| [8] |
周建烈, 刘忠厚. 补充钙和维生素D防治骨质疏松症的全球临床指南进展[J]. 中国骨质疏松杂志, 2017, 23(3): 371-380. |
| [9] |
马远征, 王以朋, 刘强, 等. 中国老年骨质疏松症诊疗指南(2018)[J]. 中国实用内科杂志, 2019, 39(1): 38-61. |
| [10] |
ZHOU P, LI Y, DI R L, et al. H19 and Foxc2 synergistically promotes osteogenic differentiation of BMSCs via Wnt-β-catenin pathway[J]. J Cell Physiol, 2019, 234(8): 13799-13806. DOI:10.1002/jcp.28060 |
| [11] |
LONG X J, WANG X Z, YAO L L, et al. Graphene/Si-promoted osteogenic differentiation of BMSCs through light illumination[J]. ACS Appl Mater Interfaces, 2019, 11(47): 43857-43864. DOI:10.1021/acsami.9b14679 |
| [12] |
王琦, 都帅, 赵全民, 等. 鹿茸多肽对小鼠胚胎成纤维细胞NIH/3T3增殖和胶原蛋白分泌能力的影响及其机制[J]. 吉林大学学报(医学版), 2019, 45(2): 307-312. |
| [13] |
潘慧欣, 崔元璐. 中药诱导骨髓间充质干细胞成软骨及成骨分化的研究进展[J]. 天津中医药, 2018, 35(10): 794-797. |
| [14] |
万德光, 杨文宇. 基于"品种-质量-药效"相关性的中药动物药品质观[J]. 中国现代中药, 2019, 21(9): 1127-1136. |
| [15] |
朱文赫, 钟秀宏, 张巍, 等. 鹿茸多肽-胶原蛋白/壳聚糖复合材料对家兔下颌骨缺损愈合的促进作用及其机制[J]. 吉林大学学报(医学版), 2017, 43(3): 527-531. |
| [16] |
姜明宇, 张剑白, 任明永, 等. 胚胎期宫内移植骨髓间充质干细胞对显性脊柱裂胎鼠脊髓骨形态发生蛋白4表达水平的影响研究[J]. 中国全科医学, 2020, 23(2): 189-193. |
| [17] |
刘菲, 李学智, 付妮妮, 等. 短刺法对兔膝骨关节炎软骨细胞Sox9、VEGF和ColX表达的影响[J]. 南方医科大学学报, 2016, 36(7): 997-1003. |
| [18] |
林瑞珠, 陈美华, 马川, 等. 烙灸对兔膝骨性关节炎软骨细胞外基质Ⅱ型胶原、蛋白多糖表达的影响[J]. 针灸临床杂志, 2019, 35(1): 54-57, 89. |
| [19] |
BAGI C M, BERRYMAN E R, TEO S, et al. Oral administration of undenatured native chicken type II collagen (UC-Ⅱ) diminished deterioration of articular cartilage in a rat model of osteoarthritis (OA)[J]. Osteoarthr Cartil, 2017, 25(12): 2080-2090. DOI:10.1016/j.joca.2017.08.013 |
| [20] |
李具宝, 何瑞建, 高焕焕, 等. 独活寄生汤对膝骨性关节炎退变软骨细胞Aggrecan和Collagen X mRNA表达的影响[J]. 中华中医药杂志, 2018, 33(11): 5125-5129. |
 2020, Vol. 46
2020, Vol. 46


