扩展功能
文章信息
- 张聪, 刘迪, 张寒雪, 张浩, 孔繁利, 冯宪敏
- ZHANG Cong, LIU Di, ZHANG Hanxue, ZHANG Hao, KONG Fanli, FENG Xianmin
- 人参皂苷对过氧化氢诱导的HepG2细胞损伤的保护作用
- Protective effect of ginsenoside on hydrogen peroxide-induced HepG2 cell injury
- 吉林大学学报(医学版), 2020, 46(05): 985-991
- Journal of Jilin University (Medicine Edition), 2020, 46(05): 985-991
- 10.13481/j.1671-587x.20200514
-
文章历史
- 收稿日期: 2020-01-20
2. 吉林医药学院基础医学院病原生物学教研室, 吉林 吉林 132013
2. Department of Pathogen Biology, School of Basic Medical Sciences, Jilin Medical University, Jilin 132013, China
氧化应激是指由于某种原因体内产生了超出机体清除能力的多余活性氧(reactive oxygen species,ROS),使机体正常情况下存在的氧化/还原平衡状态被破坏,体内蛋白质、脂质和核酸等生物大分子物质氧化损伤和功能紊乱,影响机体正常代谢过程的一种异常应激状态[1]。氧化应激是引起机体衰老、炎症和多种慢性疾病(糖尿病和高血压等)的主要原因之一[2]。人参皂苷是人参属药材中的一种固醇类化合物,是人参的主要活性成分之一,目前已知的人参皂苷约有几十种,其具有抗肿瘤、抗氧化和抗疲劳等多重功效,其中人参皂苷Rb1和Rg1在抗氧化应激的功效方面较为出色,具有治疗氧化应激介导疾病的潜力,也是在人参皂苷抗氧化应激研究中应用最普遍的2种皂苷。近年来,人参皂苷在国内外许多抑制氧化应激的研究中发挥了良好的抗氧化作用,其中核因子相关因子E2(nuclear factor erythroid 2-related factor 2,Nrf2)和核转录因子κB(nuclear transcription factor-kappaB,NF-κB)是人参皂苷抗氧化应激机制研究中涉及到最多的2种蛋白[3-7]。然而,氧化应激是一种涉及多条通路、影响机体多种功能的复杂病理过程,仅研究其中一两条相关通路并不能全面阐明其作用机制,逐步探索人参皂苷抑制氧化应激所涉及到的其他信号通路,构建完整的氧化应激通路网络,对人参皂苷治疗和预防氧化应激及其相关疾病具有重要意义。本研究采用过氧化氢(H2O2)诱导HepG2细胞氧化损伤,并采用人参皂苷RH1、F1、RD、RO和RE对其进行保护,根据各种人参皂苷对HepG2细胞的保护和毒性作用,综合考量选择其中一种,建立HepG2细胞的氧化损伤及保护模型,旨在考察人参皂苷对氧化损伤HepG2细胞的保护作用,为后续阐明人参皂苷抗氧化应激的调控机制奠定基础。
1 材料与方法 1.1 细胞、主要试剂和仪器人肝癌HepG2细胞由北华大学药学院实验室保存。人参皂苷RH1、F1、RD、RO和RE(纯度≥ 98%)(中国药品生物制品检定所)。DMEM培养基、胎牛血清(FBS)、青霉素-链霉素、PBS缓冲液、胰酶和平衡盐溶液(HBSS)(美国Gibco公司),二甲基亚砜(DMSO)、偶氮二异丁脒盐酸盐(AAPH)和水溶性维生素E(Trolox)(美国Sigma公司),细胞增殖与毒性检测试剂盒(CCK-8)(日本同仁化学研究所)、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(南京建成生物工程研究所),RIPA裂解液和细胞ROS检测试剂盒(碧云天生物技术有限公司),其他分析纯试剂(北京试剂厂)。多功能酶标仪(美国Molecular Devices公司),CO2培养箱(美国Thermo公司),激光扫描共聚焦显微镜(日本Olympus公司)。
1.2 细胞培养HepG2细胞采用含10% FBS、1%青霉素-链霉素的高糖DMEM培养基,在37℃、5%CO2培养箱中培养,细胞接种后孵育24 h。采用含40% FBS、10%DMSO的高糖DMEM培养基进行冻存。
1.3 CCK-8法检测各组细胞存活率孵育结束后,每孔加入10 μL CCK-8溶液,在37℃、5%CO2环境培养1.5 h,采用酶标仪在450 nm处测定吸光度(A)值。细胞存活率=(实验孔A值-空白孔A值)/(对照孔A值-空白孔A值)×100%。
1.4 细胞损伤实验将HepG2细胞分为空白组、对照组和损伤组,每组设3个平行孔。对照组和损伤组于96孔细胞培养板接种细胞悬液,每孔90 μL,接种密度为每孔5×103个细胞,空白组加入相同体积培养基,培养24 h。空白组和对照组加培养基,每孔10 μL,损伤组分别加入10 μL终浓度为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8和1.0 mmol·L-1的H2O2,孵育2 h。参照“1.3”中的方法测定各组细胞存活率。
1.5 细胞毒性实验HepG2细胞分为对照组和人参皂苷RH1、F1、RD、RO和RE组,每组设6个平行孔。对照组和人参皂苷组于96孔细胞培养板接种细胞悬液,每孔90 μL,接种密度为每孔5 × 103个细胞,培养24 h。人参皂苷组分别加入终浓度为10、20和40 μmol·L-1的人参皂苷RH1、F1、RD、RO和RE,每孔10 μL,对照组加培养基,每孔10 μL,孵育3 h。参照“1.3”中的方法测定各组细胞存活率。
1.6 细胞保护实验HepG2细胞分为对照组、损伤组和人参皂苷保护组,每组设6个平行孔。接种细胞悬液,每孔80 μL,接种密度为每孔5 × 103个细胞,培养24 h。人参皂苷保护组加入10、20和40 μmol·L-1的人参皂苷RH1、F1、RD、RO和RE,每孔10 μL,对照组和损伤组加入相同体积的DMEM空白培养基,孵育3 h。损伤组和人参皂苷保护组加入由“1.4”细胞损伤实验筛选出的达半数抑制浓度(IC50)时的H2O2,每孔10 μL,对照组加入相同体积的DMEM空白培养基,孵育2 h。参照“1.3”中的方法测定各组细胞存活率。
1.7 CAA法测定细胞抗氧化能力HepG2细胞分为设空白组、对照组和人参皂苷保护组,每组设3个平行孔。接种细胞悬液,每孔100 μL,接种密度为每孔5×103个细胞,培养24 h。孵育结束后弃去培养基,人参皂苷保护组分别加入100 μL含有不同浓度人参皂苷(1.25、2.50、5.00、10.00和20.00 μmol·L-1)和25 μmol·L-1 DCFH-DA溶液的培养基,空白组和对照组加入100 μL仅含有25 μmol·L-1 2',7'-二氯荧光黄双乙酸盐(DCFH-DA)的溶液,在37℃、5%CO2培养1 h去除DCFH-DA,用PBS洗涤1次。对照组和人参皂苷保护组加入100 μL含有600 μmol·L-1 AAPH的HBSS溶液处理,空白组加入100 μL的HBSS溶液,最后用荧光酶标仪(激发波长为485/20,发射波长为528/20)每5 min测定一次荧光值,持续1 h。CAA unit= 1-(∫SA /∫CA)。其中∫SA表示样品曲线累积面积,∫CA表示对照组曲线累积面积。
1.8 DCFH-DA探针法测定细胞中ROS水平HepG2细胞分为对照组、损伤组、人参皂苷对照组和人参皂苷保护组,每组设3个平行孔,将HepG2细胞接种到6孔细胞培养板中,每孔2 mL,接种密度为每孔1 × 105个细胞,培养24 h。人参皂苷对照组和人参皂苷保护组加入10、20和40 μmol·L-1的人参皂苷,每孔250 μL,损伤组和对照组补充相同体积的DMEM空白培养基,孵育3 h。损伤组和人参皂苷保护组加入由“1.4”细胞损伤实验筛选出的达IC50时浓度的H2O2,每孔250 μL,对照组和人参皂苷对照组加入相同体积的DMEM空白培养基,孵育2 h,孵育结束后移除培养基,PBS缓冲液清洗2次,按照ROS检测试剂盒的说明书步骤进行后续操作,最后置于激光共聚焦显微镜下检测荧光强度,激发波长488 nm,发射波长525 nm。以各组细胞荧光强度代表ROS水平。
1.9 WST-1法测定细胞中SOD活性细胞接种、分组及给药处理方法参照“1.8”。孵育完成后移除培养基,加入含PMSF的RIPA裂解液,每孔100 μL,冰浴裂解10 min,裂解液4℃、12 000 r·min-1离心10 min,收集上清采用BCA蛋白浓度检测试剂盒测定蛋白水平,并根据SOD检测试剂盒说明书检测SOD活性。
1.10 统计学分析采用GraphPad Prism 8.0统计软件进行统计学分析。各组细胞存活率、ROS水平和SOD活性均符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 H2O2损伤后HepG2细胞存活率采用0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8和1.0 mmol·L-1的H2O2处理HepG2细胞后,在H2O2浓度为0.4 mmol·L-1时,HepG2细胞存活率为(49.10±3.66)%,与对照组比较差异有统计学意义(P < 0.05)。见图 1。
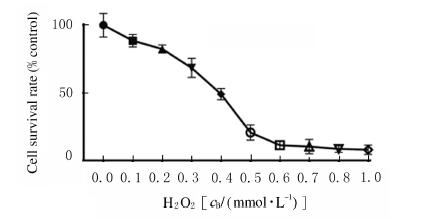
|
| 图 1 不同浓度H2O2损伤后HepG2细胞存活率 Fig. 1 Survival rates of HepG2 cells after injured by different concentrations of H2O2 |
|
|
与H2O2损伤组比较,10、20和40 μmol·L-1人参皂苷RH1、F1及RD保护组、20和40 μmol·L-1人参皂苷RE保护组以及40 μmol·L-1人参皂苷RO保护组HepG2细胞存活率明显升高(P < 0.05)。其中,10、20和40 μmol·L-1人参皂苷F1保护组HepG2细胞存活率升高最为明显,细胞存活率分别为(56.70±3.01)%、(61.49±3.15)%和(69.56±4.36)%。见表 1。
| (n=6, x±s, η/%) | |||||||||||||||||||||||||||||
| Group | Survival rate | ||||||||||||||||||||||||||||
| Control | 100.00±3.79 | ||||||||||||||||||||||||||||
| Injury | 49.82±1.13 | ||||||||||||||||||||||||||||
| Ginsenoside RH1(μmol·L-1) | |||||||||||||||||||||||||||||
| 10 | 54.65±2.01** | ||||||||||||||||||||||||||||
| 20 | 58.01±4.00** | ||||||||||||||||||||||||||||
| 40 | 65.91±3.87** | ||||||||||||||||||||||||||||
| Ginsenoside F1(μmol·L-1) | |||||||||||||||||||||||||||||
| 10 | 56.70±3.01** | ||||||||||||||||||||||||||||
| 20 | 61.49±3.15** | ||||||||||||||||||||||||||||
| 30 | 69.56±4.36** | ||||||||||||||||||||||||||||
| Ginsenoside RE(μmol·L-1) | |||||||||||||||||||||||||||||
| 10 | 51.24±2.23 | ||||||||||||||||||||||||||||
| 20 | 53.01±2.19* | ||||||||||||||||||||||||||||
| 40 | 54.26±3.91* | ||||||||||||||||||||||||||||
| Ginsenoside RO(μmol·L-1) | |||||||||||||||||||||||||||||
| 10 | 50.89±3.82 | ||||||||||||||||||||||||||||
| 20 | 52.21±3.57 | ||||||||||||||||||||||||||||
| 40 | 54.56±3.08* | ||||||||||||||||||||||||||||
| Ginsenoside RD(μmol·L-1) | |||||||||||||||||||||||||||||
| 10 | 53.60±2.48** | ||||||||||||||||||||||||||||
| 20 | 55.06±3.01** | ||||||||||||||||||||||||||||
| 40 | 62.88±3.07** | ||||||||||||||||||||||||||||
| * P < 0.05, **P < 0.01 vs injury group. | |||||||||||||||||||||||||||||
与对照组比较,10、20和40 μmol·L-1人参皂苷RH1、F1、RD、RO及RE对照组HepG2细胞存活率差异无统计学意义(P > 0.05)。见表 2。
| (n=6, x±s, η/%) | |||||||||||||||||||||||||||||
| Group | Survival rate | ||||||||||||||||||||||||||||
| Control | 100.00±3.79 | ||||||||||||||||||||||||||||
| Ginsenoside RH1(μmol·L-1) | |||||||||||||||||||||||||||||
| 10 | 97.64±2.29 | ||||||||||||||||||||||||||||
| 20 | 97.75±2.01 | ||||||||||||||||||||||||||||
| 40 | 96.90±1.66 | ||||||||||||||||||||||||||||
| Ginsenoside F1(μmol·L-1) | |||||||||||||||||||||||||||||
| 10 | 99.85±3.75 | ||||||||||||||||||||||||||||
| 20 | 100.74±4.04 | ||||||||||||||||||||||||||||
| 30 | 101.27±3.40 | ||||||||||||||||||||||||||||
| Ginsenoside RE(μmol·L-1) | |||||||||||||||||||||||||||||
| 10 | 99.39±2.83 | ||||||||||||||||||||||||||||
| 20 | 97.25±3.44 | ||||||||||||||||||||||||||||
| 40 | 95.20±4.21 | ||||||||||||||||||||||||||||
| Ginsenoside RO(μmol·L-1) | |||||||||||||||||||||||||||||
| 10 | 99.91±3.31 | ||||||||||||||||||||||||||||
| 20 | 97.60±3.24 | ||||||||||||||||||||||||||||
| 40 | 96.66±2.59 | ||||||||||||||||||||||||||||
| Ginsenoside RD(μmol·L-1) | |||||||||||||||||||||||||||||
| 10 | 99.34±2.93 | ||||||||||||||||||||||||||||
| 20 | 97.90±1.85 | ||||||||||||||||||||||||||||
| 40 | 99.34±2.93 | ||||||||||||||||||||||||||||
与对照组比较,随着人参皂苷浓度(1.25、2.50、5.00、10.00和20.00 μmol·L-1)增加,荧光强度逐渐减小,并呈浓度依赖性降低,表明人参皂苷F1能有效提高HepG2细胞的抗氧化能力(P < 0.05)。见图 2。
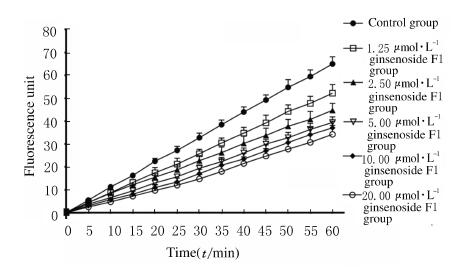
|
| 图 2 人参皂苷F1作用后各组HepG2细胞中AAPH诱导DCFH氧化的动力学曲线 Fig. 2 Kinetic curves of DCFH oxidation induced by AAPH in HepG2 cells after treated with ginsenoside F1 in various groups |
|
|
人参皂苷的半数效应浓度(EC50)由剂量-反应曲线和中效原理计算结果。见图 3和图 4。CAA值由EC50值转化而来,本实验结果以Trolox为标准品计算CAA当量,以μmol·L-1 TE(Trolox当量)/ μmol·L-1样品表示,且EC50越小,CAA值越大,表示抗氧化效果越好。人参皂苷F1的EC50为(15.82±0.82)μmol·L-1,Trolox EC50值为(201.73±0.28)μmol·L-1;人参皂苷F1的CAA当量为(1 275.20±33.90)μmol TE/100 μmol·L-1人参皂苷F1。
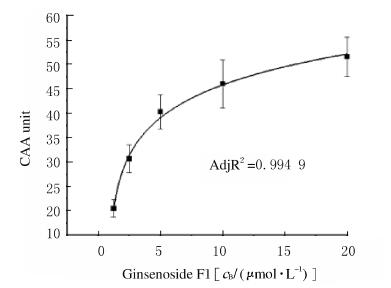
|
| 图 3 人参皂苷F1作用后各组HepG2细胞中AAPH诱导DCFH氧化的剂量-反应曲线 Fig. 3 Dose-effect curve of DCFH oxidation induced by AAPH in HepG2 cells after treated with ginsenoside F1 in various groups |
|
|
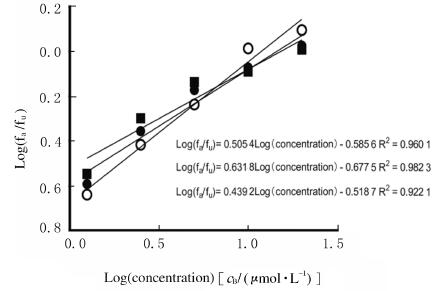
|
| fa meaned the effective score was CAA unit; fu meaned the non effective score was 100-CAA unit. 图 4 人参皂苷作用后HepG2细胞中AAPH诱导DCFH氧化的中效原理图 Fig. 4 Medium effect schematic diagram of DCFH oxidation induced by AAPH in HepG2 cells after treated with ginsenoside |
|
|
与对照组比较,损伤组细胞绿色荧光强度增强,10、20和40 μmol·L-1人参皂苷F1对照组细胞荧光强度逐渐减弱。与损伤组比较,10、20和40 μmol·L-1人参皂苷F1保护组细胞荧光强度逐渐减弱。与对照组比较,损伤组细胞中ROS水平明显升高(P < 0.05),10、20和40 μmol·L-1人参皂苷F1对照组细胞中ROS水平明显降低(P < 0.05);与损伤组比较,10、20和40 μmol·L-1人参皂苷F1保护组细胞中ROS水平明显降低(P < 0.05或P < 0.01)。见图 5(插页四)和表 3。
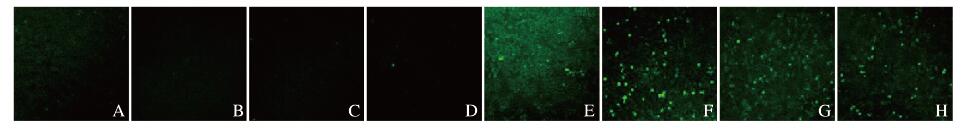
|
| A:Control group; B-D:10, 20, and 40 μmol·L-1 F1 groups; E: Injury group; F-H:H2O2 + 10, 20, and 40 μmol·L-1 groups. 图 5 荧光显微镜观察各组HepG2细胞中ROS水平 Fig. 5 Levels of ROS in HepG2 cells in various groups observed by fluorescence microscope |
|
|
| (n=3, x±s) | |||||||||||||||||||||||||||||
| Group | ROS level | ||||||||||||||||||||||||||||
| Control | 1.00±0.08 | ||||||||||||||||||||||||||||
| Injury | 3.05±0.24 | ||||||||||||||||||||||||||||
| Ginsenoside F1(μmol·L-1) | |||||||||||||||||||||||||||||
| 10 | 0.43±0.02△ | ||||||||||||||||||||||||||||
| 20 | 0.28±0.04△ | ||||||||||||||||||||||||||||
| 40 | 0.21±0.06△ | ||||||||||||||||||||||||||||
| H2O2+ginsenoside F1 | |||||||||||||||||||||||||||||
| 10 | 2.22±0.28* | ||||||||||||||||||||||||||||
| 20 | 1.95±0.20** | ||||||||||||||||||||||||||||
| 40 | 1.43±0.15** | ||||||||||||||||||||||||||||
| *P < 0.01 vs control group;△P < 0.05, △△P < 0.01 vs injury group. | |||||||||||||||||||||||||||||
与对照组(98.89±3.57)比较,损伤组HepG2细胞中SOD活性(42.99±2.38)明显降低(P < 0.05),10、20和40 μmol·L-1人参皂苷F1对照组HepG2细胞中SOD活性(109.81±1.68、117.79±0.28和127.19±1.49)明显升高(P < 0.05)。与损伤组比较,10、20和40 μmol·L-1人参皂苷F1保护组HepG2细胞中SOD活性(51.13±3.35、57.16±2.12和73.90±3.40)明显升高(P < 0.05)。
3 讨论人参皂苷在浓度较高时往往对细胞表现出促凋亡作用,多用于抑制细胞增殖等方面的研究,在以往人参皂苷抑制细胞氧化应激的研究中,研究者多选择40 μmol·L-1以下的浓度作为处理浓度[8-9]。本研究结果显示:人参皂苷RH1、F1、RD、RO和RE预处理的HepG2细胞在受到H2O2氧化损伤时细胞存活率均有所升高,其中采用人参皂苷F1对H2O2诱导的氧化损伤HepG2细胞保护作用最强,人参皂苷RO对H2O2诱导的氧化损伤HepG2细胞保护作用最小,且人参皂苷RH1、F1、RD、RO和RE对HepG2细胞均无增殖和毒性作用,表明该浓度范围内的人参皂苷能够提高氧化损伤的HepG2细胞存活率的原因与其增殖无关。因此,本研究选用人参皂苷F1进行后续实验。人参皂苷F1是人参皂苷Rg1水解β-D葡萄糖苷得到的次级皂苷[10]。研究[11]表明:原人参皂苷可以通过水解等方式转化为次级人参皂苷,次级人参皂苷同样具有良好的药理作用。
为进一步考察人参皂苷F1对H2O2诱导的氧化损伤的HepG2细胞的保护作用,本研究采用CAA法检测细胞的抗氧化活性、DCFH-DA探针法测定细胞ROS水平和WST-1法水平细胞SOD活性。CAA法是由美国康奈尔大学刘瑞海教授建立的评价细胞抗氧化能力的方法,该方法利用外源性DCFH-DA探针能够被HepG2细胞内的酯酶催化形成DCFH,DCFH被氧自由基氧化后形成具有荧光的DCF的特性,根据细胞荧光物质的量判断细胞的抗氧化能力,荧光物质越少说明细胞抗氧化能力越强[12]。本研究CCA法检测结果显示:人参皂苷F1可有效降低HepG2细胞荧光强度,且荧光强度呈浓度依赖性降低,人参皂苷F1的EC50为(15.82±0.82)μmol·L-1,CAA当量为(1 275.20±33.90)μmol TE/100 μmol·L-1人参皂苷F1。研究[13]表明:EC50与CAA值呈负相关关系,EC50越小,CAA值越大,表明抗氧化物质提高细胞抗氧化能力的作用越强。人体内的ROS主要来源于线粒体氧化呼吸链[14]。研究[15]表明:人参皂苷Rg1可以通过改善线粒体功能,调节ROS的产生。本研究结果显示:人参皂苷F1预处理的H2O2诱导氧化损伤的HepG2细胞中ROS水平较氧化损伤的HepG2细胞低,与其他研究[16]发现的人参皂苷F1通过激活SIRT1、降低ROS水平、恢复线粒体功能从而抑制氧化应激对心肌细胞造成损伤的结果相符。本研究结果显示:人参皂苷F1预处理的HepG2细胞中ROS水平较对照组降低。这可能是由于HepG2细胞是癌细胞,与其他正常组织细胞比较,癌细胞本身就存在高水平的ROS[17-18],因此在采用人参皂苷F1处理后,无论是否用H2O2诱导氧化损伤,HepG2细胞中ROS水平均呈现下降,表明人参皂苷F1可以通过抑制ROS产生和累积从而抑制细胞氧化应激损伤。人体本身存在抗氧化系统,该系统发挥抗氧化作用主要是依赖以SOD为首的一系列抗氧化酶的酶促反应作用[19]。本研究结果显示:氧化损伤的HepG2细胞中SOD活性明显下降,可能是由于利用H2O2诱导损伤后,细胞中SOD短时间内大量消耗,得不到及时补充;人参皂苷F1预处理的氧化损伤的HepG2细胞中SOD活性相对升高,表明在氧化应激条件下,人参皂苷F1可能是通过升高SOD活性加快过量ROS的清除速度从而抑制细胞氧化应激损伤。研究[20-23]表明:人参皂苷F1的前体Rg1、人参皂苷Rh2和Rg2可以通过升高SOD等一系列抗氧化酶的活性,起到对氧化损伤细胞的保护作用,与本研究结果相一致。
综上所述,不同的人参皂苷对细胞氧化损伤的保护作用存在一定差别,其中人参皂苷F1通过降低ROS水平和升高SOD活性对H2O2诱导的HepG2细胞氧化损伤起到一定的保护作用。本研究结果为后续人参皂苷F1抗细胞氧化应激的信号通路调控机制的研究奠定了良好的实验基础。
| [1] |
SIES H. Biological redox systems and oxidative stress[J]. Cell Mol Life Sci, 2007, 64(17): 2181-2188. DOI:10.1007/s00018-007-7230-8 |
| [2] |
JOMOVA K, VALKO M. Advances in metal-induced oxidative stress and human disease[J]. Toxicology, 2011, 283(2/3): 65-87. |
| [3] |
QIN Q J, LIN N, HUANG H, et al. Ginsenoside Rg1 ameliorates cardiac oxidative stress and inflammation in streptozotocin-induced diabetic rats[J]. Diabetes Metab Syndr Obes, 2019, 12: 1091-1103. DOI:10.2147/DMSO.S208989 |
| [4] |
CHEN S F, LI X, WANG Y L, et al. Ginsenoside Rb1 attenuates intestinal ischemia/reperfusion induced inflammation and oxidative stress via activation of the PI3K/Akt/Nrf2 signaling pathway[J]. Mol Med Rep, 2019, 19(5): 3633-3641. |
| [5] |
GAO Y, CHU S F, ZHANG Z, et al. Ginsenoside Rg1 prevents acetaminophen-induced oxidative stress and apoptosis via Nrf2/ARE signaling pathway[J]. J Asian Nat Prod Res, 2019, 21(8): 782-797. DOI:10.1080/10286020.2018.1504024 |
| [6] |
CHEN J, LIU G Z, SUN Q, et al. Protective effects of ginsenoside Rg3 on TNF-α-induced human nucleus pulposus cells through inhibiting NF-κB signaling pathway[J]. Life Sci, 2019, 216: 1-9. DOI:10.1016/j.lfs.2018.11.022 |
| [7] |
SONG W, WEI L, DU Y W, et al. Protective effect of ginsenoside metabolite compound K against diabetic nephropathy by inhibiting NLRP3 inflammasome activation and NF-κB/p38 signaling pathway in high-fat diet/streptozotocin-induced diabetic mice[J]. Int Immunopharmacol, 2018, 63: 227-238. DOI:10.1016/j.intimp.2018.07.027 |
| [8] |
YE J T, LI F T, HUANG S L, et al. Effects of ginsenoside Rb1 on spinal cord ischemia-reperfusion injury in rats[J]. J Orthop Surg Res, 2019, 14(1): 259. DOI:10.1186/s13018-019-1299-2 |
| [9] |
HU J N, XU X Y, LI W, et al. Ginsenoside Rk1 ameliorates paracetamol-induced hepatotoxicity in mice through inhibition of inflammation, oxidative stress, nitrative stress and apoptosis[J]. J Ginseng Res, 2019, 43(1): 10-19. DOI:10.1016/j.jgr.2017.07.003 |
| [10] |
WEI Y, ZHAO W Q, ZHANG Q, et al. Purification and characteri zation of a novel and unique ginsenoside Rg1-hydrolyzing β-D-gluco sidase from Penicillium sclerotiorum[J]. Acta Biochim Biophys Sin (Shanghai), 2011, 43(3): 226-231. DOI:10.1093/abbs/gmr001 |
| [11] |
BAE E A, SHIN J E, KIM D H. Metabolism of ginsenoside Re by human intestinal microflora and its estrogenic effect[J]. Biol Pharm Bull, 2005, 28(10): 1903-1908. DOI:10.1248/bpb.28.1903 |
| [12] |
WOLFE K L, LIU R H. Cellular antioxidant activity(CAA)assay for assessing antioxidants, foods, and dietary supplements[J]. J Agric Food Chem, 2007, 55(22): 8896-8907. DOI:10.1021/jf0715166 |
| [13] |
WEN L R, GUO X B, LIU R H, et al. Phenolic contents and cellular antioxidant activity of Chinese hawthorn "Crataegus pinnatifida"[J]. Food Chem, 2015, 186: 54-62. DOI:10.1016/j.foodchem.2015.03.017 |
| [14] |
PARK C, CHOI S H, JEONG J W, et al. Honokiol ameliorates oxidative stress-induced DNA damage and apoptosis of c2c12 myoblasts by ROS generation and mitochondrial pathway[J]. Anim Cells Syst (Seoul), 2020, 24(1): 60-68. DOI:10.1080/19768354.2019.1706634 |
| [15] |
MO J, ZHOU Y L, YANG R H, et al. Ginsenoside Rg1 ameliorates palmitic acid-induced insulin resistance in HepG2 cells in association with modulating Akt and JNK activity[J]. Pharmacol Rep, 2019, 71(6): 1160-1167. DOI:10.1016/j.pharep.2019.07.004 |
| [16] |
WANG Y, LIANG X Y, CHEN Y Q, et al. Screening SIRT1 activators from medicinal plants as bioactive compounds against oxidative damage in mitochondrial function[J]. Oxid Med Cell Longev, 2016, 2016: 4206392. |
| [17] |
PAYEN V L, ZAMPIERI L X, PORPORATO P E, et al. Pro-and antitumor effects of mitochondrial reactive oxygen species[J]. Cancer Metastasis Rev, 2019, 38(1/2): 189-203. |
| [18] |
KALYANARAMAN B, CHENG G, HARDY M, et al. Teaching the basics of reactive oxygen species and their relevance to cancer biology:Mitocho ndrial reactive oxygen species detection, redox signaling, and targeted therapies[J]. Redox Biol, 2018, 15: 347-362. DOI:10.1016/j.redox.2017.12.012 |
| [19] |
LI H X, HUANG X N, ZHAN A B. Stress memory of recurrent environmental challenges in marine invasive species:Ciona robusta as a case study[J]. Front Physiol, 2020, 11: 94. DOI:10.3389/fphys.2020.00094 |
| [20] |
叶劲涛, 宋焕瑾, 李锋涛, 等. 人参皂苷Rg1对大鼠脊髓缺血再灌注损伤中survivin蛋白表达及细胞凋亡的影响[J]. 西安交通大学学报(医学版), 2019, 40(4): 646-652. |
| [21] |
HUO D S, SUN J F, CAI Z P, et al. The protective mechanisms underlying Ginsenoside Rg1 effects on rat sciatic nerve injury[J]. J Toxicol Environ Health Part A, 2019, 82(19): 1027-1035. DOI:10.1080/15287394.2019.1684028 |
| [22] |
LU C, WANG Y, LV J, et al. Ginsenoside Rh2 reverses sleep deprivation-induced cognitive deficit in mice[J]. Behav Brain Res, 2018, 349: 109-115. DOI:10.1016/j.bbr.2018.03.005 |
| [23] |
FU W W, SUI D Y, YU X F, et al. Protective effects of ginsenoside Rg2 against H2O2-induced injury and apoptosis in H9c2 cells[J]. Int J Clin Exp Med, 2015, 8(11): 19938-19947. |
 2020, Vol. 46
2020, Vol. 46


