扩展功能
文章信息
- 李琪, 徐瑞, 李藤藤, 江一川, 李敏
- LI Qi, XU Rui, LI Tengteng, JIANG Yichuan, LI Min
- 吡柔比星对大鼠心肌细胞的损伤作用及其模型建立
- Effect of pirarubicin on cardiomyocyte injury in rats and establishment of its model
- 吉林大学学报(医学版), 2020, 46(05): 948-954
- Journal of Jilin University (Medicine Edition), 2020, 46(05): 948-954
- 10.13481/j.1671-587x.20200509
-
文章历史
- 收稿日期: 2020-02-19
2. 锦州医科大学附属第三医院病理科, 辽宁 锦州 120001;
3. 吉林大学药学院药理实验中心, 吉林 长春 130021
2. Department of Pathology, Third Affiliated Hospital, Jinzhou Medical University, Jinzhou 120001, China;
3. Experiment Center of Pharmacology, School of Pharmacy, Jilin University, Changchun 130021, China
蒽环类药物是多种实体肿瘤和血液淋巴系统恶性肿瘤的基础性治疗药物。临床研究[1-2]显示:蒽环类药物可诱导心脏毒性发生,且常呈进展性和不可逆性。由于蒽环类药物导致的心脏毒性反应发生的复杂性和临床表现的多样性,目前尚无有效的治疗方法。近年来,抗肿瘤药物心脏毒性的研究成为热点,蒽环类药物导致的心脏毒性模型和心肌细胞损伤模型也逐渐在相关的研究中被广泛使用。其中,阿霉素(doxorubicin,DOX)诱导为目前国内外实验研究中常用制备心肌细胞损伤模型的方法,但其细胞死亡率较高[3-5],干预手段常不能明显缓解心肌细胞的损伤。DOX作为第1代蒽环类药物,因其抗肿瘤针对性弱、心脏毒性大,临床上已逐渐被第3代蒽环类药物吡柔比星(theprubicin,THP)等所取代。目前THP在临床中广泛应用,但在接受THP化疗的患者依然会出现不同程度的心脏毒性反应,限制其长期使用。深入研究蒽环类药物导致的心肌细胞损伤,寻找恰当的预防蒽环类药物导致的心脏毒性反应的手段仍然是肿瘤和心血管疾病研究的热点。由于DOX诱导心肌细胞损伤的模型存在诸多缺陷,根据临床上蒽环类药物的实际应用情况,建立THP诱导心肌细胞损伤模型具有现实意义。因此,本研究采用THP作为造模药物,对比分析不同时间、不同浓度THP诱导大鼠心肌细胞(H9C2细胞)的损伤情况,探讨THP诱导心肌细胞损伤模型的建立条件,为今后开展蒽环类药物心脏毒性的相关研究提供实验依据。
1 材料与方法 1.1 细胞株、药品、主要试剂和仪器大鼠H9C2细胞由吉林大学生命科学学院实验室馈赠,吉林大学药学院实验药理与毒理学教研室冻存。注射用THP(深圳万乐药业有限公司),DMEM高糖培养液(美国Hyclone公司),CCK-8试剂盒(上海碧云天生物技术有限公司),DCFH-DA活性氧(reactive oxygen species,ROS)检测试剂盒(上海祤圣生物科技有限公司),丙二醛(malonaldehyde,MDA)和超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(北京索莱宝公司),乳酸脱氢酶(lactic dehydrogenase,LDH)活性检测试剂盒(南京建成生物工程研究所),TUNEL试剂盒(瑞士罗氏公司),TRIzol试剂盒(美国Invitrogen公司),逆转录试剂盒(北京全式金生物技术有限公司),总蛋白提取试剂盒(北京普利莱基因技术有限公司)。倒置荧光显微镜和生物显微镜(日本Nikon公司),酶联免疫检测仪(美国MD公司),实时荧光定量PCR仪(德国耶拿公司),电泳槽、流式细胞仪、CO2恒温培养箱和JJ260型精密电子天平(美国BD公司)。
1.2 细胞培养H9C2细胞生长于含10%胎牛血清的DMEM高糖培养液中,置于37℃、5%CO2饱和湿度的恒温密闭培养箱中进行常规培养并传代,0.25%胰蛋白酶消化,每2~3 d消化传代1次。
1.3 CCK-8法检测各组细胞存活率在DMEM中制备浓度分别为1×10-6、1×10-5、1×10-4和1×10-3 mol·L-1的THP工作液。将细胞接种于96孔细胞培养板(每孔5×104个细胞),分别培养12、24、36和48 h后,每孔加入10 μL CCK-8,37℃孵育2 h。酶标仪检测450 nm波长处吸光度(A)值。细胞存活率=实验组A值/对照组A值×100%。根据结果选择THP最佳造模浓度(1~10 μmol·L-1)和时间(24 h),随后采用不同浓度THP(1、3、5、7和9 μmol·L-1)处理细胞24 h,加入10 μL CCK-8,37℃孵育2 h,再次检测各组细胞存活率。
1.4 光学显微镜观察各组细胞形态表现将细胞接种于6孔细胞培养板(每孔1×106个细胞)中培养24 h。细胞分为空白对照组和不同浓度THP组,分别采用0、1、5和9 μmol·L-1 THP处理24 h后,将6孔细胞培养板放入倒置显微镜下观察细胞形态表现,并拍照记录。
1.5 DCFH-DA ROS试剂盒检测各组细胞中ROS水平使用DCFH-DA ROS检测试剂盒测定各组细胞中ROS水平。将细胞接种于6孔细胞培养板(每孔1×106个细胞)中培养24 h。细胞分为空白对照组和不同浓度THP组,分别采用0、1、5和9 μmol·L-1 THP处理24 h。吸除弃液,用无血清DMEM清洗2次,加入1 mL DCFH-DA(10 μmol·L-1),37℃孵育30 min,置于荧光显微镜下观察拍照。
1.6 各组细胞中MDA水平及SOD和LDH活性检测将细胞接种于6孔细胞培养板(每孔1×106个细胞)中培养24 h。细胞分为空白对照组和不同浓度THP组,分别采用0、1、5和9 μmol·L-1 THP处理24 h,收集各组细胞,具体步骤参照试剂盒说明书。
1.7 TUNEL试剂盒检测H9C2细胞凋亡率将高压灭菌多聚赖氨酸处理过的盖玻片放入6孔细胞培养板中,细胞分组同“1.6”,将细胞接种于6孔细胞培养板(每孔1×106个细胞)中培养24 h。4%多聚甲醛中固定25 min,按照TUNEL试剂盒说明书进行操作。应用荧光显微镜观察凋亡细胞,任选1个视野进行凋亡细胞计数,计算H9C2细胞凋亡率。细胞凋亡率=凋亡细胞数/全部细胞×100%。
1.8 qRTPCR法检测各组细胞中B淋巴细胞瘤2相关X蛋白(Bax)、B淋巴细胞瘤2(Bcl-2)、半胱氨酸蛋白酶3(Caspase-3)和半胱氨酸蛋白酶9(Caspase-9)mRNA水平将细胞接种于6孔细胞培养板(每孔1×106个细胞)中培养24 h。细胞分组同“1.6”,采用THP(1、5和9 μmol·L-1)处理各组细胞24 h。收集细胞,TRIzol法提取细胞中的总RNA,实验步骤参照试剂盒说明书。应用紫外分光光度计检测RNA的浓度及纯度,反转录合成cDNA,步骤参照cDNA合成试剂盒,根据qRT-PCR试剂盒检测Bax、Bcl-2、Caspase-3和Caspase-9 mRNA表达水平,内参基因为GAPDH。反应程序:94℃、15 s(变性);58℃、15 s(退火),72℃、15 s(延伸),40个循环。采用相对定量2-△△Ct法计算各组细胞目的基因mRNA表达水平。引物序列见表 1。
| Primer | Sequences(5'-3') |
| Bax | F: GATCAGCTCGGGCACTTTA |
| R: TGTTTGCTGATGGCAACTTC | |
| Bcl-2 | F: CCGGGAGAACAGGGTATGATAA |
| R: CCCACTCGTAGCCCCTCTG | |
| Caspase-3 | F: AACGGACCTGTGGACCTGAA |
| R: TCAATACCGCAGTCCAGCTCT | |
| Caspase-9 | F: GGAAGATCGAGAGACATGCAG |
| R: CCGTGACCATTTTCTTAGCAG | |
| GAPDH | F: GGCACAGTCAAGGCTGAGAAT |
| R: ATGGTGGTGAAGACGCCAGTA |
将细胞接种于6孔细胞培养板(每孔1×106个细胞)中培养24 h。细胞分组和处理见“1.6”。收集细胞,按照总蛋白提取试剂盒说明书提取各组总蛋白,采用BCA定量,进行SDS-PAGE凝胶电泳,湿转法转膜至PVDF膜上,Western blotting法封闭液封闭2 h,加入一抗,4℃孵育过夜,次日加入用Western blotting法二抗稀释液稀释后的二抗,并在室温摇床孵育2 h,按照高敏感度化学发光检测试剂盒说明书滴加发光工作液显色后,以GAPDH为内参,采用Image proplus 6.0软件进行灰度分析。实验过程中涉及的抗体及稀释浓度见表 2。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH条带灰度值。
| Antibody | Dilution | Source | Company |
| Primary antibody | |||
| Bax | 1︰800 | Rabbit | ABclonal, Wuhan, China |
| Bcl-2 | 1︰800 | Rabbit | ABclonal, Wuhan, China |
| Cleaved Caspase-3 | 1︰800 | Rabbit | ABclonal, Wuhan, China |
| Cleaved Caspase-9 | 1︰800 | Rabbit | ABclonal, Wuhan, China |
| GAPDH | 1︰2 000 | Rabbit | ABclonal, Wuhan, China |
| Secondary antibody | |||
| HRP Goat Anti-Rabbit IgG | 1︰5 000 | Goat | ABclonal, Wuhan, China |
采用SPSS 23.0统计软件进行统计学分析。各组H9C2细胞存活率,细胞凋亡率,各组细胞中Bax、Bcl-2、Caspase-3和Caspase-9 mRNA表达水平和Bax、Bcl-2、Cleaved Caspase-3和Cleaved Caspase-9蛋白表达水平均符合正态分布且方差齐,以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 CCK-8法检测各组细胞存活率及倒置显微镜下H9C2细胞形态表现CCK-8法检测THP细胞存活率,结果显示:THP最佳造模时间为24 h,见图 1A;造模浓度范围为1×10-6~1×10-5 mol·L-1,见图 1A和B。与空白对照组比较,1、3、5、7和9 μmol·L-1 THP组细胞存活率均明显降低(P < 0.05或P < 0.01),各组细胞存活率见图 1C。倒置显微镜观察结果显示:THP处理后的细胞形态变小、数量减少,甚至死亡漂浮,见图 2。根据以上结果,选择1、5和9 μmol·L-1 THP组进行后续实验。
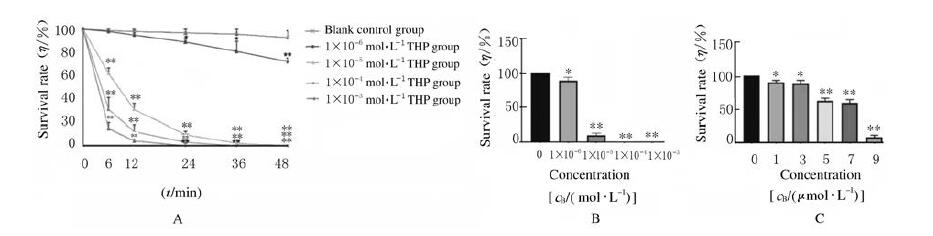
|
| A:Survival rates of H9C2 cells; B:Survival rates of H9C2 cells treated with different modeling concentrations of THP; C:Survival rates of H9C2 treated with different concentrations of THP. *P < 0.05, **P < 0.01 vs blank control group(0 μmol·L-1 THP). 图 1 各组H9C2细胞的存活率 Fig. 1 Survival rates of H9C2 cells in various groups |
|
|
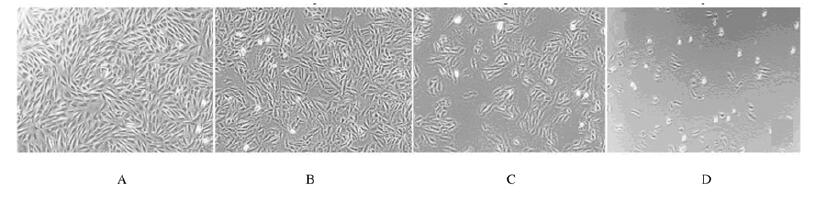
|
| A: Blank control group; B-D: 1, 5, and 9 μmol·L-1 THP groups. 图 2 各组H9C2细胞形态表现(×40) Fig. 2 Morphology of H9C2 cells in various groups(×40) |
|
|
DCFH-DA探针法检测细胞中ROS水平,结果显示:与空白对照组比较,1、5和9 μmol·L-1 THP组细胞中ROS水平升高,且呈浓度依赖性。5 μmol·L-1 THP组细胞形态正常;9 μmol·L-1 THP组细胞变圆,见图 3(插页二)。与空白对照组比较,1 μmol·L-1 THP组细胞中MDA水平和SOD活性差异无统计学意义(P > 0.05),5和9 μmol·L-1 THP组细胞中MDA水平明显升高(P < 0.01),SOD活性明显降低(P < 0.01),1、5和9 μmol·L-1 THP组LDH活性明显升高(P < 0.05或P < 0.01)。见图 4。
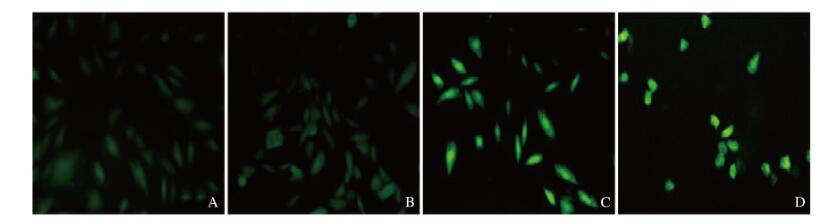
|
| A: Control group(0 μmol·L1THP); B-D: 1, 5, and 9 μmol·L1THP groups. 图 3 DCFH-DA探针法检测各组细胞中ROS水平 Fig. 3 Intracellular ROS levels in various groups detected by DCFH-DA probe |
|
|
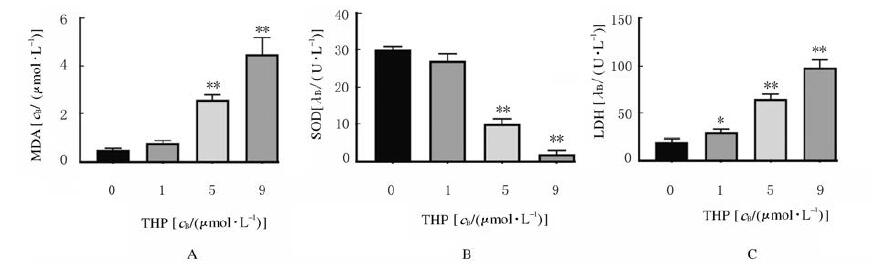
|
| A:MDA level; B:SOD activity; C:LDH activity.*P < 0.05, **P < 0.01 vs blank control group(0 μmol·L-1 THP group) 图 4 各组细胞中MDA水平及SOD和LDH活性 Fig. 4 Intracellular MDA levels and SOD and LDH activities in various groups |
|
|
1、5和9 μmol·L-1 THP组的细胞凋亡率分别为(7.01±3.03)%、(42.09±4.98)%和(92.21±3.08)%,较空白对照组(1.05%±0.94%)明显升高(P < 0.05或P < 0.01)。见图 5(插页二)。
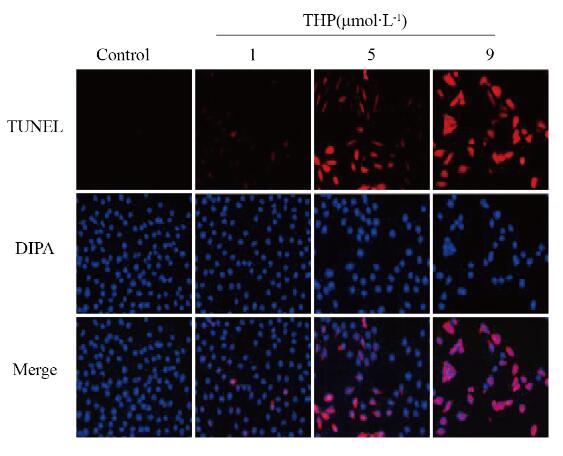
|
| 图 5 TUNEL法检测各组H9C2细胞凋亡率(× 100) Fig. 5 Apoptotic rates of H9C2 cells in various groups detected by TUNEL assay(× 100) |
|
|
与空白对照组比较,1、5和9 μmol·L-1 THP组细胞中Bax和Caspase-3 mRNA表达水平明显升高(P < 0.05),Bcl-2 mRNA表达水平明显降低(P < 0.05),1 μmol·L-1 THP组Caspase-9 mRNA表达水平差异无统计学意义(P > 0.05),5和9 μmol·L-1 THP组Caspase-9 mRNA表达水平明显升高(P < 0.01)。见表 3。
| (n=3, x±s) | |||||||||||||||||||||||||||||
| Group | Bax | Bcl-2 | Caspase-3 | Caspase-9 | |||||||||||||||||||||||||
| Blank control | 1 | 1 | 1 | 1 | |||||||||||||||||||||||||
| THP(μmol·L-1) | |||||||||||||||||||||||||||||
| 1 | 1.71±0.31* | 0.72±0.06* | 1.53±0.33* | 1.16±0.28 | |||||||||||||||||||||||||
| 5 | 3.59±0.62** | 0.50±0.12** | 3.14±0.37** | 3.51±0.19** | |||||||||||||||||||||||||
| 9 | 5.55±0.54** | 0.11±0.10** | 4.22±0.25** | 4.49±0.57** | |||||||||||||||||||||||||
| *P < 0.05, **P < 0.01 vs control blank group. | |||||||||||||||||||||||||||||
与空白对照组比较,1、5和9 μmol·L-1 THP组细胞中Bax、Cleaved Caspase-3和Cleaved Caspase-9蛋白表达水平明显升高(P < 0.01),Bcl-2蛋白表达水平明显降低(P < 0.05)。见图 6。
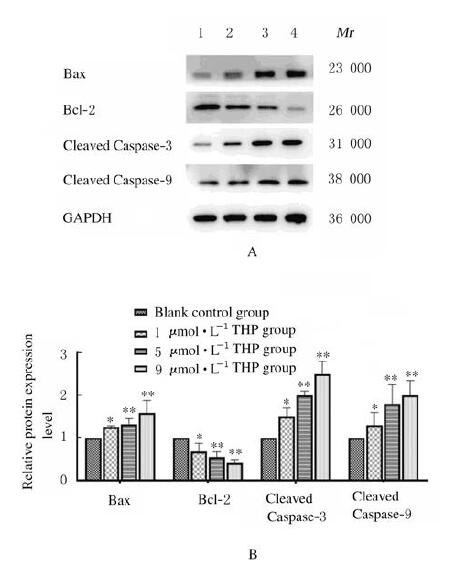
|
| Lane 1: Blank control group; Lane 2: 1 μmol·L-1 THP group; Lane 3: 5 μmol·L-1 THP group; Lane 4: 9 μmol·L-1 THP group. *P < 0.05, **P < 0.01 vs control group. 图 6 Western blotting法检测各组H9C2细胞中Bax、Bcl-2、Cleaved Caspase-3和Cleaved Caspase-9蛋白表达电泳图(A)和直条图(B) Fig. 6 Electrophoregram(A)and histogram(B)of expression levels of Bax, Bcl-2, Cleaved Caspase-3 and Cleaved Caspase-9 proteins in H9C2 cells in various groups determined by Western blotting method |
|
|
蒽环类药物引起的心脏毒性具有累积性和剂量依赖性。2011年中国临床肿瘤学会(CSCO)专家共识[6]指出:给予蒽环类药物6年后超过50%的患者可发生左心室组织和功能亚临床心脏超声变化。氧化应激是目前公认的蒽环类药物引起心脏损伤的机制[7]。蒽环类药物易聚集于心肌细胞的线粒体中,其醌基结构在代谢过程中可循环生成许多ROS,促使心肌细胞发生凋亡和坏死[8-12]。此外,蒽环类药物还可以螯合铁离子后触发氧自由基的生成,引起心肌细胞膜脂质过氧化和心肌线粒体DNA损伤[13-15]。另外,钙蓄积、心肌细胞凋亡的触发、神经调节蛋白生长因子1(neuregulin-1,NRG-1)/ErbB信号通路、腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)信号通路、β肾上腺素受体(β-adrenergic receptor,βAR)和Toll样受体(Toll-like receptors,TLRs)等也参与蒽环类药物相关心脏毒性发病机制[16]。
目前,蒽环类药物心脏毒性的预防和治疗尚缺乏令人满意的方法,是国内外的肿瘤心脏病学研究领域一个亟需解决的问题。以DOX制作实验性心肌损伤的细胞和动物模型为目前研究心脏毒性常用的途径与手段,这些模型制备方式因具有操作简单和费用低等特点而逐渐在基础研究中得到推广和应用[17]。但以DOX诱导细胞和实验动物心肌损伤模型会出现较高的死亡率,DOX诱导心肌损伤大鼠的死亡率高达30%以上,给研究造成了极大困扰[18]。并且,由于DOX的不良反应较为严重,临床上已经不再使用DOX作为肿瘤患者的一线化疗药物。因此,寻找一种诱导成功率高、细胞和动物实验的死亡率低且与临床上实际用药相结合的制备心肌损伤模型的方式为目前关注的重点。本研究采用的造模药物为THP,是一种蒽环类药物,其所致心脏毒性等不良反应少于其他蒽环类药物,在临床中应用较为广泛,具有较实际的研究价值。
本研究采用CCK-8法筛选出THP制备H9C2损伤模型的作用最佳时间(24 h)和浓度范围(1~10 μmol·L-1)。当THP浓度为1 μmol·L-1时,细胞的形态学改变,细胞中MDA水平,SOD和LDH活性,细胞凋亡率,细胞中Bax、Bcl-2、Caspase-3和Caspase-9 mRNA表达水平及Bax、Bcl-2、Cleaved caspase-3和Cleaved caspase-9蛋白表达水平变化不明显,提示THP浓度在低于1 μmol·L-1时引起H9C2损伤程度过低,达不到实验造模要求;随着给药浓度的升高,当THP浓度为9 μmol·L-1时,细胞损伤程度过重,细胞变形严重,全部凋亡甚至死亡,提示THP浓度过高也会对H9C2损伤模型制备造成影响,不符合实验造模要求。而THP浓度为5 μmol·L-1时,细胞形态趋于正常并未发生严重变形,细胞中ROS水平升高,细胞凋亡率为40%,各项指标也符合实验要求,若增加保护心肌细胞损伤的药物或方法等有益干预,能够达到改善H9C2造模后的损伤程度,可视为造模成功[19]。根据各实验组细胞形态学指标和细胞中MDA水平、SOD和LDH活性、细胞凋亡率、细胞内凋亡相关因子mRNA和蛋白表达水平等实验指标最终确定5 μmol·L-1 THP作为大鼠心肌细胞H9C2损伤模型的最佳造模药物浓度。
综上所述,本研究所确定的造模药物浓度和时间仅针对研究中所提及的细胞系和培养条件,但对其他类似的实验条件也具有参考价值。在选取心肌细胞损伤模型时,还需要根据实验室条件,模型药物试剂的安全性、可重复性、有效性以及细胞凋亡时间、细胞活力和实验细胞检测指标的时间等综合考虑,尽量避免模型中试剂所引起的干扰,根据实际情况,选择合适的实验模型。
| [1] |
YOU J S, GUO L, HUANG M, et al. The effect and mechanism of YH0618 granule on chemotherapy-induced hair loss in patients with breast cancer:study protocol for a randomized, double-blind, multi-center clinical trial[J]. Trials, 2019, 20(1): 719. |
| [2] |
SHARMA A V, REDDIN G, FORRESTAL B, et al. Cardiovascular disease risk in survivors of breast cancer[J]. Curr Treat Options Cardiovasc Med, 2019, 21(12): 79. DOI:10.1007/s11936-019-0788-2 |
| [3] |
LIU H, WANG H Y, XIANG D C, et al. Pharmaceutical measures to prevent doxorubicin-induced cardiotoxicity[J]. Mini Rev Med Chem, 2017, 17(1): 44-50. |
| [4] |
KOLEINI N, KARDAMI E. Autophagy and mitophagy in the context of doxorubicin-induced cardiotoxicity[J]. Oncotarget, 2017, 8(28): 46663-46680. DOI:10.18632/oncotarget.16944 |
| [5] |
马琴. 阿霉素诱导大鼠慢性心力衰竭模型的制备[J]. 生物化工, 2019(4): 100-103. |
| [6] |
胡夕春, 张剑, 陈德滇, 等. 中国蒽环类药物治疗乳腺癌专家共识[J]. 中国肿瘤临床, 2018, 45(3): 120-125. |
| [7] |
XIAO B, HONG L, CAI X Y, et al. The true colors of autophagy in doxorubicin-induced cardiotoxicity[J]. Oncol Lett, 2019, 18(3): 2165-2172. |
| [8] |
DEIDDA M, MERCURIO V, CUOMO A, et al. Metabolomic perspectives in antiblastic cardiotoxicity and cardioprotection[J]. Int J Mol Sci, 2019, 20(19): E4928. DOI:10.3390/ijms20194928 |
| [9] |
ALVAREZ-CARDONA J, LENIHAN D J. Anthracycline cardiotoxicity:It is possible to teach an old dog some new tricks[J]. Cardiol Clin, 2019, 37(4): 355-363. DOI:10.1016/j.ccl.2019.08.001 |
| [10] |
ZHAO L S, TAO X F, QI Y, et al. Protective effect of dioscin against doxorubicin-induced cardiotoxicity via adjusting microRNA-140-5p-mediated myocardial oxidative stress[J]. Redox Biol, 2018, 16: 189-198. DOI:10.1016/j.redox.2018.02.026 |
| [11] |
MEI S B, HONG L, CAI X Y, et al. Oxidative stress injury in doxorubicin-induced cardiotoxicity[J]. Toxicol Lett, 2019, 307: 41-48. DOI:10.1016/j.toxlet.2019.02.013 |
| [12] |
FERREIRA A, CUNHA-OLIVEIRA T, SIMÕES RF, et al. Altered mitochondrial epigenetics associated with subchronic doxorubicin cardiotoxicity[J]. Toxicology, 2017, 390: 63-73. DOI:10.1016/j.tox.2017.08.011 |
| [13] |
YIN J, GUO J B, ZHANG Q, et al. Doxorubicin-induced mitophagy and mitochondrial damage is associated with dysregulation of the PINK1/parkin pathway[J]. Toxicol In Vitro,, 2018, 51: 1-10. DOI:10.1016/j.tiv.2018.05.001 |
| [14] |
RÄSÄNEN M, DEGERMAN J, NISSINEN T A, et al. VEGF-B gene therapy inhibits doxorubicin-induced cardiotoxicity by endothelial protection[J]. Proc Natl Acad Sci U S A, 2016, 113(46): 13144-13149. DOI:10.1073/pnas.1616168113 |
| [15] |
RAZAVI-AZARKHIAVI K, IRANSHAHY M, SAHEBKAR A, et al. The protective role of phenolic compounds against doxorubicin-induced cardiotoxicity:A comprehensive review[J]. Nutr Cancer, 2016, 68(6): 892-917. DOI:10.1080/01635581.2016.1187280 |
| [16] |
黄鑫, 关旭敏, 杨晓蕾, 等. 蒽环类药物相关心脏毒性的发病机制[J]. 中国医学前沿杂志, 2017, 9(9): 15-19. |
| [17] |
KOLEINI N, NICKEL B E, EDEL A L, et al. Oxidized phospholipids in Doxorubicin-induced cardiotoxicity[J]. Chem Biol Interact, 2019, 303: 35-39. DOI:10.1016/j.cbi.2019.01.032 |
| [18] |
陈莉, 任越. 芪苈强心胶囊对阿霉素心衰大鼠心功能及心室重构的影响[J]. 陕西中医, 2016, 37(3): 368-369. |
| [19] |
WANG Y, ZHANG Y, REN L, et al. Rutin protects against pirarubicin-induced cardiotoxicity through TGF-β1-p38 MAPK signaling pathway[J]. Evid Based Complement Alternat Med, 2017, 2017: 1759385. |
 2020, Vol. 46
2020, Vol. 46


