扩展功能
文章信息
- 孙景春, 金辉, 杨雯棋, 徐辉
- SUN Jingchun, JIN Hui, YANG Wenqi, XU Hui
- 骨碎补总黄酮对骨质疏松大鼠骨组织中硬化蛋白表达的影响及其作用机制
- Effect of total flavonids of Rhizomadrynariae on sclerostin expression in bone tissue of osteoporosis rats and its mechanism
- 吉林大学学报(医学版), 2020, 46(05): 911-916
- Journal of Jilin University (Medicine Edition), 2020, 46(05): 911-916
- 10.13481/j.1671-587x.20200503
-
文章历史
- 收稿日期: 2020-02-09
2. 吉林大学中日联谊医院神经内三科, 吉林 长春 130033;
3. 吉林大学药学院再生医学科学研究所, 吉林 长春 130021
2. Department of Neurology, China-Japan Union Hospital, Jilin University, Changchun 130033, China;
3. Institute of Frontier Medical Sciences, School of Pharmacy, Jilin University, Changchun 130021, China
骨质疏松症是一种以骨微结构破坏、骨强度降低和易发生骨折为特征的全身性骨病,可发生于不同性别和年龄人群中,但多见于绝经后妇女和老年男性。2018年10月,国家卫健委发布的首个中国骨质疏松症流行病学调查[1]结果显示:骨质疏松症已经成为我国50岁以上人群的重要健康问题,从而造成沉重的家庭和社会经济负担。骨细胞是维持成熟骨新陈代谢的主要细胞,年轻的骨样骨细胞在调控骨生长和骨转换中非常重要,骨细胞通过调控骨转换在骨质疏松症的发生发展过程中扮演重要角色。骨细胞参与骨转换的作用途径主要是通过调控骨硬化蛋白(sclerostin,SOST)和核因子κB(nuclear factor-κB,NF-κB)受体激活剂配基(receptor activator of nuclear factor-κB ligand,RANKL)的产生[2]。SOST可以拮抗Wnt/β-连环蛋白(β-catenin)信号通路负性调节骨形成。SOST可通过结合骨形态发生蛋白受体和Wnt的共受体低密度脂蛋白受体相关蛋白5/6(LRP5/6),负向调节骨形态发生蛋白和Wnt信号途径来调控成骨细胞分化和骨形成。研究[3]表明:抑制SOST为骨质疏松症的治疗提供了新的途径。骨碎补总黄酮具有补益肝肾、活血止痛和强筋壮骨等功效。赵金龙等[4]通过系统药理学和相关生物信息学分析方法探讨中药材骨碎补治疗骨质疏松症的生物学通路及靶标。谢雁鸣等[5]研究结果显示:骨碎补总黄酮可通过提高原发性骨质疏松症患者的骨密度,抑制骨吸收,减少骨量丢失等环节实现对原发性骨质疏松症的治疗作用。本研究通过维甲酸诱导建立大鼠骨质疏松模型,应用骨碎补总黄酮对其进行用药干预,观察骨碎补总黄酮对骨细胞分泌SOST的影响,探讨骨碎补总黄酮对骨质疏松症的作用效果及其作用机制。
1 材料与方法 1.1 实验动物、主要试剂和仪器40只雌性Sprague-Dawley大鼠购于北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2016-0006;维甲酸购于上海阿拉丁生化科技股份有限公司,阿仑膦酸钠购于美国Sigma公司,骨碎补总黄酮(国药准字Z20030007)购于北京岐黄医药股份有限公司,TRIzol试剂购于美国Ambion公司,RIPA蛋白裂解液购于北京鼎国昌盛生物技术有限公司,SOST兔多克隆抗体(anti-sclerostin)购于美国Abcam公司,反转录试剂盒购于美国Thermo Scientific公司,基因引物由生工生物工程(上海)股份有限公司合成,荧光定量PCR试剂购于德国Roche公司;AU680全自动生化分析仪(美国Beckman Coulter公司),Quant Studio 7 Flex型StepOnePlus Real-Time PCR system(美国Thermo Fisher Scientific公司),VE-180型凝胶电泳仪和VE-186型转移电泳槽(上海天能科技有限公司)。
1.2 实验动物分组及骨质疏松模型制备将40只8月龄雌性大鼠分为正常对照组、骨质疏松模型组、阳性药组和骨碎补总黄酮组,每组10只。除正常对照组外,其余3组大鼠采用维甲酸灌胃给药方法制备骨质疏松模型。正常对照组大鼠每天采用等量生理盐水灌胃;骨质疏松模型组大鼠以90 mg·kg-1·d-1维甲酸灌胃给药,持续14 d;阳性药组大鼠以维甲酸灌胃14 d,同时皮下注射0.1 mg·kg-1·d-1阿仑膦酸钠30 d;骨碎补总黄酮组大鼠以维甲酸灌胃14 d,同时以58 mg·kg-1·d-1骨碎补总黄酮灌胃给药30 d。在实验过程中,各组大鼠均自由活动和摄食饮水,对大鼠的体质量和体征进行观察并记录,实验周期为30 d。
1.3 各组大鼠血清中生化指标检测给药结束后采用乙醚麻醉大鼠,以眼眶静脉丛取血。血液离心后收集上清,采用全自动生化分析仪检测大鼠血清中钙、磷和碱性磷酸酶(alkaline phosphatase,ALP)水平,肝和肾功能指标,包括丙氨酸氨基转移酶(alanine aminotransferase,ALT)、门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、肌酐(creatinine,Crea)和尿素氮(blood urea nitroger,BUN)。
1.4 各组大鼠骨组织HE染色给药结束后采用乙醚麻醉大鼠,收集大鼠两侧股骨,取大鼠一侧股骨进行甲醛固定,HE染色,观察大鼠股骨干骺端骨组织病理形态表现。
1.5 qRT-PCR法检测大鼠骨组织中SOSTmRNA表达水平取大鼠另一侧股骨和胫骨经液氮研磨成粉末,采用TRIzol试剂抽提骨组织的总RNA,用反转录试剂盒Revert Aid First Strand cDNA Synthesis kit进行反转录。采用StepOnePlus Real-Time PCR system进行扩增特异性SOST的基因片段。反应体系(20 µL):荧光定量PCR试剂Fast Start Universal SYBR Green Master (Rox) 10 µL,正、反向引物各2 µL,模板0.5 µL,双蒸水5.5 µL。引物序列:SOST,上游引物5'-GCTCTCCACAGCAACGAAGG-3',下游引物5'-TGCAGCTCTCACTAGCCCCT-3';GAPDH,上游引物5'-CCCCCAATGTATCCGTTGTG-3',下游引物5'-TAGCCCAGGATGCCCTTTAGT-3'。反应条件:95℃预变性30 s,95℃变性15 s,60℃退火30 s,72℃延伸30 s,共40个循环。以GAPDH作为内参,每个样本设3个复孔,以样品的2-△△Ct值(Ct为循环数)代表SOST mRNA表达水平。
1.6 Western blotting法检测各组大鼠骨组织中SOST蛋白表达水平取“1.5”中的部分大鼠股骨和胫骨经液氮研磨成粉状,将适宜浓度的骨组织样本与上样缓冲液按照一定比例混合,95℃变性5 min后,将变性的样本按照顺序和剂量加入凝胶,在恒压条件下进行电泳。电泳结束后,用PVDF膜与凝胶的分离胶部分贴好转膜。转膜结束,PVDF膜用5%脱脂牛奶封闭后,与SOST抗体(1:1 000)孵育过夜。孵育后的PVDF膜用TBST液体洗3次,再将PVDF膜浸于二抗goat anti-rabbit抗体(1:10 000)摇床孵育85 min。最后,PVDF膜加入发光液,在暗室内进行胶片显影。以β-actin作为参照物,采用Gel-Pro analyzer软件进行蛋白条带吸光度(A)值分析,以目的蛋白条带A值与内参β-actin条带A值的比值作为目的蛋白相对表达水平。
1.7 统计学分析采用SPSS 20.0统计软件进行统计学分析。各组大鼠血清中各生化指标及骨组织中SOST mRNA和蛋白表达水平经正态性检验均符合正态分布,以¯x± s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD和DUNCAN法。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠血清中钙、磷和ALP水平与正常对照组比较,骨质疏松模型组大鼠血清中磷和ALP水平稍有升高,但差异无统计学意义(P > 0.05);与骨质疏松模型组比较,阳性药组大鼠血清中钙和磷水平明显降低(P < 0.01),而骨碎补总黄酮组大鼠血清中钙水平明显升高(P < 0.05);与阳性药组比较,骨碎补总黄酮组大鼠血清中钙、磷和ALP水平明显升高(P < 0.05或P < 0.01)。见表 1。
| (n=8, x±s) | |||||||||||||||||||||||||||||
| Group | Ca[cB/(mmol·L-1)] | Pi[cB/(mmol·L-1)] | ALP[λB/(IU·L-1)] | ||||||||||||||||||||||||||
| Normal control | 2.66±0.06 | 2.03±0.11 | 37.01±2.30 | ||||||||||||||||||||||||||
| Osteoporosis model | 2.60±0.04 | 2.11±0.06 | 45.17±5.44 | ||||||||||||||||||||||||||
| Positive drug | 2.44±0.04*△ | 1.59±0.07*△△ | 35.38±5.02 | ||||||||||||||||||||||||||
| Total flavonoids of Rhizomadrynariae | 2.66±0.05*# | 2.15±0.04## | 45.67±5.62# | ||||||||||||||||||||||||||
| *P < 0.05 compared with normal control group; △ P < 0.05, △△ P < 0.01 compared with osteoporosis model group; # P < 0.05, ## P < 0.01 compared with positive drug group. | |||||||||||||||||||||||||||||
各组大鼠血清中ALT、AST和BUN水平比较差异均无统计学意义(P > 0.05)。与正常对照组比较,骨质疏松模型组、阳性药组和骨碎补总黄酮组大鼠血清中Crea水平明显降低(P < 0.01);与模型组和阳性药组比较,骨碎补总黄酮组大鼠血清中Crea水平明显降低(P < 0.01)。见表 2。
| (n=8,x±s) | |||||||||||||||||||||||||||||
| Groups | ALT[λB/(IU·L-1)] | AST[λB/(IU·L-1)] | Crea[cB/(μmol·L-1)] | BUN[cB/(mmol·L-1)] | |||||||||||||||||||||||||
| Normal control | 44.29 ± 3.72 | 158.00±8.48 | 44.64±1.49 | 6.07±0.30 | |||||||||||||||||||||||||
| Osteoporosis model | 46.00±6.05 | 156.33±8.70 | 38.70±1.12* | 5.72±0.37 | |||||||||||||||||||||||||
| Positive drug | 53.75±12.33 | 195.88±35.41 | 39.58±0.97* | 6.33±0.46 | |||||||||||||||||||||||||
| Total flavonoids of Rhizomadrynariae | 44.33±6.25 | 141.17±11.80 | 33.87±1.20*△# | 5.47±0.27 | |||||||||||||||||||||||||
| *P < 0.05 compared with normal control group; △P < 0.05 compared with osteoporosis model group; #P < 0.05 compared with positive drug group. | |||||||||||||||||||||||||||||
正常对照组大鼠股骨干骺端骨小梁较多较厚,无明显吸收或断裂现象;骨质疏松模型组大鼠股骨干骺端骨小梁变薄,排列稀疏,骨髓腔变大,可见明显的类骨质堆积,表明骨质疏松大鼠模型制备成功;与骨质疏松模型组比较,阳性药组大鼠股骨干骺端骨小梁厚度明显增加,仍可见少量断裂和类骨质堆积;骨碎补总黄酮组大鼠股骨干骺端骨小梁较模型组的连续性好,断裂少,骨小梁厚度也增加,类骨质堆积较不明显。见图 1(插页一)。
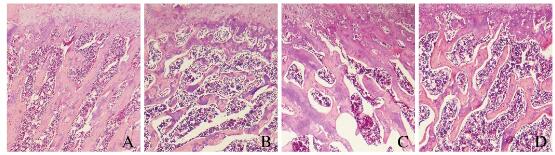
|
| A: Normal control group; B: Ostcoporosis model group; C: Positive drug group; D: Total flavonoids of Rhizomadrynariae group. 图 1 各组大鼠股骨干骺端组织病理形态表现(HE,X40) Fig. 1 Pathomorphology of femoral metaphysis tissue of rats in various groups(HE, X 40)(seen on page 914 in paragraph) |
|
|
mRNA和蛋白表达水平与正常对照组比较,阳性药组和骨碎补总黄酮组大鼠骨组织SOST mRNA表达水平明显降低(P < 0.01),骨质疏松模型组大鼠骨组织中SOST mRNA表达水平升高(P < 0.05);与骨质疏松模型组比较,阳性药组和骨碎补总黄酮组大鼠骨组织中SOST mRNA表达水平均明显降低(P < 0.01)。阳性药组大鼠骨组织中SOST蛋白表达水平较正常对照组和骨质疏松模型组均明显降低(P < 0.01),骨碎补总黄酮组大鼠骨组织中SOST蛋白表达水平虽较正常对照组和骨质疏松模型组低,但差异无统计学意义(P > 0.05)。见图 2和表 3。
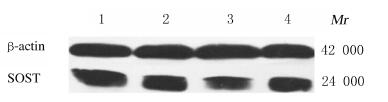
|
| Lane 1:Normal control group; Lane 2:Osteoporosis model group; Lane 3 : Positive drug group; Lane 4 : Total flavonoids of Rhizomadrynariae group. 图 2 各组大鼠骨组织中SOST蛋白表达电泳图 Fig. 2 Electrophoregram of expressions of SOST protein in bone tissue of rats in various groups |
|
|
| (n=8, x±s) | |||||||||||||||||||||||||||||
| Group | SOST mRNA |
SOST protein |
|||||||||||||||||||||||||||
| Normal control | 1.15±0.08 | 3.76±0.21 | |||||||||||||||||||||||||||
| Osteoporosis model | 1.31±0.10 | 3.49±0.23 | |||||||||||||||||||||||||||
| Positive drug | 0.63±0.11*△ | 1.98±0.19*△ | |||||||||||||||||||||||||||
| Total flavonoids of Rhizomadrynariae | 0.75±0.13*△ | 2.80±0.02 | |||||||||||||||||||||||||||
| *P < 0.01 compared with normal control group; △P < 0.01 compared with osteoporosis model group. | |||||||||||||||||||||||||||||
随着老龄化人口的逐渐增加,骨质疏松症作为衰老人群的常见病症之一,现已成为研究热点[6-7],骨质疏松症主要是以骨量减少、骨组织微观结构退化为特征,导致骨的脆性增加,易发生骨折。目前,骨质疏松症的发病机制尚不完全清楚,临床治疗药物也存在耐药和不良反应的问题[8-9]。
骨质疏松症研究的常用实验动物模型为雌性动物切除卵巢造成雌激素缺乏,成骨降低,破骨不受抑制;也有大剂量地塞米松引起的活跃破骨型的骨质疏松,以及相类似的大剂量维甲酸诱发骨质疏松症等模型[10-12]。本研究采用维甲酸灌胃法制备大鼠骨质疏松动物模型,是基于维甲酸增强破骨细胞活性,刺激骨吸收,造成骨转换加强而引起骨质疏松。在本研究中使用阿仑膦酸钠作为阳性药,不仅因为该药应用于抗骨质疏松临床治疗多年,而且该药的药效机制是抑制破骨细胞的骨吸收,符合维甲酸复制骨质疏松动物模型的特点。贾婷婷等[13]研究显示:采用维甲酸制备的骨质疏松模型大鼠的胫骨骺端可观察到皮质骨面积降低,骨小梁变窄且稀疏,呈松散状态,数目减少,骨小梁分离度增加;正常对照组大鼠皮质骨面积正常,骨小梁密集,间距小,交织连续呈网状。本研究结果显示:在骨质疏松大鼠股骨干骺端也观察到了骨小梁变薄、排列稀疏、断裂明显和骨髓腔变大,表明维甲酸已导致大鼠骨质疏松;阳性药组和骨碎补总黄酮组大鼠干骺端的骨小梁厚度增加,骨小梁断裂减少,再次证明了骨碎补总黄酮在治疗骨质疏松方面的药用价值[14]。
在本研究中也观察了骨碎补总黄酮对骨质疏松大鼠骨代谢和肝肾功能指标的影响,结果表明:阿仑膦酸钠能够抑制骨吸收,从而降低大鼠血清中钙和磷水平。而骨碎补总黄酮能提高ALP的酶活性,反映了骨碎补总黄酮刺激成骨作用的潜能。研究[15]表明:骨碎补提取物治疗去势大鼠,能够通过调节内皮素1和血管内皮生长因子水平,改善骨代谢,较低剂量骨碎补提取物对提高骨密度起到促进作用,高剂量时效果更为明显。本研究通过对大鼠肝肾功能指标的分析表明:维甲酸制备骨质疏松模型对大鼠的肝肾功能影响轻微,骨碎补总黄酮无明显的肝肾不良反应。
本研究利用分子生物学技术分析了给予骨碎补总黄酮后骨质疏松大鼠骨组织中SOST的表达情况。SOST作为骨细胞的标志物之一,是骨形成的负性调节因子,也可以通过刺激骨细胞从而调控破骨细胞的形成和活性,还可以调控骨的矿化来调节骨结构的改变[16]。甲状旁腺激素和雌激素可抑制SOST基因表达,转录因子Osterix、Runx2和Mef2c可促进SOST基因表达,而沉默信号调节因子1(silent information regulator 1,Sirt1)负调控SOST基因表达[17]。SOST单克隆抗体目前正被广泛应用于骨质疏松和骨折不愈合的基础与临床研究领域。其中,Evenity(romosozumab)是2019年美国食品药品管理局(FDA)批准的治疗骨质疏松的单克隆抗体新药[18]。因此,SOST在骨质疏松防治方面具有重要的应用价值。本研究结果显示:骨质疏松模型大鼠骨组织中SOST表达水平升高,而阿仑膦酸钠和骨碎补总黄酮可明显抑制骨组织中SOST mRNA的表达,骨碎补总黄酮组大鼠骨组织中SOST蛋白表达水平降低,提示骨碎补总黄酮能够抑制骨细胞产生SOST。骨碎补总黄酮通过抑制SOST而促进成骨,抑制破骨,达到治疗骨质疏松症的目的[19-21]。
综上所述,骨碎补总黄酮拮抗原发性骨质疏松症的作用机制可能是通过抑制骨细胞合成SOST,刺激成骨细胞活性,抑制破骨因子,进而发挥促进骨组织形成的作用。但骨碎补总黄酮作为一种混合物,目前仍不能确定其发挥作用的主要活性成分,需进一步深入研究。
| [1] |
国家卫生健康委员会官网. 国家卫生健康委发布首个中国骨质疏松症流行病学调查结果[J]. 人口文摘, 2018(11): 55-56. |
| [2] |
RHEE Y, ALLEN M R, CONDON K, et al. PTH receptor signaling in osteocytes governs periosteal bone formation and intracortical remodeling[J]. J Bone Miner Res, 2011, 26(5): 1035-1046. DOI:10.1002/jbmr.304 |
| [3] |
SINGH A, GUPTA M K, MISHRA S P. Study of correlation of level of expression of Wnt signaling pathway inhibitors sclerostin and dickkopf-1 with disease activity and severity in rheumatoid arthritis patients[J]. Drug Discov Ther, 2019, 13(1): 22-27. DOI:10.5582/ddt.2019.01011 |
| [4] |
赵金龙, 曾令烽, 赵第, 等. 基于系统药理学的骨碎补治疗骨质疏松的通路及靶标探讨[J]. 天津中医药, 2019, 36(11): 1126-1132. |
| [5] |
谢雁鸣, 马海波. 强骨胶囊治疗原发性骨质疏松症(肾阳虚证)的临床研究[J]. 中药新药与临床药理, 2000, 11(4): 197-201. |
| [6] |
洪维, 郑松柏, 李慧林, 等. 骨折风险评估工具FRAX-评分判定上海社区老年人群实际骨质疏松性椎体骨折(OVF)效用的研究[J]. 复旦学报(医学版), 2020, 47(1): 83-88, 100. |
| [7] |
赵明月, 高永红. 老年糖尿病患者饮食对骨质疏松症发生的影响[J]. 中国现代医药杂志, 2020, 22(2): 47-49. |
| [8] |
毛哲渊, 周中. 骨质疏松症临床治疗的研究进展[J]. 山东医药, 2019, 59(31): 110-113. |
| [9] |
郜振武, 吴斗, 高敏, 等. 骨质疏松性骨折的药物治疗策略与选择[J]. 中华老年骨科与康复电子杂志, 2018, 4(5): 317-320. |
| [10] |
许东亮, 彭朝晖, 熊美才. 姜黄素对骨质疏松大鼠种植体骨结合的促进作用[J]. 吉林大学学报(医学版), 2019, 45(4): 877-881, 987. |
| [11] |
朱刚, 孙海斌, 徐刚. 肉苁蓉醇提物对去卵巢骨质疏松大鼠的治疗作用及其机制[J]. 吉林大学学报(医学版), 2018, 44(1): 68-72, 207. |
| [12] |
卢锦东, 谢平金. 骨质疏松大鼠造模法研究进展[J]. 辽宁中医药大学学报, 2015, 17(5): 248-251. |
| [13] |
贾婷婷, 张云涛, 刘顺振, 等. 维甲酸诱导大鼠骨质疏松模型的制作[J]. 口腔医学研究, 2012, 28(5): 420-422. |
| [14] |
张峻玮, 陈玲玲, 李琰, 等. 骨碎补对去卵巢大鼠骨微结构的保护作用[J]. 山东科学, 2020, 33(1): 35-41. |
| [15] |
李建民, 王雷鸣. 骨碎补提取物对去卵巢骨质疏松大鼠血清学指标及疗效的影响研究[J]. 新中医, 2019, 51(9): 5-8. |
| [16] |
SPATZ J M, WEIN M N, GOOI J H, et al. The wnt inhibitor sclerostin is up-regulated by mechanical unloading in osteocytes in vitro[J]. J Biol Chem, 2015, 290(27): 16744-16758. DOI:10.1074/jbc.M114.628313 |
| [17] |
秦龙娟, 丁达霞, 崔璐璐, 等. SOST基因的表达调控[J]. 遗传, 2013, 35(8): 939-947. |
| [18] |
Romosozumab (Evenity) for postmenopausal osteoporosis [J]. Med Lett Drugs Ther, 2019, 61(1573): 83-86[J]. Med Lett Drugs Ther, 2019, 61(1573): 83-86. |
| [19] |
曾辉, 赵许兵, 唐成芳, 等. 骨碎补总黄酮对去卵巢大鼠下颌骨结构、血清E_2及OPG/RANKL的影响[J]. 西安交通大学学报(医学版), 2019, 40(2): 328-332. DOI:10.3969/j.issn.1672-2353.2011.09.002 |
| [20] |
宋双红, 余倩, 王喆之, 等. 骨碎补防治骨质疏松研究概况[J]. 生命的化学, 2015, 35(1): 73-80. |
| [21] |
招文华, 沈耿杨, 任辉, 等. 骨碎补活性单体成分调控骨质疏松症相关信号通路的研究进展[J]. 中国骨质疏松杂志, 2017, 23(1): 122-129, 140. |
 2020, Vol. 46
2020, Vol. 46


