扩展功能
文章信息
- 杨泽斌, 王明月, 陈丽, 刘宁, 王浩, 崔梅英, 方楷漪, 夏薇, 关新刚
- YANG Zebin, WANG Mingyue, CHEN Li, LIU Ning, WANG Hao, CUI Meiying, FANG Kaiyi, XIA Wei, GUAN Xingang
- 载阿霉素细胞膜纳米囊泡对黑色素瘤B16F10细胞的杀伤效应
- Killing effect of doxorubicin-loaded cell membrane nanovesicles on melanoma B16F10 cells
- 吉林大学学报(医学版), 2020, 46(05): 905-910
- Journal of Jilin University (Medicine Edition), 2020, 46(05): 905-910
- 10.13481/j.1671-587x.20200502
-
文章历史
- 收稿日期: 2020-02-11
阿霉素(doxorubicin,DOX),又称多柔比星,是一种具有广谱抗肿瘤活性的蒽环类抗生素,广泛应用于乳腺癌、胃癌、肝癌、宫颈癌、胆管癌和前列腺癌等实体瘤及多种血液系统恶性肿瘤的治疗。尽管在多种肿瘤中显现出良好的治疗效果,但DOX用药过程中产生的心脏毒性及骨髓抑制等严重不良反应限制了其在临床上的进一步应用[1]。提高DOX的靶向肿瘤输送效率并降低对正常组织的不良反应成为改善治疗效果的关键。近年来,基于纳米颗粒的药物递送系统引起了广泛关注[2],与游离小分子药物比较,纳米药物递送系统具有药物代谢时间延长、肝肾组织吸收降低、高通透性和滞留(EPR)效应[3-5]等优势。多项研究[6-8]显示:利用细胞膜为原材料制备的纳米囊泡具有极佳的生物相容性,可作为一种高效安全的药物递送系统用于抗肿瘤研究。细胞膜纳米囊泡担载紫杉醇(paclitaxel,PTX)用于恶性胶质母细胞瘤治疗,与小分子PTX比较,纳米药物能明显延长药物的体内循环时间并减轻不良反应[9];此外,利用膜囊泡作为siRNA递送载体,能够改善siRNA在血液中的快速降解,明显抑制c-Myc基因表达[10]。本研究利用人胚肾细胞HEK293T的细胞膜制备一种细胞膜纳米囊泡(nanovesicle,NVs),通过电穿孔法将DOX担载于囊泡内腔,得到新型阿霉素纳米药物NVs-DOX,探讨纳米药物NVs-DOX对黑色素瘤B16F10细胞的内吞作用及杀伤效应,为开发高效低毒的新型抗癌药提供参考。
1 材料与方法 1.1 细胞、主要试剂和仪器小鼠黑色素瘤B16F10细胞、人胚胎肾细胞HEK293和小鼠胚胎成纤维细胞NIH3T3由本实验室保存。DOX、MTT、PMSF、DAPIT和BCA蛋白定量试剂盒购于碧云天生物技术公司,二甲基亚砜(DMSO)、DMEM和胎牛血清(FBS)购于生工生物工程(上海)股份有限公司,活/死细胞活力检测试剂盒购于凯基生物。纳米粒度及Zeta电位分析仪Microtrac Nanotrac Wave Ⅱ(美国麦奇克有限公司),LF10脂质体挤出仪(加拿大AVESTIN公司),M200多功能酶标仪(瑞士TECAN公司),CUY21EDIT Ⅱ细胞电转化仪(日本BEX公司),紫外分光光度计(上海仪电INESA有限公司),ACEA NovoCyte序列流式细胞仪和倒置荧光显微镜(美国Lifte-Technologies公司)。
1.2 细胞培养细胞在37℃、5%CO2培养箱孵育,用含10%FBS和1%双抗混合液(penicillin-streptomycin solution)的DMEM培养基培养。
1.3 细胞膜NVs制备将对数生长期的HEK293T细胞进行消化后,离心收集细胞沉淀用PBS缓冲液洗涤3次(1 500 r·min-1,5 min),使用HM培养基(1 mmol·L-1 EDTA、20 mmol·L-1 Hepes-NaOH、pH7.4、1 mmol·L-1 PMSF)进行重悬,冰上使用匀浆器挤压50次,1 500 r·min-1离心10 min,收集上清超高速离心(35 000 r·min-1,2 h)收集沉淀,PBS缓冲液重悬3次后顺序通过装有1 μm和0.4 μm滤膜的挤出仪挤压20次,得到细胞膜NVs,利用BCA蛋白定量试剂盒检测囊泡中蛋白浓度,细胞膜NVs浓度以蛋白浓度(mg·L-1)表示。使用Microtrac Nanotrac Wave Ⅱ检测NVs的粒径分布。
1.4 MTT法分析NVs的细胞相容性取对数生长期小鼠胚胎成纤维细胞NIH3T3,消化后接种于96孔细胞培养板,37℃、5%CO2培养箱孵育24 h后每孔加入终浓度分别为0、5、10、20、50和100 mg·L-1(蛋白浓度)的NVs,37℃、5%CO2培养箱培养48 h后每孔加入20 μL MTT(5 g·L-1)溶液,继续培养4 h后弃去孔中溶液,加入150 μL DMSO,震荡1 min后检测490 nm处吸光度(A)值并计算细胞存活率。细胞存活率=NVs组A值/空白组A值×100%。
1.5 纳米药物NVs-DOX的制备利用电转法将DOX担载于细胞膜内腔:CUY21EDIT Ⅱ细胞电转化仪电击杯(内径尺寸为0.4 cm)加入细胞膜NVs与DOX(质量比为2:1),电转条件为PPV:200 V,On:10 ms,Off:10 ms,PdV:25 V,On:50 ms,Off:50 ms,C:940 μF,Cycle:10。冰上孵育30 min,35 000 r·min-1超高速离心2 h后将沉淀重悬于PBS缓冲液,得到NVs-DOX;孵育方法装载DOX,将细胞膜与DOX(质量比2:1)37℃孵育2 h,PBS缓冲液洗涤3次后重悬,利用DOX在485 nm吸光度(A)值绘制标准曲线,对上述2种方法制备的纳米药物DOX浓度进行定量。使用Microtrac Nanotrac Wave Ⅱ测定NVs-DOX的粒径分布。
1.6 激光共聚焦成像检测细胞中荧光分布将对数生长期的黑色素瘤B16F10细胞消化后,接种于24孔细胞培养板中,37℃、5%CO2培养箱孵育12 h后,分别加入10 mg·L-1(DOX浓度)的小分子DOX或NVs-DOX,37℃孵育3 h弃去孔中培养液,PBS缓冲液清洗3次后4%多聚甲醛37℃固定20 min,PBS缓冲液清洗3次后DAPI室温染色10 min,PBS缓冲液清洗3次后封片于荧光显微镜(Zeiss)下成像。采用Image J软件分析图片荧光强度。
1.7 流式细胞术检测细胞中荧光强度将B16F10细胞接种于6孔细胞培养板中,每孔1.8×105个细胞,37℃、5%CO2培养箱孵育24 h后,分别加入10 mg·L-1 (DOX浓度)的小分子DOX或NVs-DOX,37℃孵育3 h后胰蛋白酶消化,1 500 r·min-1离心5 min,收集细胞沉淀,PBS缓冲液清洗3次后加入500 μL PBS缓冲液轻轻混匀重悬,采用流式细胞仪检测并分析B16F10细胞内吞后的荧光强度。
1.8 MTT法检测NVs-DOX作用后B16F10细胞存活率取对数生长期的小鼠黑色素瘤B16F10细胞,接种于96孔细胞培养板中,每孔1×104个细胞,37℃、5%CO2培养箱孵育24 h后,实验组每孔加入100 μL NVs-DOX,药物终浓度分别为0.001、0.005、0.010、0.050、0.100、0.500和1.000 μmol·L-1,对照组加入相同终浓度的游离DOX,每组设置5个重复孔,37℃、5%CO2培养箱培养48 h。弃上清,加入20 μL MTT (5 g·L-1),37℃、5%CO2孵育4 h。弃上清,每孔加入150 μL DMSO,使用全波长多功能自动酶标仪检测490 nm处A值,计算细胞存活率。细胞存活率=药物处理组A值/空白对照组A值×100%。
1.9 活/死细胞染色检测NVs-DOX对B16F10细胞的毒性取对数生长期的黑色素瘤B16F10细胞,接种于96孔细胞培养板中,每孔1×104个细胞,37℃、5%CO2培养箱孵育24 h后,分别加入含有1 μmol·L-1 DOX的小分子DOX及NVs-DOXs,37℃、5%CO2培养箱培养24 h,弃去培养基后PBS缓冲液冲洗2次,加入活/死细胞活力检测试剂盒进行染色,荧光显微镜成像,使用Image J软件分析数据。计算各组死细胞占总细胞比率。
1.10 统计学分析采用Graphpad Prism 5.0统计软件进行统计学分析。各组细胞存活率、载药效率、荧光强度和死细胞占总细胞比率经正态分布检验均呈正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,2组间样本均数比较采用两独立样本t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 细胞膜NVs的制备通过超速离心法得到HEK293细胞的细胞膜,脂质体挤出仪处理后得到细胞膜NVs,动态光散射检测结果显示:NVs平均粒径为254.3 nm(图 1)。MTT法检测结果显示:随着NVs浓度逐渐增加,NVs不仅未显示出细胞毒性,而且在一定程度上促进了NIH3T3细胞的增殖(细胞存活率 > 120%)(表 1),显示出良好的生物相容性。
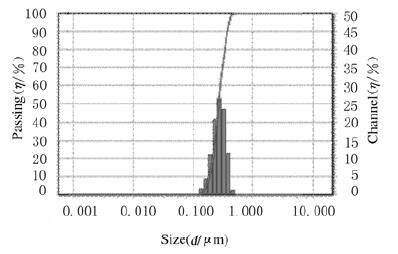
|
| 图 1 细胞膜NVs的粒径分布 Fig. 1 Size distribution of cell membrane NVs |
|
|
| (n=5, x±s, η/%)NVs(mg·L-1) | |||||||||||||||||||||||||||||
| NVs(mg·L-1) | NIH3T3 cell viability | ||||||||||||||||||||||||||||
| 5 | 103.60±4.97 | ||||||||||||||||||||||||||||
| 10 | 108.60±7.33 | ||||||||||||||||||||||||||||
| 20 | 114.20±3.29 | ||||||||||||||||||||||||||||
| 50 | 125.40±3.09 | ||||||||||||||||||||||||||||
| 100 | 125.60±10.48 | ||||||||||||||||||||||||||||
动态光散射检测结果显示:装载DOX后的NVs平均粒径为289.6 nm(图 2),较空NVs粒径(254.3 nm)略大。电转法DOX担载效率(24.91%±2.26%)高于孵育法(15.10%±0.73%,P < 0.05),与参考文献[11]报道一致,因此在后续研究中均采用电转法进行药物担载。
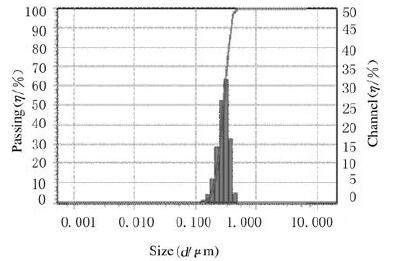
|
| 图 2 纳米药物NVs-DOX的粒径分布 Fig. 2 Size distribution of NVs-DOX |
|
|
荧光成像检测结果显示:药物孵育3 h后小分子DOX和纳米药物NVs-DOX均可以快速进入胞内,主要分布在细胞核中(图 3,见插页一);荧光定量分析显示:小分子DOX组细胞的荧光强度(38.81±1.58)高于NVs-DOX组(30.20±3.81)(P < 0.05)。流式细胞术检测结果显示:小分子DOX细胞内吞效率(95.47%±1.32%)高于NVs-DOX组(91.07%±0.42%),与荧光成像结果一致,见图 4。
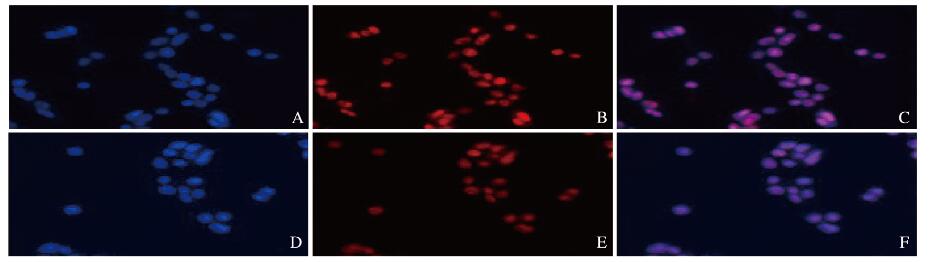
|
| A-C:Free DOX group; D-F:NVs DOX group; A, D: DAPI; B, E: D0X;C, F: Merge. 图 3 激光共聚焦成像检测NVsDOX的黑色索瘤细胞内吞(免疫荧光, Bar=20pμm) Fig. 3 Endocytosis of NVs-D0X melanoma cells detected by laser conlocal imaging(Immunofluorescence, Bar= 20 μm)(seen on page 908 in paragraph) |
|
|
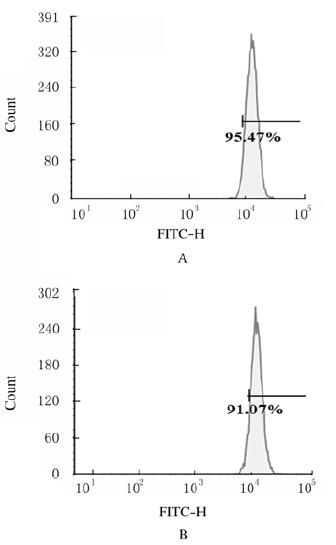
|
| A:Free DOX; B:Nvs-DOX. 图 4 流式细胞术检测NVs-DOX的黑色素瘤B16F10细胞内吞 Fig. 4 Endocytosis of melanoma B16F10 cells of NVs-DOX detected by flow cytometry |
|
|
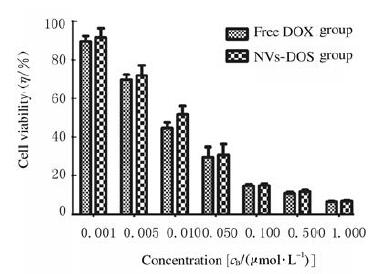
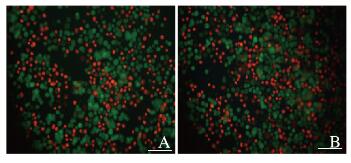
MTT法检测结果显示:随着药物浓度增加,小分子DOX和NVs-DOX处理的细胞存活率均逐渐降低;不同浓度NVs-DOX组细胞存活率与相对应浓度小分子DOX组比较差异无统计学意义(P > 0.05)(图 5)。活/死细胞染色法检测结果显示:处理24 h后小分子DOX组与NVs-DOX组死细胞占总细胞比率分别为(41.14±3.13)%和(43.38±5.41)%(图 6,见插页一),2组间比较差异无统计学意义(P > 0.05)。
|
| 图 5 MTT法检测各组黑色素瘤B16F10细胞存活率 Fig. 5 Survival rates of melanoma B16F10 cells in various groups detected by MTT method |
|
|
|
| A:Free Dox group;B:NVs-Dox group. 图 6 活/死细胞染色法检测NVs-DOX对B16F10细胞的杀伤效果(Bar= 100 μm) Fig. 6 Killing effect of NVs-DOX on B16F10. melanoma cells detected by Live/dead cell staining assay( Bar= 100 μm)(seen on page 908 in paragraph) |
|
|
晚期黑色素瘤由于高侵袭性和强转移性,其临床治疗仍是一个亟待解决的难题[12]。降低DOX的严重不良反应成为影响治疗效果的关键问题[13]。近年来基于纳米颗粒的药物递送系统取得了重要进展,已开发出脂质体纳米粒、纳米胶束、纳米囊泡、金纳米颗粒和介孔纳米硅球等载药体系用于靶向肿瘤递送DOX研究[14-19]。然而药物载体在体内的代谢去向及安全性仍是不容忽视的问题。
细胞膜来源的NVs由于其独特的材料特性在药物输送领域引起了广泛关注[20]。研究[21]显示:利用细胞膜制备的NVs担载姜黄素不仅能够改善姜黄素药物溶解度差的问题,还能延长姜黄素的体内循环时间,取得了较游离药物更好的治疗效果。细胞膜NVs作为药物递送载体可以降低肝肾组织对药物的清除,从而降低药物对正常组织的不良反应[11, 22-23]。由于胚胎肾细胞分化程度较低,基本不表达胞外配体所对应的受体分子,因而具有较低的免疫原性,因此本研究采用人胚肾HEK293细胞的细胞膜作为原材料制备NVs,利用其担载并递送DOX用于抗黑色素瘤细胞的研究。本研究结果表明:NVs与NIH3T3细胞具有良好的生物相容性;短时间(3 h)内纳米药物NVs-DOX内吞效率略低于小分子DOX,与其通过自由扩散的方式快速入胞有关,纳米药物主要以内吞方式进入胞内,速度较自由扩散稍慢;但48 h处理结果显示:纳米药物NVs-DOX具有与小分子DOX相当的肿瘤细胞毒性,提示纳米药物NVs-DOX具有高效杀伤黑色素瘤B16F10细胞的特性。
综上所述,本研究成功制备了基于细胞膜NVs的纳米药物NVs-DOX,细胞膜NVs在成纤维细胞上显示出良好的生物相容性,纳米药物NVs-DOX可被黑色素瘤B16F10细胞高效内吞并展示出与小分子DOX相当的肿瘤细胞杀伤效应。本研究为开发高效低毒的新型抗癌药提供了新思路。
| [1] |
时长淮. 阿霉素毒副作用机制及其防治研究进展[J]. 实用临床医药杂志, 2013, 17(3): 107-110. |
| [2] |
SILVA V L, AL-JAMAL W T. Exploiting the cancer niche:Tumor-associated macrophages and hypoxia as promising synergistic targets for nano-based therapy[J]. J Control Release, 2017, 253: 82-96. DOI:10.1016/j.jconrel.2017.03.013 |
| [3] |
SHI J J, KANTOFF P W, WOOSTER R, et al. Cancer nanomedicine:progress, challenges and opportunities[J]. Nat Rev Cancer, 2017, 17(1): 20-37. DOI:10.1038/nrc.2016.108 |
| [4] |
LUK B T, ZHANG L F. Cell membrane-camouflaged nanoparticles for drug delivery[J]. J Control Release, 2015, 220(Pt B): 600-607. |
| [5] |
VADER P, MOL E A, PASTERKAMP G, et al. Extracellular vesicles for drug delivery[J]. Adv Drug Deliv Rev, 2016, 106(Pt A): 148-156. |
| [6] |
VAN DER MEEL R, FENS M H, VADER P, et al. Extracellular vesicles as drug delivery systems:lessons from the liposome field[J]. J Control Release, 2014, 195: 72-85. DOI:10.1016/j.jconrel.2014.07.049 |
| [7] |
TAN S W, WU T T, ZHANG D, et al. Cell or cell membrane-based drug delivery systems[J]. Theranostics, 2015, 5(8): 863-881. DOI:10.7150/thno.11852 |
| [8] |
MUNOZ J L, BLISS S A, GRECO S J, et al. Delivery of functional anti-miR-9 by mesenchymal stem cell-derived exosomes to glioblastoma multiforme cells conferred chemosensitivity[J]. Mol Ther Nucleic Acids, 2013, 2: e126. DOI:10.1038/mtna.2013.60 |
| [9] |
ZHU Q W, LING X Z, YANG Y L, et al. Embryonic stem cells-derived exosomes endowed with targeting properties as chemotherapeutics delivery vehicles for glioblastoma therapy[J]. Adv Sci (Weinh), 2019, 6(6): 1801899. DOI:10.1002/advs.201801899 |
| [10] |
LUNAVAT T R, JANG S C, NILSSON L, et al. RNAi delivery by exosome-mimetic nanovesicles-Implications for targeting c-Myc in cancer[J]. Biomaterials, 2016, 102: 231-238. DOI:10.1016/j.biomaterials.2016.06.024 |
| [11] |
ZHANG X, WANG C, WANG J, et al. PD-1 blockade cellular vesicles for cancer immunotherapy[J]. Adv Mater, 2018, 30(22): e1707112. |
| [12] |
王一芩, 周佳磊, 白凯文, 等. 黑色素瘤的发病机制和治疗方法研究进展[J]. 药物生物技术, 2019, 26(4): 357-361. |
| [13] |
李艳阳, 孙海燕, 姜战胜, 等. 中医药防治抗肿瘤药物心脏毒性的研究[J]. 中国中医基础医学杂志, 2018, 24(11): 1602-1606. |
| [14] |
姜建奇, 吕艺伟, 王天莹, 等. 共载阿霉素-碳点@磷酸钙脂质纳米粒的制备与评价[J]. 沈阳药科大学学报, 2019, 36(11): 949-955. |
| [15] |
王未来, 丁勇兴, 闫若寒. 共载阿霉素与姜黄素纳米粒的制备及其抗耐药活性研究[J]. 内蒙古医学杂志, 2019, 51(11): 1284-1286, 1276. |
| [16] |
刘梦颐, 徐祖顺. 核磁共振成像引导的金球-阿霉素纳米复合物协同治疗[J]. 胶体与聚合物, 2019, 37(4): 169-171. |
| [17] |
喻兆阳, 薛慧颖, 钟梦菊. 具核磁共振成像功能的可再生介孔硅作为抗肿瘤药物新型载体的性能研究[J]. 转化医学杂志, 2019, 8(5): 266-270. |
| [18] |
RUAN H T, HU Q Y, WEN D, et al. A dual-bioresponsive drug-delivery depot for combination of epigenetic modulation and immune checkpoint blockade[J]. Adv Mater Weinheim, 2019, 31(17): e1806957. |
| [19] |
黄小莉, 刘莹莹, 丛敏. 以肝星状细胞为靶向的药物载体系统[J]. 临床肝胆病杂志, 2020, 36(1): 208-212. |
| [20] |
ZHUANG X Y, XIANG X Y, GRIZZLE W, et al. Treatment of brain inflammatory diseases by delivering exosome encapsulated anti-inflammatory drugs from the nasal region to the brain[J]. Mol Ther, 2011, 19(10): 1769-1779. DOI:10.1038/mt.2011.164 |
| [21] |
LIU Q L, BI C, LI J L, et al. Generating giant membrane vesicles from live cells with preserved cellular properties[J]. Research (Wash D C), 2019, 2019: 6523970. |
| [22] |
贾欣, 冯倩华, 张超锋, 等. 透明质酸修饰的中空介孔硫化铜负载阿霉素载药体系在乳腺癌模型裸鼠体内的分布行为及抗肿瘤效果观察[J]. 郑州大学学报(医学版), 2018, 53(6): 738-743. |
| [23] |
JIA G, HAN Y, AN Y L, et al. NRP-1 targeted and cargo-loaded exosomes facilitate simultaneous imaging and therapy of glioma in vitro and in vivo[J]. Biomaterials, 2018, 178: 302-316. DOI:10.1016/j.biomaterials.2018.06.029 |
 2020, Vol. 46
2020, Vol. 46


