扩展功能
文章信息
- 杨吉平, 费琳, 柴学军, 苟兴春
- YANG Jiping, FEI Lin, CHAI Xuejun, GOU Xingchun
- MyD88抑制肽对LPS诱导BV2小胶质细胞极化状态的抑制作用及其机制
- Inhibitory effect of MyD88 inhibitory peptide on polarization of BV2 microglial cells induced by LPS and its mechanism
- 吉林大学学报(医学版), 2020, 46(05): 899-904
- Journal of Jilin University (Medicine Edition), 2020, 46(05): 899-904
- 10.13481/j.1671-587x.20200501
-
文章历史
- 收稿日期: 2020-02-06
2. 西安交通大学第一附属医院精神心理科, 陕西 西安 710061
2. Department of Psychiatry and Psychology, First Affiliated Hospital, Xi'an Jiaotong University, Xi'an 710061, China
小胶质细胞是机体发育过程中存在于中枢神经系统内的一类特异性免疫细胞,对颅脑内多种疾病的病理变化具有重要的调节作用[1]。近年来,不同极化状态的小胶质细胞在神经炎症中的功能变化逐渐被研究者所关注,促使小胶质细胞向选择性激活状态(M2 phenotype)极化,抑制其向经典激活状态(M1 phenotype)极化,是治疗脑创伤和脑缺血的一个潜在靶点[2-3]。存在于小胶质细胞膜表面的Toll样受体(Toll-like receptors,TLRs)是连接天然固有免疫和获得性免疫应答的关键[4],髓样分化因子88(myeloid differentiation factor 88,MyD88)是TLRs下游接头分子,也是TLRs信号通路中的重要转导蛋白,TLRs/MyD88信号通路及其调控的基因表达产物在适应性免疫应答中发挥着重要作用[5]。研究[6]表明:蛛网膜下腔出血后MyD88的选择性抑制剂ST2825通过降低其下游信号核因子κB(nuclear factor-κB,NF-κB)和丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)的激活,减轻炎性反应,减弱促凋亡信号,从而对蛛网膜下腔出血后的脑损伤具有保护作用。本课题组前期研究[7]结果显示:体外神经元氧-糖剥离(oxygen-glucose deprivation,OGD)处理后可使MyD88蛋白的表达水平明显上调。然而,阻断或抑制MyD88对小胶质细胞的极化状态是否有影响尚未见报道。因此,本研究采用脂多糖(lipopolysaccharide,LPS)诱导BV2小胶质细胞建立体外炎症模型,探讨MyD88抑制肽(MyD88 inhibitory peptide,MIP)能否对抗LPS诱导的炎症反应,并调控小胶质细胞的极化状态,为脑缺血和脑创伤等疾病的治疗提供新的策略。
1 材料与方法 1.1 细胞、主要试剂和仪器BV2小胶质细胞为小鼠来源的小胶质细胞株,购自中国医学科学院基础医学研究所。DMEM培养基和胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司,噻唑蓝(MTT)和LPS购自美国Sigma公司,兔抗小鼠诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)抗体购自英国Abcam公司,山羊抗小鼠精氨酸酶1(arginase-1,Arg-1)抗体购自美国Santa Cruz公司,抗小鼠β-actin购自上海Beyotime公司,MIP和对照肽(control peptide,CP)购自美国Novus Biologicals公司。Multiskan FC酶标仪购自美国Thermo公司,超微量核酸分析仪购自杭州Allsheng公司,7500型实时荧光定量PCR仪购自美国ABI公司,Western blotting成像采用上海Tanon 4600全自动化学发光系统。实验中所用引物由西安擎科泽西生物科技有限公司合成。
1.2 细胞培养和实验分组将BV2小胶质细胞用含10% FBS的DMEM完全培养基于5% CO2、37℃条件下传代培养。取对数生长期细胞调整成密度为每毫升2×105个细胞,接种到96孔细胞培养板中,每孔100 μL,于细胞培养箱中贴壁培养3~4 h。实验分为对照组,LPS组,低、中和高剂量MIP+LPS组。MIP和CP在使用前均用0.01 mol·L-1 PBS缓冲液(pH7.4)溶解成5 mmol·L-1的储备液。待细胞贴壁后弃掉上清,对照组细胞每孔加DMEM培养基100 μL,LPS组细胞每孔加入80 μL DMEM和10 μL CP,低、中和高剂量MIP+LPS组每孔加入80 μL DMEM和10 μL MIP(MIP用DMEM培养基依次稀释至终浓度为25、50和100 μmol·L-1),培养1 h后,分别向LPS组和不同剂量MIP+LPS组各孔加入LPS 10 μL(LPS用双纯水稀释,工作浓度为1 mg·L-1),将96孔细胞培养板置于5% CO2、37℃细胞培养箱中继续培养24 h,进行后续实验。
1.3 细胞存活率测定BV2小胶质细胞培养24 h后,每孔中加入10 μL MTT液(5 g·L-1),继续培养4 h,每孔加入DMSO 150 μL,震荡10~15 min,至蓝紫色的甲臜颗粒完全溶解,于自动酶标仪490 nm处测定各孔吸光度(A)值,计算各组细胞存活率,细胞存活率=(干预组A值-空白孔A值)/(对照组A值-空白孔A值)×100%。活化率的计算方法为各组细胞随机拍3~5个视野,形态学观察“阿米巴状”活化细胞占该视野总细胞数的百分比,采用Image J软件进行统计。
1.4 实时荧光定量PCR(RT-qPCR)法检测各组细胞因子mRNA表达水平采用Trizol法提取各孔细胞总RNA,按照TaKaRa逆转录试剂盒说明书步骤进行反转录cDNA,分装保存,然后按组别分别加入反应体系,反应体系:2×SYBRⅡ Mix 5 μL,Rox 0.2 μL,引物(10 μmol·L-1)1 μL,cDNA 1 μL,RNase free dH2O 2.8 μL,每孔10 μL,设3个复孔。引物序列见表 1。反应条件:94℃预变性4 min;94℃变性30 s,58℃退火30 s,72℃延伸45 s,共循环30次;72℃延伸5 min。采用2-△△Ct法计算目的基因mRNA表达水平,目标基因mRNA水平通过与同组GAPDH mRNA水平标准化后进行组间比较。
| Primer | Sequence (5'-3') |
| IL-1β | Forward:CCTCGTGCTGTCGGACCCATA Reverse:CAGGCTTGTGCTCTGCTTGTGA |
| IL-4 | Forward:GGTCTCAACCCCCAGCTAGT Reverse:GCCGATGATCTCTCTCAAGTGAT |
| IL-10 | Forward:CCCATTCCTCGTCACGATCTC Reverse:TCAGACTGGTTTGGGATAGGTTT |
| IL-18 | Forward:GACTCTTGCGTCAACTTCAAGG Reverse:CAGGCTGTCTTTTGTCAACGA |
| GAPDH | Forward:TGGATTTGGACGCATTGGTC Reverse:TTTGCACTGGTACGTGTTGAT |
BV2细胞培养24 h后,弃掉上清,分别加入终浓度为1 mmol·L-1 PMSF的RIPA裂解液100 μL,在冰上超声裂解15 min,4℃、12 000 r ·min-1离心20 min;将上清液转移至另一离心管中,Bradford法检测蛋白水平。每孔取30 μg总蛋白上样,以SDS-PAGE电泳分离蛋白质,湿转至PVDF膜,用5%脱脂奶粉封闭1 h,TBST漂洗,分别加入一抗:iNOS(1︰300)、Arg-1(1︰300)和β-actin(1︰3 000),4℃过夜,TBST漂洗后,加入HRP标记的相应种属源的二抗(1︰5 000),室温孵育2 h。TBST漂洗4次,ECL发光。采用Image J软件进行蛋白表达条带灰度分析。目的蛋白表达水平=目的蛋白条带灰度值/β-actin条带灰度值。
1.6 统计学分析采用SPSS 19.0统计软件进行统计学分析。各组BV2小胶质细胞的细胞存活率、4种细胞因子mRNA表达水平以及各组细胞中iNOS和Arg-1蛋白表达水平均符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组BV2小胶质细胞形态表现对照组BV2小胶质细胞胞体较小,以圆形或类圆形居多,突起较少;LPS组细胞胞体明显变大,突起增多,部分突起变粗变短,有时可见小棘,呈典型的“阿米巴状”;不同剂量MIP+LPS组BV2小胶质细胞较LPS组细胞突起变细变少,呈梭形,见图 1(插页一)。采用Image J软件对活化的BV2细胞进行统计,不同剂量MIP+LPS组BV2小胶质细胞的活化率较LPS组明显降低(P < 0.05或P < 0.01),见表 2,且呈剂量依赖性,表明MIP对LPS激活BV2小胶质细胞具有明显抑制作用。
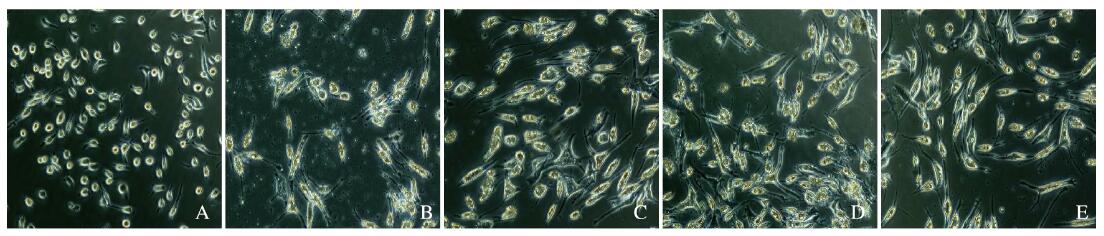
|
| A: Control group; B: LPS group; C-E: 25, 50, and 100 μmol MIP + LPS groups. 图 1 各组BV2小胶质细胞的形态表现(X200) Fig. 1 Morphology of BV2 microglia in various groups(X 200) (seen on page 901 in paragraph) |
|
|
| (n=8, x±s, η/%) | |||||||||||||||||||||||||||||
| Group | Activation rate | Survival rate | |||||||||||||||||||||||||||
| Control | 8.97 ±0.46 | 98.85±1.02 | |||||||||||||||||||||||||||
| LPS | 83.23±2.73* | 53.98±2.63* | |||||||||||||||||||||||||||
| 25 μmol·L-1 MIP+LPS | 60.78±1.94Δ | 78.13±4.36Δ | |||||||||||||||||||||||||||
| 50 μmol·L-1 MIP+LPS | 42.89±1.43ΔΔ | 89.75±2.65ΔΔ | |||||||||||||||||||||||||||
| 100 μmol·L-1 MIP+LPS | 13.95±1.04ΔΔ | 95.26±3.47ΔΔ | |||||||||||||||||||||||||||
| *P < 0.01 compared with control group;∆P < 0.05,∆∆P < 0.01 compared with LPS group. | |||||||||||||||||||||||||||||
与对照组比较,LPS组BV2小胶质细胞存活率明显降低(P < 0.01);与LPS组比较,不同剂量MIP +LPS组BV2小胶质细胞存活率明显升高(P < 0.05或P < 0.01),且呈一定的剂量依赖性。见表 2。
2.3 各组BV2小胶质细胞中IL-1β、IL-18、IL-4和IL-10 mRNA表达水平与对照组比较,LPS组BV2小胶质细胞中M1型细胞因子IL-1β和IL-18 mRNA表达水平明显升高(P < 0.01)。与LPS组比较,不同剂量MIP+LPS组BV2小胶质细胞中IL-1β和IL-18 mRNA的表达水平明显降低(P < 0.05或P < 0.01),而M2型细胞因子IL-4和IL-10 mRNA表达水平明显升高(P < 0.05或P < 0.01),且呈剂量依赖性。见表 3。
| (n=8, x±s) | |||||||||||||||||||||||||||||
| Group | IL-1β | IL-18 | IL-4 | IL-10 | |||||||||||||||||||||||||
| Control | 1.00±0.14 | 1.00±0.15 | 1.00±0.11 | 1.00±0.12 | |||||||||||||||||||||||||
| LPS | 5.85±0.43* | 5.47±0.47* | 3.86±0.32* | 4.09±0.37* | |||||||||||||||||||||||||
| 25 μmol·L-1MIP+LPS | 4.24±0.34∆ | 4.08±0.35∆ | 5.91±0.34∆ | 6.06±0.44∆ | |||||||||||||||||||||||||
| 50 μmol·L-1MIP+LPS | 3.46±0.28∆ | 3.06±0.32∆∆ | 7.21±0.42∆∆ | 7.15±0.42∆∆ | |||||||||||||||||||||||||
| 100 μmol·L-1MIP+LPS | 2.43±0.27∆ | 2.34±0.28∆∆ | 8.34±0.47∆∆ | 8.18±0.43∆∆ | |||||||||||||||||||||||||
| *P < 0. 01 compared with control group;ΔP < 0. 05,ΔΔP < 0. 01 compared with LPS group. | |||||||||||||||||||||||||||||
与对照组比较,LPS组BV2小胶质细胞中iNOS蛋白表达水平明显升高(P < 0.01),Arg-1蛋白表达水平明显降低(P < 0.01);与LPS组比较,不同剂量MIP+LPS组BV2小胶质细胞中iNOS蛋白表达水平明显降低(P < 0.05或P < 0.01),而Arg-1蛋白表达水平明显升高(P < 0.01)。见图 2和表 4。
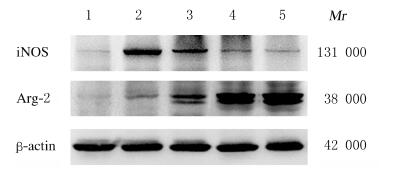
|
| Control group; Lane 2: LPS group; Lane 3-5: 25, 50 and 100 μmol∙L-1 MIP groups. 图 2 各组BV2小胶质细胞中iNOS和Arg-1蛋白表达电泳图 Fig. 2 Electrophoregram of expressions of iNOS and Arg-1 protein in BV2 microglial cells in various groups |
|
|
| (n=8, x±s) | |||||||||||||||||||||||||||||
| Group | iNOS | Arg-1 | |||||||||||||||||||||||||||
| Control | 0.09±0.02 | 0.09±0.01 | |||||||||||||||||||||||||||
| LPS | 1.10±0.05* | 0.44±0.04* | |||||||||||||||||||||||||||
| 25 μmol·L-1 MIP+LPS | 0.78±0.03Δ | 0.99±0.04ΔΔ | |||||||||||||||||||||||||||
| 50 μmol·L-1 MIP+LPS | 0.52±0.04ΔΔ | 1.21±0.03ΔΔ | |||||||||||||||||||||||||||
| 100 μmol·L-1 MIP+LPS | 0.22±0.03ΔΔ | 1.52±0.05ΔΔ | |||||||||||||||||||||||||||
| *P < 0.01 compared with control group;∆ P < 0.05,∆∆P < 0.01 compared with LPS group. | |||||||||||||||||||||||||||||
BV2小胶质细胞是源于小鼠脑内的小胶质细胞经过逆转录病毒v-raf/v-myc转染获得的永生细胞,建立于1990年,该细胞保留了小胶质细胞形态、表型和多种功能[8]。由于原代培养的小胶质细胞来源有限,细胞增殖分裂能力差,操作过程繁琐,获得的细胞数量较少,不能很好地适应体外研究需要,因此一般采用BV2细胞系替代小胶质细胞进行体外实验。LPS是一种强力炎性反应诱导剂,可通过激活BV2小胶质细胞构建体外神经炎症模型[9]。本研究结果显示:经1 mg·L-1 LPS刺激后,BV2小胶质细胞胞体明显变大,突起变粗变短,呈典型的“阿米巴状”,表明BV2小胶质细胞在LPS刺激下呈激活形态;MTT法检测结果显示:LPS组BV2小胶质细胞存活率低于对照组,这与文献报道[10-11]相一致。
近年来,不同极化状态的小胶质细胞在神经炎症中的功能变化逐渐被研究者所重视,当脑组织受到各种伤害性刺激(创伤、缺血和感染等)时,小胶质细胞即从静息态(M0)转变为M1型或M2型[12-13],iNOS是M1型小胶质细胞表面主要的标记物之一[14]。本研究结果显示:BV2小胶质细胞经LPS处理后iNOS蛋白表达水平较对照组明显升高,表明LPS可使小胶质细胞向M1方向极化;RT-PCR法检测结果显示:LPS组BV2小胶质细胞中IL-1β和IL-18 mRNA表达水平较对照组明显升高,提示LPS可增加M1型小胶质细胞分泌促炎性细胞因子。
MyD88是TLRs和IL-1家族信号通路在胞内的一个关键接头蛋白,与多种炎症性疾病的发生发展密切相关[15-17]。研究[18]表明:MyD88基因敲除可减少癫痫持续状态后小鼠海马中炎症反应,增加癫痫模型小鼠海马CA1区谷氨酸转运蛋白-1的表达,从而减少锥体神经元凋亡。本研究应用25、50和100 μmol·L-1 MIP干预BV2小胶质细胞后结果显示:不同剂量MIP+LPS组活化细胞的数目较LPS组明显减少,细胞存活率较LPS组明显提高,且呈一定的剂量依赖性,表明MIP对LPS激活BV2小胶质细胞具有一定的抑制作用。M2型小胶质细胞标记物包括Arg-1、CD163、CD206、CD209、Ym1、Fizzl和甘露糖受体(mannose receptor,MR)等[19]。本研究结果显示:与模型组比较,MIP可剂量依赖性地上调BV2小胶质细胞体外炎症模型Arg-1蛋白的表达水平,表明通过抑制MyD88信号通路可使小胶质细胞向M2方向极化,从而抑制炎症反应,促进组织修复。
M1型小胶质细胞能产生肿瘤坏死因子α(TNF-α)、IL-1、IL-6、IL-18和IL-23等促炎性细胞因子,以及多种趋化因子,促进炎症和产生组织损伤,对神经元产生毒性作用[20]。M2型小胶质细胞能分泌转化生长因子β1(TGFβ1)、IL-4和IL-10等抗炎性细胞因子,能够抑制过度的炎性反应,有利于清除坏死组织,促进组织修复和神经元再生[21]。本研究结果显示:LPS组BV2小胶质细胞M1型细胞因子IL-1β和IL-18 mRNA表达水平较对照组明显升高;与LPS组比较,不同剂量MIP +LPS组BV2小胶质细胞M2型细胞因子IL-4和IL-10 mRNA的表达水平明显升高,且呈剂量依赖性,表明MIP可抑制LPS诱导的促炎因子释放,剂量依赖性地增加抗炎细胞因子的分泌。
综上所述,本研究利用MyD88的选择性抑制剂MIP作用于LPS诱导的BV2小胶质细胞炎症模型,结果显示:MIP能有效抑制BV2小胶质细胞向M1型极化,促进其向M2型表型转化,抑制炎症的过度激活。因此,通过阻断或抑制MyD88表达调节小胶质细胞的极化表型,可作为一个潜在的脑卒中和脑创伤等治疗策略。然而,MIP促使小胶质细胞向M2型转化的具体分子机制及其能否直接发挥神经元保护作用还需进一步研究。
| [1] |
HARUWAKA K, IKEGAMI A, TACHIBANA Y, et al. Dual microglia effects on blood brain barrier permeability induced by systemic inflammation[J]. Nat Commun, 2019, 10(1): 5816. |
| [2] |
DI STADIO A, ANGELINI C. Microglia polarization by mitochondrial metabolism modulation: a therapeutic opportunity in neurodegenerative diseases[J]. Mitochondrion, 2019, 46: 334-336. DOI:10.1016/j.mito.2018.09.003 |
| [3] |
WANG J, XING H Y, WAN L, et al. Treatment targets for M2 microglia polarization in ischemic stroke[J]. Biomed Pharmacother, 2018, 105: 518-525. DOI:10.1016/j.biopha.2018.05.143 |
| [4] |
FIEBICH B L, BATISTA C R A, SALIBA S W, et al. Role of microglia TLRs in neurodegeneration[J]. Front Cell Neurosci, 2018, 12: 329. |
| [5] |
LIU M J, XIE J H, SUN Y X. TLR4/MyD88/NF-κB-mediated inflammation contributes to cardiac dysfunction in rats of PTSD[J]. Cell Mol Neurobiol, 2020, 40(6): 1029-1035. DOI:10.1007/s10571-020-00791-9 |
| [6] |
YAN H Y, ZHANG D D, WEI Y X, et al. Inhibition of myeloid differentiation primary response protein 88 provides neuroprotection in early brain injury following experimental subarachnoid hemorrhage[J]. Sci Rep, 2017, 7(1): 15797. DOI:10.1038/s41598-017-16124-8 |
| [7] |
YANG J P, ZHAO Y Y, ZHANG L, et al. RIPK3/MLKL-mediated neuronal necroptosis modulates the M1/M2 polarization of microglia/macrophages in the ischemic cortex[J]. Cereb Cortex, 2018, 28(7): 2622-2635. DOI:10.1093/cercor/bhy089 |
| [8] |
KUČIĆ N, RAČKI V, JURDANA K, et al. Immunometabolic phenotype of BV-2 microglia cells upon murine cytomegalovirus infection[J]. J Neurovirol, 2019, 25(4): 496-507. DOI:10.1007/s13365-019-00750-1 |
| [9] |
YUN H K, PARK J, CHAE U, et al. Parkin in early stage LPS-stimulated BV-2 cells regulates pro-inflammatory response and mitochondrial quality via mitophagy[J]. J Neuroimmunol, 2019, 336: 577044. DOI:10.1016/j.jneuroim.2019.577044 |
| [10] |
SHAO Q H, ZHANG X L, CHEN Y, et al. Anti-neuroinflammatory effects of 20C from Gastrodia elata via regulating autophagy in LPS-activated BV-2 cells through MAPKs and TLR4/Akt/mTOR signaling pathways[J]. Mol Immunol, 2018, 99: 115-123. DOI:10.1016/j.molimm.2018.04.014 |
| [11] |
YAN J J, DU G H, QIN X M, et al. Baicalein attenuates the neuroinflammation in LPS-activated BV-2 microglial cells through suppression of pro-inflammatory cytokines, COX2/NF-κB expressions and regulation of metabolic abnormality[J]. Int Immunopharmacol, 2020, 79: 106092. DOI:10.1016/j.intimp.2019.106092 |
| [12] |
BAI Q, XUE M Z, YONG V W. Microglia and macrophage phenotypes in intracerebral haemorrhage injury: therapeutic opportunities[J]. Brain, 2020, 143(5): 1297-1314. DOI:10.1093/brain/awz393 |
| [13] |
MA S, FAN L L, LI J C, et al. Resveratrol promoted the M2 polarization of microglia and reduced neuroinflammation after cerebral ischemia by inhibiting miR-155[J]. Int J Neurosci, 2020, 1-9. |
| [14] |
BUTTURINI E, BORIERO D, CARCERERI DE PRATI A, et al. STAT1 drives M1 microglia activation and neuroinflammation under hypoxia[J]. Arch Biochem Biophys, 2019, 669: 22-30. DOI:10.1016/j.abb.2019.05.011 |
| [15] |
ZHU G W, CHENG Z B, LIN C L, et al. MyD88 regulates LPS-induced NF-kB/MAPK cytokines and promotes inflammation and malignancy in colorectal cancer cells[J]. Cancer Genomics Proteomics, 2019, 16(6): 409-419. DOI:10.21873/cgp.20145 |
| [16] |
AKHTER N, HASAN A, SHENOUDA S, et al. TLR4/MyD88-mediated CCL2 production by lipopolysaccharide (endotoxin): Implications for metabolic inflammation[J]. J Diabetes Metab Disord, 2018, 17(1): 77-84. DOI:10.1007/s40200-018-0341-y |
| [17] |
KIM Y C, LEE S E, KIM S K, et al. Toll-like receptor mediated inflammation requires FASN-dependent MYD88 palmitoylation[J]. Nat Chem Biol, 2019, 15(9): 907-916. |
| [18] |
LIU J T, WU S X, ZHANG H, et al. Inhibition of MyD88 signaling skews microglia/macrophage polarization and attenuates neuronal apoptosis in the hippocampus after status epilepticus in mice[J]. Neurotherapeutics, 2018, 15(4): 1093-1111. DOI:10.1007/s13311-018-0653-0 |
| [19] |
KOBASHI S, TERASHIMA T, KATAGI M, et al. Transplantation of M2-deviated microglia promotes recovery of motor function after spinal cord injury in mice[J]. Mol Ther, 2020, 28(1): 254-265. DOI:10.1016/j.ymthe.2019.09.004 |
| [20] |
MI Y, WU Q, YUAN W R, et al. Role of microglia M1/M2 polarisation in the paraventricular nucleus: New insight into the development of stress-induced hypertension in rats[J]. Auton Neurosci, 2018, 213: 71-80. DOI:10.1016/j.autneu.2018.06.003 |
| [21] |
WANG J, XING H Y, WAN L, et al. Treatment targets for M2 microglia polarization in ischemic stroke[J]. Biomed Pharmacother, 2018, 105: 518-525. DOI:10.1016/j.biopha.2018.05.143 |
 2020, Vol. 46
2020, Vol. 46


