扩展功能
文章信息
- 王丹, 廖丹, 李红, 熊立秋, 武莹, 董营, 盖晓东
- WANG Dan, LIAO Dan, LI Hong, XIONG Liqiu, WU Ying, DONG Ying, GAI Xiaodong
- 浆细胞样树突状细胞和Foxp3+调节性T细胞在结直肠癌组织中的表达及其意义
- Expressions of plasmacytoid dendritic cells and Foxp3+ regulatory T cells in colorectal cancer tissue and their significances
- 吉林大学学报(医学版), 2020, 46(04): 834-838
- Journal of Jilin University (Medicine Edition), 2020, 46(04): 834-838
- 10.13481/j.1671-587x.20200427
-
文章历史
- 收稿日期: 2019-12-24
2. 吉林化工集团公司总医院急诊内科, 吉林 吉林 132011
2. Department of Emergency Medicine, Jilin Chemical Industry Company Hospital, Jilin 132011, China
结直肠癌(colorectal cancer, CRC)是临床上常见的恶性肿瘤,临床治疗主要是手术治疗、内镜治疗及放化疗,近年来免疫治疗和中医中药治疗也越来越受到重视。CRC微环境和肿瘤引流淋巴结(tumor-draining lymph node,TDLN)中的各种免疫细胞在抗肿瘤免疫中起至关重要的作用,探讨抗肿瘤免疫的作用机制可为临床CRC的治疗提供新线索。
调节性T细胞(regulatory T cell, Tregs)代表CD4+辅助T细胞亚群,叉状头转录因子3(forked head transcription factor 3, Foxp3)作为Tregs的标志性分子[1],是叉状头转录因子家族成员之一。Foxp3作为一个转录调控子能够调节Tregs的活性,其在调节机体自身免疫中起关键作用,Foxp3基因突变能够引起严重的自身免疫性疾病,因此Foxp3在调节机体免疫自稳中起至关重要的作用。在多种人类恶性肿瘤中均发现了Tregs的浸润,Foxp3+Tregs通过抑制抗肿瘤免疫来促进肿瘤生长和转移[2]。树突状细胞(dendritic cells, DCs)是一种功能强大的抗原提呈细胞,是启动和活化静止T细胞的专职细胞,因此DCs与T细胞的相互作用是肿瘤有效免疫应答的基础。根据细胞起源不同,DCs可分为髓样树突状细胞(myeloid dendritic cells, mDCs)和浆细胞样树突状细胞(plasmacytoid dendritic cells, pDCs)。研究[3]显示:mDCs和Tregs在免疫应答及免疫耐受过程中起至关重要的调节作用。mDCs在CRC患者组织中的浸润可以反映肿瘤组织的免疫状态[4],但pDCs是否有类似的作用目前尚不明确。pDCs起源于淋巴样前体细胞,在病毒刺激下能够分泌大量的Ⅰ型干扰素,促进固有性免疫,在免疫系统中发挥重要的作用。pDCs与T细胞的相互作用可促进Tregs的产生[5]。到目前为止,尚不清楚CRC组织中CD123+ pDCs和Foxp3+ Tregs是否对CRC患者的临床进展和预后有影响。本研究将Foxp3和CD123蛋白在肿瘤组织中的表达水平与CRC患者临床病理指标进行统计学分析,探讨Tregs和pDCs在CRC组织中分布的临床意义。
1 资料与方法 1.1 标本收集和处理选择2008年6月—2015年12月在吉化集团公司总医院行手术切除并经病理证实的CRC患者63例,患者术前均未经放疗或化疗。63例CRC患者中男性33例,女性30例,平均年龄64岁(47~82岁);有淋巴结转移27例,无淋巴结转移36例;分化程度良好12例,分化程度较低46例(5例黏液癌不计入)。根据2000年WHO关于CRC的标准分类,管状腺癌58例,黏液癌5例;根据国际癌症控制联盟(UICC 2002)标准分类,T1+T2期19例,T3+T4期44例;根据UICC2002分期系统的TNM分期标准分类,Ⅰ+Ⅱ期34例,Ⅲ+Ⅳ期29例。收集上述63例CRC患者癌组织和TDLN标本,同时收集癌旁正常组织(距离肿瘤边缘 > 5 cm处)作为对照。本研究方案经北华大学医学院伦理委员会批准,所有研究对象均对本研究知情同意。
1.2 主要试剂和仪器小鼠抗人Foxp3单克隆抗体(武汉博士德公司),小鼠抗人CD123单克隆抗体(北京杉木金桥生物技术公司),多聚赖氨酸、免疫组织化学SP试剂盒和DAB显色剂(福州迈新生物技术公司)。包埋机和切片机(德国LEICA公司),生物显微镜(日本Olympus公司)。
1.3 免疫组织化学染色所有标本经固定、常规脱水和石蜡包埋,制作4 μm厚组织切片,采用SP免疫组织化学试剂盒进行免疫组织化学染色:切片经二甲苯脱蜡,梯度酒精水化,3% H2O2室温下孵育阻断内源性过氧化物酶活性,然后加热(EDTA, pH值8)诱导抗原修复。切片分别滴加Foxp3抗体和CD123单克隆抗体4℃过夜后滴加二抗,PBS缓冲液冲洗后加入DAB溶液,显微镜下观察控制显色,苏木精复染,然后脱水封片。每个样本重复检测2次。
1.4 结果判定标准染色组织切片置于400倍显微镜下,随机选取10个视野,分别由不同病理学专业人员采用双盲法评估观察结果。每个视野计数100个细胞,计数阳性细胞数,求取阳性细胞数的平均值。阳性细胞数≤ 20为低浸润,阳性细胞数 > 20为高浸润。
1.5 统计学分析采用SPSS13.0统计软件进行统计学分析。CRC患者癌组织、癌旁正常组织及转移TDLN(mTDLN)和非转移TDLN(mfTDLN)组织中中Foxp3+Tregs和CD123+pDCs阳性细胞数及pDC/mDC比值经正态性检验均呈正态性分布,以x±s表示,两组间样本均数比较采用t检验;CRC患者肿瘤组织和癌旁正常组织中CD123的阳性表达率比较采用χ2检验;采用Spearman秩相关分析法分析Foxp3+Tregs与CD123+pDCs阳性细胞数和PDC/mDC比值的相关性。以P < 0.05为差异有统计学意义。
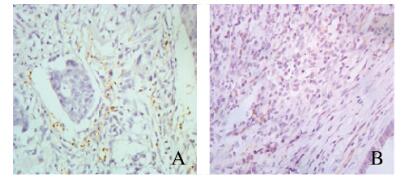
2 结果 2.1 CRC患者癌组织和癌旁正常组织中Foxp3+Tregs和CD123+pDCs阳性细胞数Foxp3蛋白阳性表达为棕黄色颗粒,主要定位于Tregs的细胞核中,Foxp3+ Tregs散在分布于CRC患者肿瘤组织和癌旁正常组织中,其在CRC患者癌组织中的阳性细胞数(8.1 ± 2.7)明显高于癌旁正常组织(1.0 ± 0.6)(P < 0.01)(图 1A,见插页九)。CRC患者癌组织中CD123+pDC主要分布于肿瘤组织间质(图 1B,见插页九),其阳性表达为棕黄色颗粒,主要定位于细胞浆,CD123+pDC以圆形和浆细胞样形态为特征,尽管其阳性细胞数较低,但是CD123在CRC肿瘤组织中的阳性表达率(44.2%)明显高于癌旁正常组织(10.0%),差异有统计学意义(χ2 = 18.68, P < 0.01)。
|
|
A: Nuclear staining for Foxp3; B: Membranous staining for CD123. (seen on page 836 in paragraph) 图 1 Foxp3+ Tregs和CD123+ pDCs在CRC患者癌组织中的表达(免疫组织化学, X 400) Fig. 1 Expressions of Foxp3+ Tregs and CD123+ pDCs in cancer tissue of CRC patients (Immunohistochemistry, X 400) |
|
|
TNM分期Ⅲ+Ⅳ期患者癌组织中Foxp3+Tregs阳性细胞数明显高于TNM分期Ⅰ+Ⅱ期患者(P < 0.01),淋巴结转移阳性患者癌组织中Foxp3+Tregs阳性细胞数明显高于无淋巴结转移患者(P < 0.01),Foxp3+Tregs阳性细胞数与患者年龄、肿瘤类型、肿瘤浸润深度和肿瘤分化程度无关联(P > 0.05)。见表 1。
| Clinicopathological parameter | n | Foxp3 | P |
| Age(year) | |||
| ≥60 | 40 | 8.01±2.44 | 0.337 |
| < 60 | 23 | 8.32±3.45 | |
| Histology | |||
| Tubular adenocarcinoma | 58 | 8.16±3.34 | 0.349 |
| Mucious carcinoma | 5 | 7.52±5.53 | |
| Depth infiltration | |||
| T1+T2 | 19 | 8.13±2.73 | 0.498 |
| T3+T4 | 44 | 8.12±2.90 | |
| Differentiation | |||
| Well-Moderate | 12 | 7.87±3.19 | 0.361 |
| Poor | 46 | 8.20±2.82 | |
| Lymph node metastasis | |||
| Yes | 27 | 9.75±2.88 | < 0.01 |
| No | 36 | 6.91±2.10 | |
| TNM stage | |||
| Ⅰ+Ⅱ | 34 | 6.84±2.10 | < 0.01 |
| Ⅲ+Ⅳ | 29 | 9.63±2.86 | |
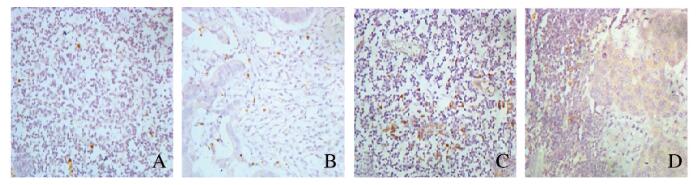
Foxp3+Tregs分布于淋巴结的副皮质区,mTDLN组织中Foxp3+Trges阳性细胞数明显高于mfTDLN(P < 0.01)。CD123+pDCs主要分布于淋巴结的副皮质区及癌巢,mTDLN和mfTDLN组织中CD123+pDCs阳性细胞数比较差异无统计学意义(P > 0.05)。mTDLN组织中pDC/mDC比值明显高于mfTDLN(P < 0.01)。见表 2和图 2(插页九)。
| (x±s) | |||||||||||||||||||||||||||||
| Group | n | Foxp3+Tregs | CD123+pDCs | pDCs/mDCs | |||||||||||||||||||||||||
| mfTDLN | 36 | 5.48±2.50 | 9.74±4.25 | 1.49 ±0.86 | |||||||||||||||||||||||||
| mTDLN | 27 | 8.37±4.19* | 8.59±3.20 | 3.62 ±1.70* | |||||||||||||||||||||||||
| * P < 0.01 compared with mfTDLN group. | |||||||||||||||||||||||||||||
|
|
A. B: Nuclear staining for Foxp3;C, D: Membranous staining for CD123; A, C: mfTDLN; B, D: mTDLN (seen on page 836 in paragraph) 图 2 Foxp3 + Tregs和CD123 + pDCs在CRC患者TDLN组织中的表达(免疫组织化学, X 400) Fig. 2 Expressions of Foxp3 + Tregs and CD123 + pDCs in TDLN tissue of CRC patients(Immunohistochemistry, X 400) |
|
|
Foxp3+Tregs与CD123+pDCs阳性细胞数无相关关系(r=0.103, P=0.423),而Foxp3+Tregs阳性细胞数与pDC/mDC比值呈正相关关系(r=0.421, P < 0.01)。
3 讨论近年来,免疫治疗逐渐成为肿瘤综合治疗的组成部分。一系列研究[6-9]表明:Tregs与肿瘤免疫逃逸机制有密切关联,Foxp3+Tregs在多种肿瘤中的比例异常增高,如非小细胞肺癌、上皮性卵巢癌、乳腺癌和恶性胸膜间皮瘤等。FAGHIH等[10]发现:在乳腺癌中新的抗原刺激优先激活T细胞抗原受体(T cell receptor, TCR) Vβ亚家族表达调节的Tregs,从而导致肿瘤免疫耐受。还有研究[11-12]显示:一些肿瘤细胞会通过肿瘤坏死因子α(tumor necrosis factor α, TNF-α)、肿瘤坏死因子R2(tumor necrosis factor R2, TNFR2)通路间接或者直接诱导Tregs浸润增多;此外肿瘤细胞分泌趋化因子CCL22能够与Tregs表面CCR4受体结合,从而导致Tregs在肿瘤组织中的聚集。因此,在以细胞为主的肿瘤免疫过程中,Tregs处于关键环节,决定了机体免疫自稳。本研究结果显示:Foxp3+ Tregs在63例CRC标本中均有表达,明显高于癌旁正常组织;Foxp3+Tregs浸润与CRC患者淋巴结转移和TNM分期有密切关联,Foxp3+Tregs在淋巴结转移患者肿瘤组织中的浸润明显高于无淋巴结转移患者,随着TNM分期增高,Foxp3+Tregs在肿瘤组织中的浸润增多。淋巴结转移和TNM分期是判断肿瘤患者预后和存活时间的重要指标。本研究结果证实:Foxp3+Tregs浸润与CRC患者转移及预后不良有关。
pDCs是一个独特而重要的DC亚群,能够产生大量的干扰素1(interferon-1, IFN-1), 具有抗病毒及抗宿主核酸复合物的作用[13-15]。虽然大多数研究均关注pDCs在抗病毒免疫中的作用,但也有部分证据[16]证明:pDCs与肿瘤免疫和促进免疫耐受有关,当受到肿瘤抗原刺激时,pDCs离开骨髓,通过淋巴结中的高内皮小静脉迁移到T细胞丰富区域和肿瘤组织中的二级淋巴结附近,增强肿瘤细胞的免疫耐受作用。本研究首次证明:CD123+pDCs在正常的结直肠黏膜组织中几乎不表达,而是散在分布于结直肠癌肿瘤间质,CD123+pDCs与Foxp3+Tregs相互作用的关系以及肿瘤部位的活性调控仍需进一步阐明,因此本研究进一步分析了TDLN组织中Foxp3+ Tregs与CD123+pDCs的相关性,未发现明显相关性,但研究结果显示:Foxp3+ Tregs阳性细胞数与pDC/mDC比值呈正相关关系。内源性Foxp3+Tregs与CD123+pDCs在局部淋巴结中相互作用的分子机制将是本课题组下一步研究的课题。
探讨TDLN的免疫状态是近年来肿瘤免疫研究的热点问题之一[17]。本研究分析了暴露于免疫耐受因子的mTDLN是否较mfTDLN具有更强的免疫抑制功能:CRC患者mTDLN癌组织中Foxp3+Tregs阳性细胞数较mfTDLN高,CD123+pDCs阳性细胞数比较差异无统计学意义,但mTDLN组织中pDC/mDC比值明显高于mfTDLN。BATTAGLIA等[18]采用免疫组织化学方法检测发现:宫颈癌患者mTDLNs组织中pDC/mDC比值明显高于mfTDLN。该结果可能意味着在TDLN中,DCs中2个不平衡的淋巴结亚群与肿瘤的免疫耐受及肿瘤的发生发展有密切关联。研究[19]显示:扁桃体鳞状细胞癌患者中的DC亚群比率是不平衡的,即所谓的DC亚群漂移。然而有关DC亚群漂移的机制目前并不清楚。一些证据[20]表明:肿瘤细胞不仅可以抑制mDCs的迁移和功能,也能吸引淋巴前体细胞(pre-pDCs)。此外,还有一些研究[21]表明:肿瘤组织中表达的pDCs是不成熟或者功能受损的。上述研究为CRC患者存在DC亚群漂移的理论提供了支持,并提示mTDLN中有肿瘤免疫耐受。
综上所述,随着CRC的发展,Foxp3+Tregs在CRC肿瘤组织和TDLN组织中均呈高表达。转移淋巴结中pDC/mDC比值增加,与Foxp3+Tregs在淋巴结中的分布呈正相关关系,提示DC亚群的比例失调可能是Foxp3+Tregs促进肿瘤发生发展的重要机制之一。然而,Foxp3+Tregs和CD123+pDCs在CRC中的作用机制仍需进一步研究。
| [1] |
HORI S, NOMURA T, SAKAGUCHI S. Control of regulatory T cell development by the transcription factor Foxp3[J]. J Immunol, 2017, 98(3): 981-985. |
| [2] |
NOMURA T, SAKAGUCHI S. Naturally arising CD25+CD4+ regulatory T cells in tumor immunity[J]. Curr Top Microbiol Immunol, 2005, 293: 287-302. |
| [3] |
SUN C M, HALL J A, BLANK R B, et al. Small intestine lamina propria dendritic cells promote de novo generation of Foxp3 Treg cells via retinoic acid[J]. J Exp Med, 2007, 204(8): 1775-1785. DOI:10.1084/jem.20070602 |
| [4] |
GULUBVA M, ALEKSANDROVA E, VLAYKOVA T. Promoter polymorphisms inTGFB1 and IL-10 genes influence tumor dendritic cells infiltration, development and prognosis of colorectal cancer[J]. J Gene Med, 2018, 20(2/3): e3005. |
| [5] |
MATTA B M, CASTELLANETA A, THOMSON A W. Tolerogenic plasmacytoid DC[J]. Eur J Immunol, 2010, 40(10): 2667-2676. DOI:10.1002/eji.201040839 |
| [6] |
KE X, ZHANG S P, XU J, et al. Non-small-cell lung cancer-induced immunosuppression by increased human regulatory T cells via Foxp3 promoter demethylation[J]. Cancer Immunol Immunother, 2016, 65(5): 587-599. DOI:10.1007/s00262-016-1825-6 |
| [7] |
KE X, SHEN L S. Targeting cytokines secreted by CD4+ CD25high CD127low regulatory T cells inhibits ovarian cancer progression[J]. Scand J Immunol, 2019, 89(2): e12736. DOI:10.1111/sji.12736 |
| [8] |
PENG G L, LI L, GUO Y W, et al. CD8+ cytotoxic and FoxP3+ regulatory T lymphocytes serve as prognostic factors in breast cancer[J]. Am J Transl Res, 2019, 11(8): 5039-5053. |
| [9] |
KLAMPATSA A, O'BRIEN S M, THOMPSON J C, et al. Phenotypic and functional analysis of malignant mesothelioma tumor-infiltrating lymphocytes[J]. Oncoimmunology, 2019, 8(9): e1638211. DOI:10.1080/2162402X.2019.1638211 |
| [10] |
FAGHIH Z, DEIHIMI S, TALEI A, et al. Analysis of T cell receptor repertoire based on Vβ chain in patients with breast cancer[J]. Cancer Biomark, 2018, 22(4): 733-745. DOI:10.3233/CBM-181295 |
| [11] |
WANG M, ZHANG C, TIAN T, et al. Increased regulatory T Cells in peripheral blood of acute myeloid leukemia patients rely on tumor necrosis factor (TNF)-α-TNF receptor-2 pathway[J]. Front Immunol, 2018, 9: 1274. DOI:10.3389/fimmu.2018.01274 |
| [12] |
WANG Q, SCHMOECKEL E, KOST B P, et al. Higher CCL22+ cell infiltration is associated with poor prognosis in cervical cancer patients[J]. Cancers (Basel), 2019, 11(12): E2004. DOI:10.3390/cancers11122004 |
| [13] |
GERLINI G, URSO C, MARIOTTI G, et al. Plasmacytoid dendritic cells represent a major dendritic cell subset in sentinel lymph nodes of melanoma patients and accumulate in metastatic nodes[J]. Clin Immunol, 2007, 125(2): 184-193. |
| [14] |
PERROT I, BLANCHARD D, FREYMOND N, et al. Dendritic cells infiltrating human non-small cell lung cancer are blocked at immature stage[J]. J Immunol, 2007, 178(5): 2763-2769. |
| [15] |
GERLINI G, DI GENNARO P, MARIOTTI G, et al. Indoleamine 2, 3-dioxygenase+ cells correspond to the BDCA2+ plasmacytoid dendritic cells in human melanoma sentinel nodes[J]. J Invest Dermatol, 2010, 130(3): 898-901. |
| [16] |
MITCHELL D, CHINTALA S, DEY M. Plasmacytoid dendritic cell in immunity and cancer[J]. J Neuroimmunol, 2018, 322: 63-73. DOI:10.1016/j.jneuroim.2018.06.012 |
| [17] |
MA S K, CHEE J, FEAR V S, et al. Pre-treatment tumor neo-antigen responses in draining lymph nodes are infrequent but predict checkpoint blockade therapy outcome[J]. Oncoimmunology, 2020, 9(1): 1684714. DOI:10.1080/2162402X.2019.1684714 |
| [18] |
BATTAGLIA A, BUZZONETTI A, BARANELLO C, et al. Metastatic tumour cells favour the generation of a tolerogenic milieu in tumour draining lymph node in patients with early cervical cancer[J]. Cancer Immunol Immunother, 2009, 58(9): 1363-1373. DOI:10.1007/s00262-008-0646-7 |
| [19] |
ABOLHALAJ M, ASKMYR D, SAKELLARIOU C A, et al. Profiling dendritic cell subsets in head and neck squamous cell tonsillar cancer and benign tonsils[J]. Sci Rep, 2018, 8(1): 8030. |
| [20] |
LU Y, GIVER C R, SHARMA A, et al. IFN-γ and indoleamine 2, 3-dioxygenase signaling between donor dendritic cells and T cells regulates graft versus host and graft versus leukemia activity[J]. Blood, 2012, 119(4): 1075-1085. DOI:10.1182/blood-2010-12-322891 |
| [21] |
MIYAZAKI M, AOKI M, OKADO Y, et al. Poorly differentiated clusters predict a poor prognosis for external auditory canal carcinoma[J]. Head Neck Pathol, 2019, 13(2): 198-207. |
 2020, Vol. 46
2020, Vol. 46


