扩展功能
文章信息
- 刘晶, 王景, 葛静, 冯艳萍, 房桂英, 王旭, 杨艳红, 李林
- LIU Jing, WANG Jing, GE Jing, FENG Yanping, FANG Guiying, WANG Xu, YANG Yanhong, LI Lin
- 宫颈癌HeLa细胞外泌体对细胞迁移和侵袭的影响及其Wnt/β-catenin信号通路机制
- Effect of HeLa cell exosomes on migration and invasion and its mechanism of Wnt/ β-catenin signaling pathway
- 吉林大学学报(医学版), 2020, 46(04): 798-803
- Journal of Jilin University (Medicine Edition), 2020, 46(04): 798-803
- 10.13481/j.1671-587x.20200421
-
文章历史
- 收稿日期: 2019-09-23
宫颈癌患者治疗失败及预后比较差的主要原因为宫颈癌的转移,但其侵袭转移的分子机制尚不十分清楚。外泌体为一种双层膜包裹的小囊泡,在生理和病理条件下由细胞释放到胞外[1]。研究[2-3]显示:外泌体携带包括mRNA、DNA、长链非编码RNA(LncRNAs)、微小RNA(microRNAs)、脂质和蛋白等一系列生物活性物质,在恶性肿瘤的侵袭、转移、血管生成和化疗耐药等过程中发挥重要作用。宫颈癌细胞来源外泌体也受到大家关注,易红艳等[4]通过差速超速离心法分离出宫颈癌Siha细胞外泌体,并发现Siha细胞外泌体可介导癌前细胞Ect1上皮间质转化,从而提高其侵袭能力。但宫颈癌HeLa细胞外泌体对其侵袭迁移的影响及可能机制尚未完全清楚。本文作者通过分离宫颈癌HeLa细胞外泌体,观察其对HeLa细胞迁移、侵袭及Wnt/β-连环蛋白(β-catenin)信号通路的影响,探讨宫颈癌细胞来源的外泌体对宫颈癌细胞的作用和可能机制。
1 材料与方法 1.1 细胞、主要试剂和仪器人宫颈癌HeLa细胞(ATCC细胞库)。FKH-26染剂和胰蛋白酶(美国Sigma公司),RPMI 1640培养基和胎牛血清(美国Hyclone公司),兔抗人CD63抗体、兔抗人CD81抗体、兔抗人Wnt1抗体、兔抗人β-catenin抗体和兔抗人T细胞因子4(T cell factor 4, TCF4)抗体(美国Abcam公司)。共聚焦显微镜(德国Leica公司),JEM-1400透射电子显微镜(日本电子公司),Transwell小室(美国Corning公司),Matrigel基质胶(美国BD公司)。
1.2 无外泌体血清制备和HeLa细胞培养将Hyclone胎牛血清100 000 g离心70 min,去除沉淀得到无外泌体胎牛血清。将HeLa细胞用无外泌体的胎牛血清配置的RPMI 1640培养基(含10%胎牛血清)培养。
1.3 HeLa细胞培养上清液中外泌体的收集将对数生长的HeLa细胞用胰蛋白酶消化,用无外泌体的胎牛血清配置的RPMI 1640培养基(含10%胎牛血清)培养48 h,收集HeLa细胞培养上清,500 g离心10 min,再12 000 g离心20 min,取上清液,经0.22 μm孔滤器过滤,过滤后100 000 g离心2 h,用磷酸盐缓冲液(PBS)液重悬沉淀,100 000 g离心2 h,沉淀用PBS液重悬即为HeLa细胞外泌体,保存备用。
1.4 电镜下观察外泌体形态表现将上述获得的沉淀用PBS(含2%多聚甲醛)重悬,吸取适量重悬液滴加到电镜用铜网上,干燥30 min,PBS液清洗,加入1%戊二醛固定5 min,蒸馏水冲洗,用0.4%醋酸双氧铀染色5 min,醋酸双氧铀和甲基纤维素混合物染色并包被10 min,晾10 min,透射电镜下拍照并观察外泌体形态表现。
1.5 Western blottig检测外泌体标志蛋白CD63和CD81蛋白表达情况取20 μL重悬的上述外泌体,加入蛋白裂解液10 μL,冰上裂解30 min,12 000 g离心20 min,收集上清液即为外泌体蛋白。取80 μg外泌体蛋白经电泳2 h,半干法转膜,脱脂奶粉封闭1 h,加入相应一抗(兔抗人CD63抗体、兔抗人CD81抗体,稀释比例1:1000),过夜孵育,以β-actin为内参。加入二抗孵育1 h,ECL显色,暗室曝光显影,每组设7个复孔,凝胶成像系统获得蛋白条带图片,采用Image J软件分析目标蛋白表达情况。
1.6 HeLa细胞摄取外泌体实验PKH-26为膜标记染料,可与外泌体脂膜结合并发出红色荧光,可用于外泌体存在的鉴定。将1 μLPKH-26染料与100 μL外泌体孵育,加入1 mLDiluent C,加入200 μL1% BSA/PBS,再加入3 μLPKH-26染料孵育20 min,100 000 g离心70 min,获得标记好的外泌体沉淀。将HeLa细胞置于12孔板中培养,达70%融合时更换为含标记好的外泌体的新鲜培养基孵育24 h,PBS清洗,多聚甲醛固定20 min,DAPI染色细胞核,共聚焦荧光显微镜下观察HeLa细胞摄取外泌体情况。
1.7 Transwell小室实验检测细胞侵袭能力用Matrigal胶包被Transwell小室上室。用无血清培养基饥饿培养HeLa细胞12 h,用胰蛋白酶消化细胞,1000 g离心5 min,PBS清洗,用含BSA的无血清培养基重悬HeLa细胞,调整HeLa细胞密度为1 × 105 mL-1,取200 μL细胞悬液加入Transwell小室的上室,并设外泌体组(Exo组)和对照组,Exo组细胞中加入20 μL外泌体悬液,对照组细胞中加入20 μL无血清培养基,每组设7个复孔。小室的下室加入去除外泌体的培养基,培养24 h后,棉签擦去基质胶及上室细胞,PBS冲洗,结晶紫染色,显微镜下观察并计算侵袭细胞数,代表细胞迁移能力。
1.8 细胞划痕实验测定细胞迁移能力在12孔板背后用记号笔均匀划3条平行横线,横线横穿过孔,间隔0.8 cm。调整对数生长的HeLa细胞密度为1 × 105 mL-1,在12孔板中加入HeLa细胞过夜孵育,24 h后用10 μL枪头垂直背后横线垂直划痕,PBS冲洗去除划下细胞,细胞分为Exo组和对照组,Exo组细胞总加入含外泌体悬液50 μL的无血清培养基,对照组细胞加入等量无血清培养基,置于培养箱中培养,分别于0 h和24 h拍照观察细胞迁移距离,代表细胞迁移能力。每组设7个复孔。
1.9 Western blotting检测细胞中Wnt1、β-catenin和TCF4蛋白表达水平将HeLa细胞分为Exo组和对照组,接种到培养皿中培养至细胞达80%以上融合时,更换培养基,Exo组细胞中加入含50 μL外泌体悬液的培养基,对照组加入50 μL不含外泌体的培养基培养,每组设7个复孔。24 h后提取各组细胞总蛋白,以兔抗人Wnt1、兔抗人β-catenin和兔抗人TCF4抗体为一抗,稀释比例为1:1000,采用Western blotting法检测细胞中Wnt1、β-catenin和TCF4蛋白表达水平,具体步骤见“1.6”。目的蛋白表达水平=目的蛋白条带灰度值/β-actin条带灰度值。
1.10 统计学分析采用SPSS20.0统计软件进行统计学分析。各组HeLa细胞中侵袭细胞数和迁移距离、细胞中Wnt1、β-catenin和TCF4蛋白表达水平符合正态分布,以x±s表示,2组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果 2.1 HeLa细胞来源外泌体鉴定透射电镜下观察:通过超速离心法获得HeLa细胞培养上清中有呈圆形或椭圆形、直径为40 ~ 100 nm的囊泡状小体。Western blotting法检测结果显示:囊泡状小体中富含CD63蛋白和CD81蛋白,表明HeLa细胞中分离的物质为外泌体。见图 1和图 2。

|
| A: Bar = 100 nm; B: Bar = 25 nm. 图 1 电镜下观察HeLa细胞来源外泌体形态表现 Fig. 1 Morphology of HeLa cells-derived exosomes observed under electron microscope |
|
|

|
| Lane 1:Control group; Lane 2:Exo group. 图 2 Western blotting法检测各组HeLa细胞来源外泌体中CD63和CD81蛋白表达电泳图 Fig. 2 Electrophoregram of expressions of CD63 and CD81 proteins in HeLa cells-derived exosomes detected by Western blotting method |
|
|
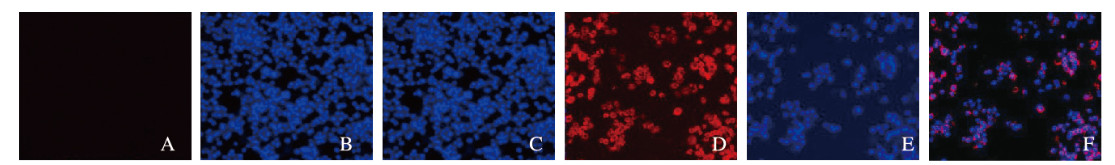
HeLa细胞外泌体采用PKH26荧光标记(PKH26染剂不影响外泌体特性,且可与外泌体膜结构稳定结合发出红色荧光),HeLa细胞用DAPI荧光进行核染色,培养24 h,共聚焦荧光显微镜观察,对照组HeLa细胞膜表面无标记外泌体附着,Exo组HeLa细胞膜表面有标记的外泌体附着。见图 3(插页七)。
|
| A—C:Control group; D—F: Exo group; A, D: PKH26; B, E:DAPI; C, F:Merg. 图 3 HeLa细胞外泌体的PKH26和DAPI荧光标记(×100) Fig. 3 PKH26 and DAPI fluorescence labeling of exosomes in HeLa cells (×100) |
|
|
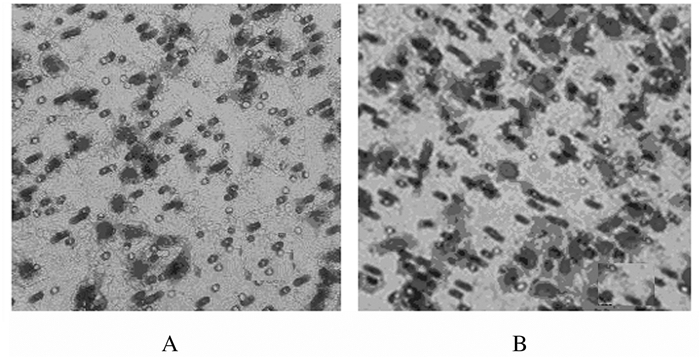
Transwell小室实验结果显示:与对照组比较,Exo组HeLa细胞中侵袭细胞数明显升高(P<0.01)。见图 4和表 1。
|
| A:Cotrol group; B:Exo group. 图 4 Transwell小室实验检测2组HeLa细胞侵袭能力(×200) Fig. 4 Invasion abilities of HeLa cells in two groups detected by Transwell chamber experiment (×200) |
|
|
| (n=7, x±s) | |||||||||||||||||||||||||||||
| Group | Number of invasion cells | Migration distance (l/μm) |
|||||||||||||||||||||||||||
| Control | 42.15±5.37 | 6.31±1.24 | |||||||||||||||||||||||||||
| Exo | 96.71±6.02 | 13.05±1.36 | |||||||||||||||||||||||||||
| t | 17.894 | 9.689 | |||||||||||||||||||||||||||
| P | <0.01 | <0.01 | |||||||||||||||||||||||||||
与对照组比较,Exo组HeLa细胞迁移距离明显增加(P<0.01)。见表 1和图 5。

|
| A, B:0 h; C, D:24 h; A, C:Control group; B, D:Exo group. 图 5 细胞划痕实验检测2组HeLa细胞迁移距离 Fig. 5 Migration distance of HeLa cells in two groups detected by cell scratch assay |
|
|
与对照组比较,Exo组HeLa细胞中Wnt1、β-catenin和TCF4蛋白表达水平均明显升高(P<0.01)。见表 2和图 6。
| Group | Wnt1 | β-catenin | TCF4 |
| Control | 0.13±0.03 | 0.11±0.02 | 0.18±0.05 |
| Exo | 0.42±0.05 | 0.48±0.06 | 0.56±0.12 |
| t | 13.159 | 15.478 | 7.734 |
| P | <0.01 | <0.01 | <0.01 |

|
| Lane 1:Control group; Lane 2:Exo group. 图 6 Western blotting法检测2组HeLa细胞中Wnt1、β-catenin和TCF4蛋白表达电泳图 Fig. 6 Electrophoregram of expressions of Wnt1, β-catenin and TCF4 proteins in HeLa cells detected by Western blotting method |
|
|
外泌体是一种细胞外囊泡,直径为50~140 nm,由细胞经过内吞、融合-外排等调控过程形成;外泌体通过携带蛋白质、核酸等生物活性小分子在细胞之间进行信号传递[5]。外泌体可从各种体液、细胞培养液上清中分离,其功能和组成由其细胞来源决定[6]。外泌体在恶性肿瘤微环境中含量非常丰富,在恶性肿瘤的侵袭和转移中发挥重要作用[7]。如肿瘤来源的外泌体增强涎腺腺样囊性癌细胞的侵袭和转移[8],M2巨噬细胞来源的外泌体促进结肠癌细胞迁移和侵袭[9],食管癌细胞来源外泌体促进食管癌细胞的迁移和侵袭能力[10],胰腺癌外泌体促进肿瘤转移[11]。本研究采用超速离心法成功分离得到宫颈癌HeLa细胞外泌体,并发现HeLa细胞来源外泌体可促进HeLa细胞本身侵袭和迁移能力,表明宫颈癌HeLa细胞外泌体在其自身侵袭和迁移过程中也发挥重要作用,但其作用机制尚不清楚。
为探讨宫颈癌HeLa细胞外泌体在宫颈癌HeLa细胞侵袭和迁移中的作用机制,本文作者对HeLa细胞中Wnt/β-catenin信号通路及其下游基因进行研究,结果显示:宫颈癌HeLa细胞来源外泌体可升高HeLa细胞中Wnt1、β-catenin和TCF4蛋白表达水平。Wnt/β-catenin信号通路在恶性肿瘤细胞的侵袭和迁移中发挥重要作用,宫颈癌的侵袭迁移与Wnt/β-catenin信号通路关系密切[11-12]。β-catenin在细胞中以游离型和结合型两种形式存在,结合型β-catenin通过与上皮钙黏蛋白结合调节恶性肿瘤细胞之间的黏附;游离型β-catenin通过Wnt信号通路作用于恶性肿瘤细胞核内的转录因子淋巴增强因子/T细胞因子(LEF/TCF)在恶性肿瘤的发生发展过程中发挥重要作用[13-14]。Wnt/β-catenin信号通路的激活机制比较复杂,在Wnt蛋白缺失的情况下,细胞中的β-catenin被磷酸化,磷酸化的β-catenin由蛋白酶降解,因此在细胞内保持比较低的水平;在Wnt蛋白存在的条件下,β-catenin磷酸化水平低,导致胞内β-catenin大量积累,随后进入细胞核中,可在细胞核中与LEF/TCF形成复合物,调控相关基因表达,参与恶性肿瘤细胞的侵袭和迁移过程[15-16]。TCF家族为Wnt信号通路的分子开关,在恶性肿瘤的侵袭和转移中发挥重要作用,尤其是TCF4与恶性肿瘤的发生发展有密切关联[17-18]。在宫颈癌中Wnt/β-catenin信号通路激活,Wnt1和β-catenin蛋白表达水平升高,其下游的TCF4蛋白表达水平也升高。外泌体可通过Wnt/β-catenin信号通路发挥生物学作用,如脂肪来源间充质干细胞外泌体通过Wnt /β-catenin信号通路保护心肌免受缺血/再灌注损伤[19];缺氧结直肠癌细胞来源外来体通过Wnt/β-catenin信号传导促进血管生成[20];骨髓间充质干细胞来源外泌体通过Wnt/β-catenin途径促进胃癌进展[21]。本研究中宫颈癌HeLa细胞来源外泌体可升高HeLa细胞中Wnt1、β-catenin和TCF4蛋白表达水平,表明宫颈癌HeLa细胞来源外泌体可能通过促进Wnt/β-catenin信号通路及其下游的TCF4基因抑制宫颈癌细胞的侵袭和迁移过程。
综上所述,宫颈癌HeLa细胞来源的外泌体可促进宫颈癌细胞的侵袭和迁移能力,其机制可能与HeLa细胞来源外泌体可促进Wnt /β-catenin信号通路的激活及下游TCF4基因的表达有关。
| [1] |
THEODORAKI M N, YERNENI S S, BRUNNER C, et al. Plasma-derived exosomes reverse epithelial-to-mesenchymal transition after photodynamic therapy of patients with head and neck cancer[J]. Oncoscience, 2018, 5(3/4): 75-87. |
| [2] |
SHTAM T, NARYZHNY S, SAMSONOV R, et al. Plasma exosomes stimulate breast cancer metastasis through surface interactions and activation of FAK signaling[J]. Breast Cancer Res Treat, 2019, 174(1): 129-141. |
| [3] |
张晓航, 张淑雯, 宁永玲, 等. 肿瘤细胞外泌体在肿瘤免疫中的作用[J]. 中国免疫学杂志, 2017, 33(2): 305-307. DOI:10.3969/j.issn.1000-484X.2017.02.031 |
| [4] |
易红艳, 周琛斐, 梁莉, 等. 宫颈癌细胞分泌外泌体介导上皮-间质转化提高癌前细胞侵袭能力的体外研究[J]. 现代妇产科进展, 2017, 26(3): 165-168. |
| [5] |
MIN H, SUN X, YANG X, et al. Exosomesderived from irradiated esophagealcarcinoma-infiltrating T cells promote metastasis by inducing the epithelial-mesenchymal transition in esophageal cancer cells[J]. Pathol Oncol Res, 2018, 24(1): 11-18. DOI:10.1007/s12253-016-0185-z |
| [6] |
HUANG Z, YANG M, LI Y, et al. Exosomes derived from hypoxic colorectal cancer cells transfer wnt4 to normoxic cells to elicit a prometastatic phenotype[J]. Int J Biol Sci, 2018, 14(14): 2094-2102. DOI:10.7150/ijbs.28288 |
| [7] |
KIM R, LEE S, LEE J, et al. Exosomesderived from microRNA-584 transfected mesenchymal stem cells:novel alternative therapeutic vehicles forcancertherapy[J]. BMB Rep, 2018, 51(8): 406-411. DOI:10.5483/BMBRep.2018.51.8.105 |
| [8] |
HOU J, WANG F Y, LIU X H, et al. Tumor-derived exosomes enhance invasion and metastasis of salivary adenoid cystic carcinoma cells[J]. J Oral Pathol Med, 2018, 47(2): 144-151. |
| [9] |
LAN J, SUN L, XU F, et al. M2 macrophage-derived exosomes promote cell migration and invasionin colon cancer[J]. Cancer Res, 2019, 79(1): 146-158. |
| [10] |
林锋, 王海娟, 李春晓, 等. 食管癌细胞来源的外泌体对肿瘤细胞迁移及侵袭能力的影响及机制研究[J]. 解放军医学杂志, 2017, 42(4): 307-313. |
| [11] |
YU Z Q, ZHAO S S, REN L, et al. Pancreatic cancer-derived exosomes promote tumor metastasis and liver pre-metastatic niche formation[J]. Oncotarget, 2017, 8(38): 63461-63483. DOI:10.18632/oncotarget.18831 |
| [12] |
WANG CH, LI YH, TIAN HL, et al. Long non-coding RNA BLACAT1 promotes cell proliferation, migration and invasion in cervical cancer through activation of Wnt/β-catenin signaling pathway[J]. Eur Rev Med Pharmacol Sci, 2018, 22(10): 3002-3009. |
| [13] |
LI F, WANG T, TANG S. SOX14 promotes proliferation and invasion of cervical cancer cells through Wnt/β-catenin pathway[J]. Int J Clin Exp Pathol, 2015, 8(2): 1698-1704. |
| [14] |
WANG Y, JIANG M, YAO Y, et al. WWC3 inhibits glioma cell proliferation through suppressing the Wnt/β-Catenin signaling pathway[J]. DNA Cell Biol, 2018, 37(1): 31-37. DOI:10.1089/dna.2017.3931 |
| [15] |
GU J, CUI C F, YANG L, et al. Emodin inhibits colon cancer cell invasion and migration by suppressing epithelial-mesenchymal transition via the Wnt/β-catenin pathway[J]. Oncol Res, 2019, 27(2): 193-202. |
| [16] |
ZHANG H, HAN X, WEI B, et al. RSPO2 enhances cellinvasionand migration via theWnt/β-cateninpathway in human gastriccancer[J]. J Cell Biochem, 2019, 120(4): 5813-5824. DOI:10.1002/jcb.27867 |
| [17] |
ZHENG H E, WANG G, SONG J, et al. MicroRNA-495 inhibits the progression of non-small-cell lungcancerby targetingTCF4 and inactivatingWnt/β-cateninpathway[J]. Eur Rev Med Pharmacol Sci, 2018, 22(22): 7750-7759. |
| [18] |
SUN J, LI B, JIA Z, et al. RUNX3 inhibits glioma survival andinvasionvia suppression of the β-catenin/TCF-4 signaling pathway[J]. J Neurooncol, 2018, 140(1): 15-26. DOI:10.1007/s11060-018-2927-0 |
| [19] |
CUI X J, HE Z Y, LIANG Z H, et al. Exosomes from adipose-derived mesenchymal stem cells protect the myocardium against ischemia/reperfusion injury through Wnt/β-catenin signaling pathway[J]. J Cardiovasc Pharmacol, 2017, 70(4): 225-231. DOI:10.1097/FJC.0000000000000507 |
| [20] |
HUANG Z, FENG Y. Exosomes derived from hypoxic colorectal cancer cells promote angiogenesis through Wnt4-induced β-cateninsignaling in endothelial cells[J]. Oncol Res, 2017, 25(5): 651-661. |
| [21] |
MAO J H, LIANG Z F, ZHANG B, et al. UBR2 enriched in p53 deficient mouse bone marrow mesenchymal stem cell-exosome promoted gastric cancer progression via wnt/β-catenin pathway[J]. Stem Cells, 2017, 35(11): 2267-2279. DOI:10.1002/stem.2702 |
 2020, Vol. 46
2020, Vol. 46


