扩展功能
文章信息
- 闻颖, 吴巧玲, 刘国利
- WEN Ying, WU Qiaoling, LIU Guoli
- 舒芬太尼后处理通过ERK1/2介导的p70S6K信号通路对大鼠心肌缺血再灌注损伤的保护作用
- Protective effect of sufentanil post-conditioningthrough ERK1/2-mediated p70S6K signaling pathway on myocardial ischemia-reperfusion injuryof rats
- 吉林大学学报(医学版), 2020, 46(04): 792-797
- Journal of Jilin University (Medicine Edition), 2020, 46(04): 792-797
- 10.13481/j.1671-587x.20200420
-
文章历史
- 收稿日期: 2019-11-24
2. 锦州医科大学附属第一医院麻醉科, 辽宁 锦州 121000
2. Department of Anesthesiology, First Affiliated Hospital, Jinzhou Medical University, Jinzhou 121000, China
心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury,MIRI)是指由缺血和恢复进入先前缺血组织的血流引起的对心肌的损伤。再灌注后,心肌超微结构、功能、代谢和电生理特征进一步受损,出现血压突然下降、心率下降甚至猝死[1-2]。MIRI可对心肌细胞造成不可逆的损伤,并降低细胞活性。目前公认MIRI的主要机制包括释放过量的钙、释放炎症因子和细胞凋亡[3]。已有研究[4-8]证实:MIRI诱导细胞凋亡是急性MIRI的主要形式。目前,已经鉴定出3种调节细胞凋亡的信号转导途径,包括线粒体途径、死亡受体途径和内质网应激(endoplasmic reticulum stress,ERS)途径[9]。
促活化激酶信号级联途径包括磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B,PI3K/Akt)和细胞外信号激酶1/2(extracellular-signal regulated kinase,ERK1/2),在缺血再灌注损伤(ischemia/reperfusion injury,I/R)过程中该途径被激活,可以保护心脏免受再灌注损伤[10]。p70核糖体蛋白S6激酶(p70 ribosomal protein S6 kinase, p70S6K)是一种属于环磷酸腺苷(cAMP)和环磷酸鸟苷(cGMP)依赖性蛋白激酶家族的激酶[11],在多种细胞过程中发挥重要作用,包括蛋白质合成、mRNA加工、葡萄糖稳态、细胞生长和存活[12]。p70S6K作为ERK信号通路的下游靶点,控制着翻译元件的生物合成,参与蛋白质合成[13]。
舒芬太尼(sufentanil,Sufen)是一种特异性的μ-阿片受体激动剂,具有强大的脂溶性和对人体血浆蛋白的高附着率,具有强大的镇痛作用,常用于心脏手术患者。研究[14]显示:舒芬太尼在I/R心肌损害中发挥重要作用,但是目前有关ERK1/2介导的p70S6K信号通路对大鼠I/R的保护机制研究较少。本研究通过构建大鼠MIRI模型,探讨舒芬太尼对大鼠MIRI的保护作用机制,为临床应用舒芬太尼提供理论依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器SPF级SD雄性大鼠72只,体质量200~250 g,由锦州医科大学动物部提供,动物生产许可证号:SCXK(京) 2014-0010,在温度(20±2)℃、相对湿度(55±5)%条件下饲养。所有实验动物在实验过程中严格遵循实验动物的护理和使用指南。舒芬太尼注射液(宜昌人福药业有限责任公司),戊巴比妥钠(上海泰瑞尔生物技术有限公司),二甲基亚砜(DMSO)和ERK抑制剂PD98059(美国Sigma公司),磷酸化ERK(p-ERK)小鼠多克隆抗体和磷酸化p70S6K(p-p70S6K)小鼠多克隆抗体(美国Cell Signaling公司),HRP标记山羊抗小鼠二抗(江苏碧云天生物技术研究所)。ALC-v8d动物呼吸机(上海奥尔科特有限公司),监护仪M3046A(美国Philips公司)。
1.2 大鼠MIRI模型的制备大鼠腹腔内注射戊巴比妥钠50 mg·kg-1麻醉及500 U·kg-1肝素化后,取仰卧位固定四肢,连接皮下电极连续监测标准Ⅱ导联心电图,颈部正中分离气管并切开气管进行插管,用动物呼吸麻醉机进行机械通气,潮气量设为2 mL·100 g-1,通气频率70 min-1。右颈总动脉插入24号套管针连接压力换能器,持续监测平均动脉压(mean arterial blood pressure,MAP)和心率(heart rate,HR),左侧颈内静脉置管作为药物输液通道,使用加热毯将体温维持在(36.5±1.0)℃。于胸骨左缘打开胸腔并剪开心包膜,暴露心脏,以左冠状静脉主干为标志,以6.0的无损伤缝合线在左心耳下方1~2 mm作线结,针深约1.5 mm,于肺动脉圆锥与左心耳之间出针,将直径为2 mm长度为0.5 cm的聚乙烯管套于线的末端,同时以持针器夹紧缝合线造成缺血和松开缝合线模拟再灌注。将结扎后心电图ST段明显升高、结扎线远端心肌颜色苍白作为心肌缺血的标志,释放后最初苍白区域的充血反应是再灌注成功的标志。
1.3 实验分组72只SD雄性大鼠随机分为6组,每组12只。假手术组:大鼠手术时只挂线不结扎,持续灌注150 min;缺血再灌注组(I/R组):缺血30 min,再灌注120min;DMSO组:制备大鼠心脏I/R模型,于再灌注前5 min给予<0.2%的DMSO;舒芬太尼后处理组(Sufen组):于再灌注前3 min给予1 μg·kg-1舒芬太尼(用生理盐水稀释至1 mL舒芬太尼注射液);PD组:再灌注前5min给予20 μmol·L-1 PD98059(1.0 g PD98059溶于150 mL DMSO中);PD98059+舒芬太尼后处理组(PD+Sufen组):于再灌注前3和5 min分别给予1 μg·kg-1舒芬太尼和20 μmol·L-1 PD98059。
1.4 血流动力学指标检测大鼠右颈总动脉插入24号套管针连接压力换能器,于缺血前即刻(T0)和再灌注30 min(T1)、60 min(T2)、90 min(T3)、2h(T4)持续监测MAP和HR。
1.5 大鼠心肌梗死面积检测于再灌注2h后迅速取出大鼠心脏,用心脏分割器分割为5~6块,切成2 mm厚组织。分割后的心脏置于1% 2,3,5氯化三苯基四氮唑(TTC)中振荡染色,避光恒温孵育20 min。PBS缓冲液冲洗后使用10%甲醛固定24h,观察心肌梗死范围。梗死区为灰白色,非梗死区为砖红色,使用Alpha View凝胶图像分析系统分析。心肌缺血面积以缺血区心肌质量/左室质量(AAR/LV)表示,心肌梗死面积以梗死区心肌质量/缺血区心肌质量(IS/AAR)表示。
1.6 Western blotting法检测大鼠心肌组织中p-ERK1/2和p-p70S6K蛋白表达水平取约300 mg大鼠左心室,剪碎,加入细胞裂解液和蛋白酶抑制剂(PMSF),低温下超声细胞破碎仪裂解3次。取上清的心肌组织提取液,使用BCA进行蛋白定量,每组取30 μg蛋白上样,进行SDS聚丙烯酰胺凝胶电泳。一抗为p-ERK1、p-ERK2和p-p70S6K。二抗为HRP标记山羊抗小鼠二抗,用ECL发光法检测目的蛋白表达水平。以GAPDH作为内参校正上样误差,凝胶成像仪拍照。Image J软件进行灰度分析,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH条带灰度值。
1.7 统计学分析采用Graph Pad Prism 4.0统计软件进行统计学分析。各组大鼠MAP、HR、心肌梗死面积和心肌组织中ERK1/2和p70S6K蛋白表达水平均符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果 2.1 不同时间各组大鼠MAP和HR与T0时比较,T1~T4时I/R组、Sufen组、DMSO组、PD组和PD+Sufen组大鼠MAP和HR均明显降低(P<0.05)。与假手术组比较,T1~T4时其他各组大鼠MAP和HR均降低(P<0.05);与I/R组比较,T3时Sufen组大鼠MAP降低(P<0.05),HR明显升高(P<0.05),其余时间点各组大鼠MAP和HR差异均无统计学意义(P>0.05)。见表 1。
| (n=6, x±s) | |||||||||||||||||||||||||||||
| Group | MAP(P/mmHg) | HR(beat·min-1) | |||||||||||||||||||||||||||
| T0 | T1 | T2 | T3 | T4 | T0 | T1 | T2 | T3 | T4 | ||||||||||||||||||||
| Sham | 118±5 | 113±5 | 108±4 | 104±3 | 101±2 | 382±30 | 386±27 | 396±29 | 392±13 | 390±21 | |||||||||||||||||||
| I/R | 112±4 | 105±3*△ | 99±3*△ | 94±2*△ | 84±2*△ | 392±27 | 350±30*△ | 330±23*△ | 311±25*△ | 302±32*△ | |||||||||||||||||||
| Sufen | 115±5 | 110±4*△ | 101±3*△ | 98±3*△# | 90±2*△ | 376±17 | 360±26*△ | 342±30*△ | 333±18*△# | 310±25*△ | |||||||||||||||||||
| DMSO | 116±5 | 112±4 | 100±3*△ | 96±3*△ | 89±2*△ | 380±29 | 354±31*△ | 331±17*△ | 320±25*△ | 304±28*△ | |||||||||||||||||||
| PD | 113±5 | 106±3 | 97±3*△ | 92±2*△ | 88±2*△ | 400±36 | 356±25*△ | 332±24*△ | 312±23*△ | 301±28*△ | |||||||||||||||||||
| PD+Sufen | 109±4 | 104±4 | 100±2*△ | 94±3*△ | 87±3*△ | 395±27 | 372±30*△ | 330±25*△ | 315±21*△ | 317±30*△ | |||||||||||||||||||
| *P<0.05 compared with T0; △P<0.05 compared with sham group; #P<0.05 compared with I/R group. | |||||||||||||||||||||||||||||
与I/R组比较,Sufen组大鼠心肌梗死面积明显减少(P<0.05);与Sufen组比较,PD组和PD+Sufen组大鼠心肌梗死面积明显增加(P<0.05);I/R组、DMSO组、PD组和PD+Sufen组大鼠心肌梗死面积组间比较差异无统计学意义(P>0.05)。见表 2。
| (n=6, x±s, η/%) | |||||||||||||||||||||||||||||
| Group | ARR/LV | IS/ARR | |||||||||||||||||||||||||||
| I/R | 56.30±9.82 | 45.67±10.32 | |||||||||||||||||||||||||||
| Sufen | 54.50±6.50 | 20.92±6.88* | |||||||||||||||||||||||||||
| DMSO | 58.47±6.02 | 34.45±11.02 | |||||||||||||||||||||||||||
| PD | 56.57±9.78 | 43.12±6.01△ | |||||||||||||||||||||||||||
| PD+Sufen | 55.63±7.23 | 42.14±6.73△ | |||||||||||||||||||||||||||
| *P<0.05 compared with I/R group;△P<0.05 compared with Sufen group. | |||||||||||||||||||||||||||||
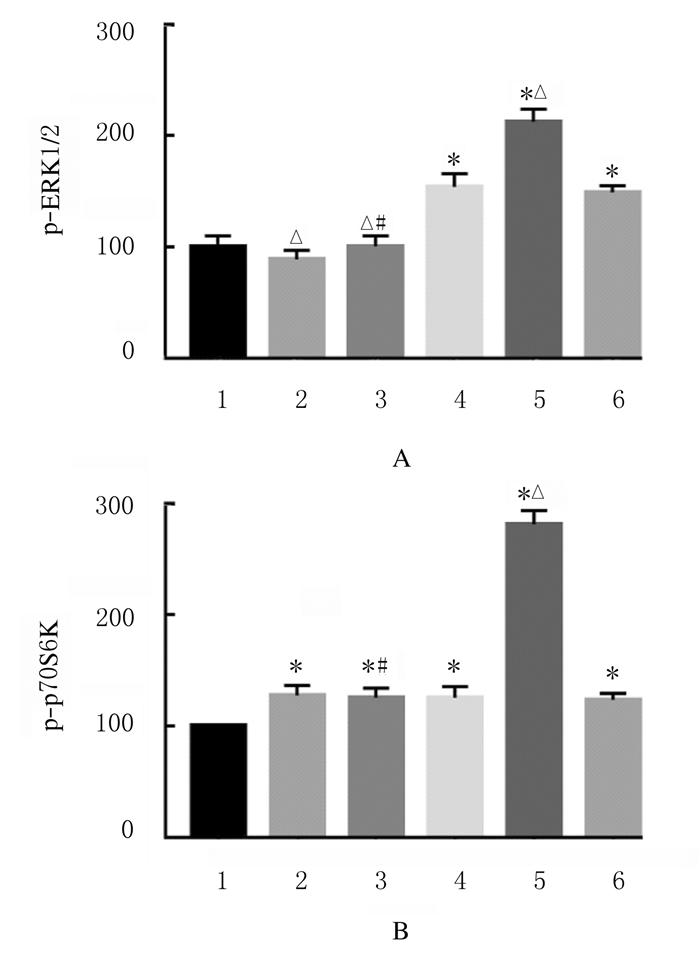
与假手术组比较,I/R组、Sufen组和DMSO组大鼠心肌组织中p-ERK1/2蛋白表达水平及PD组、PD+Sufen组、I/R组、Sufen组和DMSO组大鼠心肌组织中p-p70S6K蛋白表达水平均明显升高(P<0.05);与I/R组比较,Sufen组大鼠心肌组织中p-ERK1/2和p-p70S6K蛋白表达水平均进一步升高(P<0.05),PD组和PD+Sufen组大鼠心肌组织中p-ERK1/2蛋白表达水平降低(P<0.05);与Sufen组比较,PD+Sufen组大鼠心肌组织中p-p70S6K和p-ERK1/2蛋白表达水平均明显降低(P<0.05)。见图 1和图 2。

|
| Lane 1: Sham group; Lane 2: PD group; Lane 3: PD+Sufen group; Lane 4:I/R group; Lane 5: Sufen group; Lane 6:DMSO group. 图 1 各组大鼠心肌组织中p-ERK1/2和p-p70S6K蛋白表达电泳图 Fig. 1 Electrophoregram of expressions of p-ERK1/2 and p-p70S6K proteins in myocardium tissue of rats in various groups |
|
|
|
| 1: Sham group; 2: PD group; 3: PD+Sufen group; 4:I/R group; 5: Sufen group; 6:DMSO group.*P < 0.05 compared with Sham group; △P < 0.05 compared with I/ R group; #P < 0.05 compared with Sufen group. 图 2 各组大鼠心肌组织中p-ERK1/2(A)和p-p70S6K(B)蛋白表达水平 Fig. 2 Expression levels of p-ERK1/2(A) and p-p70S6K(B) proteins in myocardium tissue of rats in various groups |
|
|
心肌缺血再灌注是急性心力衰竭的主要原因。MIRI后不完全修复和纤维组织增生可导致持续性心肌损伤,并逐渐发展为慢性心力衰竭,对人体健康造成严重危害[15]。已有研究[16]表明:舒芬太尼在心肌缺血再灌注中可以特异性地保护心肌功能。舒芬太尼后处理对MIRI的保护作用一直是研究的热点,但其机制复杂,存在很多争议。本实验构建了MIRI大鼠模型,测定大鼠心肌缺血再灌注末的心功能指标和心肌梗死范围,结果显示:Sufen组大鼠MAP、HR均高于I/R组,心肌梗死范围低于I/R组,舒芬太尼后处理能够改善大鼠心功能指标,减少MIRI后的心肌梗死面积,表明舒芬太尼对MIRI后的心肌具有保护作用;与I/R组比较,PD+Sufen组大鼠MAP、HR及心肌梗死面积差异无统计学意义,表明作为ERK抑制剂的PD98059抑制了舒芬太尼后处理的心肌保护作用,也证明了舒芬太尼后处理的保护作用机制与ERK信号通路有关。
研究[17]显示:舒芬太尼可以通过ERK1/2信号通路途径实现对MIRI的保护作用。在正常心肌细胞中ERK1/2呈低表达,但是当受到I/R刺激时,ERK1/2被激活并表达上调。本研究结果显示:与假手术组比较,I/R组大鼠心肌组织中p-ERK1/2蛋白表达水平明显升高,而Sufen组大鼠心肌组织中p-ERK1/2蛋白表达水平进一步高于I/R组,表明舒芬太尼后处理通过增加p-ERK1/2的表达激活ERK信号通路进而发挥对MIRI后大鼠心肌的保护作用;而PD+Sufen组大鼠心肌组织中p-ERK1/2蛋白表达水平明显低于Sufen组,表明给予PD98059后其心肌保护作用消失,进一步说明舒芬太尼后处理通过激活ERK信号通路发挥对大鼠的心肌保护作用。
吴宥熹等[18]研究证明:荭草苷在大鼠缺血再灌注模型中对心肌的保护作用是通过ERK调节其下游靶点p70S6K的表达实现的。张静等[19]证实:七氟醚后处理可能通过p70S6K参与了心肌保护作用。CHEN等[20]证实:可以通过激活p70S6K减轻MIRI。p-p70S6K是ERK信号通路的下游靶点,参与合成蛋白质。本研究结果显示:大鼠心肌组织中p-p70S6K蛋白表达水平随着p-ERK1/2表达水平的升高而升高,且与I/R组比较,Sufen组大鼠心肌组织中p-p70S6K蛋白表达水平明显升高,说明p70S6K的磷酸化依赖于ERK信号通路的激活,同时PD能抑制p70S6K的活性。作为ERK1/2的抑制剂,PD能完全抑制ERK1/2的磷酸化,却不能有效抑制p70S6K的磷酸化,可能还存在其他的信号通路调节p70S6K的磷酸化。
综上所述,舒芬太尼后处理激活ERK1/2信号通路,使ERK1/2磷酸化,进一步促进p70S6K的磷酸化,舒芬太尼后处理通过ERK1/2介导的p70S6K信号通路对MIRI大鼠心肌细胞起保护作用。
| [1] |
GOLDHABER J I, WEISS J N. Oxygen free radicals and cardiac reperfusion abnormalities[J]. Hypertension, 1992, 20(1): 118-127. |
| [2] |
HU Q, CHEN J, JIANG C, et al. Effect of peroxisome proliferator-activated receptor gamma agonist on heart of rabbits with acute myocardial ischemia/reperfusion injury[J]. Asian Pac J Trop Med, 2014, 7(4): 271-275. DOI:10.1016/S1995-7645(14)60036-5 |
| [3] |
MUNTEAN D M, STURZA A, DÃNILÃ M D, et al. The role of mitochondrial reactive oxygen species in cardiovascular injury and protective strategies[J]. Oxid Med Cell Longev, 2016, 2016: 8254942. |
| [4] |
XIA P, LIU Y N, CHENG Z K. Signaling pathways in cardiac myocyte apoptosis[J]. Biomed Res Int, 2016, 2016: 9583268. |
| [5] |
HAUNSTETTER A, IZUMO S. Apoptosis:basic mechanisms and implications for cardiovascular disease[J]. Circ Res, 1998, 82(11): 1111-1129. |
| [6] |
BAINES C P, MOLKENTIN J D. STRESS signaling pathways that modulate cardiac myocyte apoptosis[J]. J Mol Cell Cardiol, 2005, 38(1): 47-62. DOI:10.1016/j.yjmcc.2004.11.004 |
| [7] |
BERNECKER O Y, HUQ F, HEIST E K, et al. Apoptosis in heart failure and the senescent heart[J]. Cardiovasc Toxicol, 2003, 3(3): 183-190. |
| [8] |
MATTSON M P, KROEMER G. Mitochondria in cell death:novel targets for neuroprotection and cardioprotection[J]. Trends Mol Med, 2003, 9(5): 196-205. DOI:10.1016/S1471-4914(03)00046-7 |
| [9] |
RAO R V, ELLERBY H M, BREDESEN D E. Coupling endoplasmic reticulum stress to the cell death program[J]. Cell Death Differ, 2004, 11(4): 372-380. |
| [10] |
HAUSENLOY D J, YELLON D M. New directions for protecting the heart against ischaemia-reperfusion injury:targeting the Reperfusion Injury Salvage Kinase (RISK)-pathway[J]. Cardiovasc Res, 2004, 61(3): 448-460. |
| [11] |
PEARCE L R, KOMANDER D, ALESSI D R. The nuts and bolts of AGC protein kinases[J]. Nat Rev Mol Cell Biol, 2010, 11(1): 9-22. |
| [12] |
FENTON T R, GOUT I T. Functions and regulation of the 70kDa ribosomal S6 kinases[J]. Int J Biochem Cell Biol, 2011, 43(1): 47-59. DOI:10.1016/j.biocel.2010.09.018 |
| [13] |
CHEN G Z, SHAN X Y, LI X S, et al. Remote ischemic postconditioning protects the brain from focal ischemia/reperfusion injury by inhibiting autophagy through the mTOR/p70S6K pathway[J]. Neurol Res, 2018, 40(3): 182-188. DOI:10.1080/01616412.2018.1424696 |
| [14] |
ZHAI Y F, AO L H, CLEVELAND J C, et al. Toll-like receptor 4 mediates the inflammatory responses and matrix protein remodeling in remote non-ischemic myocardium in a mouse model of myocardial ischemia and reperfusion[J]. PLoS One, 2015, 10(3): e0121853. DOI:10.1371/journal.pone.0121853 |
| [15] |
SHIRAKAWA M, IMURA H, NITTA T. Propofol protects the immature rabbit heart against ischemia and reperfusion injury:impact on functional recovery and histopathological changes[J]. Biomed Res Int, 2014, 2014: 601250. |
| [16] |
WANG X H, ZENG J F, LIN C, et al. Effects of morphine and sufentanil preconditioning against myocardial ischemic-reperfusion injury in rabbits[J]. Int J Clin Exp Med, 2015, 8(9): 15692-15699. |
| [17] |
陶慧.舒芬太尼通过ERK1/2信号通路对心肌缺血/再灌注损伤保护作用的机制研究[D].重庆: 重庆医科大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10631-1018863649.htm
|
| [18] |
吴宥熹, 徐俊, 刘立亚, 等. PI3K-Akt-mTOR信号通路介导的细胞自噬在荭草苷抗大鼠心肌缺血再灌注损伤中的作用研究[J]. 时珍国医国药, 2017, 28(1): 20-24. |
| [19] |
张静, 余鹏, 华福洲, 等. ERK1/2介导的p70S6K信号通路在七氟醚后处理离体大鼠缺血-再灌注损伤中的作用[J]. 临床麻醉学杂志, 2015, 31(7): 697-701. |
| [20] |
CHEN G H, XU C S, ZHANG J, et al. Inhibition of miR-128-3p by Tongxinluo protects human cardiomyocytes from ischemia/reperfusion injury via upregulation of p70s6k1/p-p70s6k1[J]. Front Pharmacol, 2017, 8: 775. DOI:10.3389/fphar.2017.00775 |
 2020, Vol. 46
2020, Vol. 46


