扩展功能
文章信息
- 张爽爽, 贺武斌, 苏荣健, 杜晓媛
- ZHANG Shuangshuang, HE Wubin, SU Rongjian, DU Xiaoyuan
- EZH2抑制剂GSK126对肺腺癌细胞增殖和凋亡的影响
- Effects of EZH2 inhibitor GSK126 on proliferation and apoptosis of lung adenocarcinoma cells
- 吉林大学学报(医学版), 2020, 46(04): 786-791
- Journal of Jilin University (Medicine Edition), 2020, 46(04): 786-791
- 10.13481/j.1671-587x.20200419
-
文章历史
- 收稿日期: 2019-10-21
2. 锦州医科大学附属第一医院, 辽宁 锦州 121001;
3. 锦州医科大学基础医学院细胞生物学教研室, 辽宁 锦州 121000
2. First Affiliated Hospital, Jinzhou Medical University, Jinzhou 121001, China;
3. Department of Cell Biology, School of Basic Medical Sciences, Jinzhou Medical University, Jinzhou 121000, China
随着发病率和死亡率的不断升高,肺癌已成为对人类健康有巨大威胁的恶性肿瘤之一,位居中国男性恶性肿瘤发病率和死亡率首位,女性发病率和死亡率第2位[1]。组蛋白甲基转移酶zeste基因增强子同源物2(zeste gene enhancer homolog 2,EZH2)在人类癌症中高度扩增,并与癌症的发展有密切关联[2-3]。研究[4-6]已证明:EZH2的过表达是肿瘤的一个预后不良指标,上调EZH2表达水平可以促进子宫内膜癌、乳腺癌和结肠癌等细胞的增殖与侵袭。在肺癌组织中,EZH2过表达与肺肿瘤大小和不良预后有关联[7],EZH2可通过调控wnt/β-连环蛋白信号通路促进其增殖[8]。由于EZH2在肿瘤生长与转移中的作用,EZH2抑制剂的研究逐渐深入。GSK2816126(GSK126)是一种新型的选择性酶活性抑制剂,通过抑制EZH2组蛋白甲基转移酶的功能,降低细胞内H3K27me3水平,从而发挥其靶向EZH2的抗肿瘤作用[9]。已有研究[10-11]表明:GSK126对膀胱癌、前列腺癌、神经母细胞瘤、胶质细胞瘤和卵巢癌等具有抑制作用。在小细胞肺癌中GSK126可以抑制Y样染色体基因(chromodomain Y like)/ EZH2/周期蛋白依赖性激酶1C(cyclin-dependent kinase inhibitor 1C)(CDYL/EZH2/CDKN1C)轴促进的化疗耐药性[12]。GSK126还可增强尼美舒利和硼替佐米对非小细胞肺癌的联合治疗作用[13]。目前,GSK126在肺癌方面的研究仍较缺乏,因此本研究将对EZH2抑制剂GSK126对肺腺癌细胞A549增殖与凋亡的影响进行初步探讨,以期为肺癌的治疗提供新的途径。
1 材料与方法 1.1 细胞、主要试剂和仪器人肺腺癌A549细胞由北京生命科学研究院惠赠。GSK126粉末(美国Selleck生物科技有限公司),DMSO(北京索莱宝科技有限公司),MTT试剂(北京博奥拓达科技有限公司),EdU试剂盒(广州锐博生物科技有限公司),FITC AnnexinV-7-AAD试剂盒(美国Biolegend公司),蛋白激酶B(proteinkinase B, AKT)、磷酸化AKT(p-AKT)、天冬氨酸特异性半胱氨酸蛋白酶3(Caspase-3)及HRP标记的二抗和β-actin抗体(美国CST公司),B细胞淋巴瘤-2原癌基因(B-cell lymphoma-2, Bcl-2)、Bcl-2相关X蛋白(Bcl-2associted X protein, Bax)和活化型Caspase-3(Cleaved-Caspase-3)(上海爱必信生物科技公司),ECL发光试剂(上海碧云天有限公司)。Western blotting电泳设备(美国Bio-Rad Laboratories公司),全自动酶标仪(美国Bio-Tek公司),流式细胞仪(美国BD公司)。
1.2 细胞培养人肺腺癌A549细胞于含10%胎牛血清和1%青链霉素的RPMI-1640培养基中,常规培养于37℃、含5% CO2的孵箱中。当细胞长满皿底80%~90%时进行消化传代,每2~3 d传代1次。
1.3 MTT实验检测细胞存活率取生长状态良好的A549细胞,胰酶消化后按每孔5 000个细胞的密度接种于96孔板中,12 h后分为对照组和不同浓度GSK126组,分别用浓度为0、1.0、2.5、5.0、10.0和15.0 μmol·L-1 GSK126处理,每组设置5个复孔,培养48 h后,每孔加入MTT试剂(5 g·L-1)20 μL继续培养4 h,DMSO溶解沉淀,采用酶标仪于490nm处测定各孔吸光度(A)值,并计算各组细胞存活率。细胞存活率=实验孔平均A值/对照孔平均A值×100%。
1.4 克隆形成实验检测A549细胞克隆形成率取生长状态良好的A549细胞均匀接种于6孔板,每孔1000个细胞,常规培养12 h后分为对照组和不同浓度GSK126组,分别用浓度为0、1.0、2.5、5.0、10.0和15.0μmol·L-1 GSK126处理,每3 d更换1次培养基,培养14 d或皿底长满细胞后终止培养,弃去培养基,PBS清洗3次,4%多聚甲醛固定60 min,结晶紫染色20 min,PBS清洗3次。常温下干燥,倒置拍照,肉眼计数集落形成数,并计算克隆形成率。
1.5 EdU实验检测细胞增殖率取生长状态良好的A549细胞接种于共聚焦皿中,每孔20 000个细胞,细胞贴壁24 h后,分为对照组和不同浓度GSK126组,分别加入浓度为0、5.0和10.0μmol·L-1 GSK126,培养24 h后按1:5000比例将EdU加入每个皿中,培养24 h后进行清洗和染色,最后用共聚焦显微镜观察细胞增殖情况。绿色荧光为增殖期细胞,蓝色荧光为非增殖期细胞。细胞增殖率=增殖细胞数/总细胞数×100%。
1.6 Hoechst-33342荧光染色法观察细胞凋亡形态表现取生长状态良好的A549细胞接种于4个小皿,每孔细胞数50 000个,12 h后分为对照组和不同浓度GSK126组,分别加入浓度为0、5.0、10.0和15.0 μmol·L-1 GSK126,培养48h后弃培养基,每孔加入1mL Hoechst-33342稀释液染色,37℃培养20~30 min后荧光显微镜下观察并拍照。强亮度荧光为凋亡期细胞,弱亮度荧光为非凋亡期细胞。
1.7 流式细胞术检测细胞凋亡率按照FITC AnnexinⅤ-7-AAD试剂盒说明书进行操作,取生长状态良好的A549细胞接种于6个中皿,12 h后分为对照组和不同浓度GSK126组,分别加入浓度为0、5.0、10.0和15.0 μmol·L-1 GSK126,培养48 h,无EDTA的胰酶消化收集细胞,预冷PBS洗涤1~2次,细胞重悬于100 μL BindingBuffer中,每管加入5 μL AnnexinⅤ-FITC和5 μL 7-AAD,轻轻混匀,室温避光15 min,再加入400 μL BindingBuffer,转移至流式管,采用流式细胞仪检测各组凋亡率。细胞凋亡率=(早期凋亡细胞数+晚期凋亡细胞数)/总细胞数×100%。
1.8 Western blotting法检测各组细胞中增殖和凋亡相关蛋白表达水平将细胞分为对照组和不同浓度GSK126组,分别加入浓度为0、5.0、10.0和15.0 μmol·L-1 GSK126,继续培养48 h,将处理后的细胞用刮刀收集,离心后加入相应体积RIPA裂解液,裂解完成后BCA定量,SDS-PAGE电泳分离,然后转移到PVDF膜上,1% BSA封闭,一抗(AKT、p-AKT、Bcl-2、Bax、Caspase-3和Cleaved-Caspase-3)4℃孵育过夜,TBST洗膜3次后加入HRP标记的二抗,常温孵育1 h,ECL显色。利用Image J软件对蛋白的表达水平进行量化分析。目的蛋白表达水平=目的蛋白条带灰度值/β-actin条带灰度值。
1.9 统计学分析采用SPSS22.0统计软件进行统计学分析。各组细胞存活率、克隆形成率、细胞增殖率、细胞凋亡率和细胞中AKT、p-AKT、Bcl-2、Bax、Caspase-3及Cleaved-Caspase-3蛋白表达水平均符合正态分布,均以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果 2.1 各组细胞存活率不同浓度GSK126处理A549细胞48h,随着GSK126浓度的升高,细胞存活受到不同程度抑制,细胞存活率随药物浓度升高逐渐降低(F=189.933,P<0.05)。与对照组(100.00%±0.87%)比较, 1.0、2.5、5.0、10.0和15.0μmol·L-1 GSK126组细胞存活率(96.64%±0.92%、89.28%±1.22%、80.35%±1.57%、50.00%±1.39%和42.85%±0.81%)明显降低(P<0.05或P<0.01),15.0μmol·L-1 GSK126组细胞存活率降低最明显(P<0.01)。
2.2 各组细胞克隆形成率不同浓度GSK126作用A549细胞14 d后,观察计数集落形成数并计算克隆形成率。与对照组(100%)比较,2.5、5.0、10.0和15.0μmol·L-1 GSK126组细胞克隆形成率明显降低(P<0.05),且随着GSK126浓度的增加降低程度越来越明显。见图 1(插页六)和图 2。
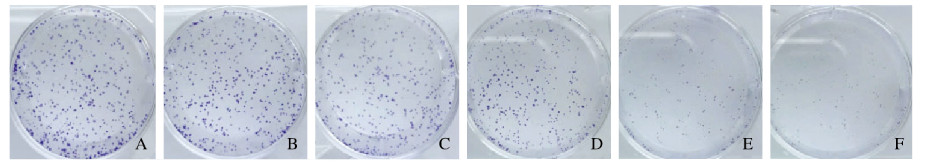
|
| A:Control group; B—F: 1.0, 2.5, 5.0, 10.0, and 15.0 μmol·L-1 GSK126 groups. 图 1 克隆形成实验观察各组细胞集落形成情况 Fig. 1 Colony formation of cells in various groups detected by colony formation experiment |
|
|
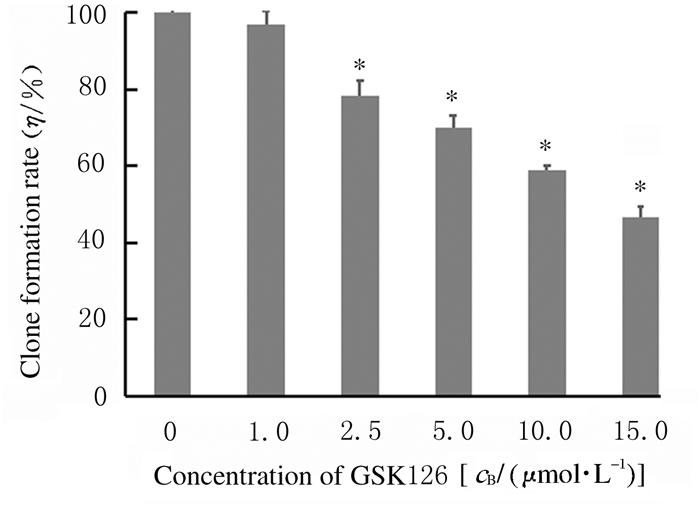
|
| *P < 0.05 compared with control(0μmol·L-1 GSK126)group. 图 2 各组细胞克隆形成率 Fig. 2 Colony formation rates of cells in various groups |
|
|
共聚焦显微镜下观察:5.0和10.0μmol·L-1 GSK126组细胞绿色荧光与绿色和蓝色荧光的比值小于对照组,且10.0μmol·L-1 GSK126组细胞绿色荧光与绿色和蓝色荧光的比值小于5.0μmol·L-1 GSK126组(图 3,见插页六)。与对照组(100.00%±2.79%)比较,5.0和10.0μmol·L-1 GSK126组细胞殖率(63.44%±3.02%和37.97%±3.53%)明显降低(P<0.05)。随着GSK126浓度增加,各组细胞增殖率逐渐降低(F=400.358, P<0.05)。
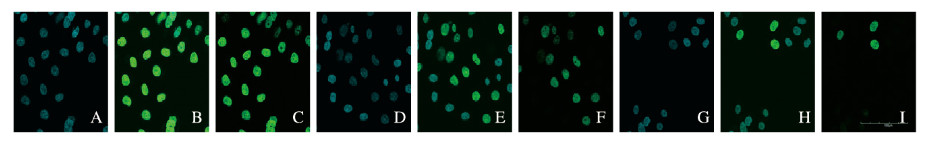
|
| A—C: Control group; D—F: 5.0 μmol·L-1 GSK126 group; G—I: 10.0 pmol·L-1 GSK126 group; A, D, G: DAPI; B, E, H: EdU; C, F, I:Merge. 图 3 EdU掺入法检测各组细胞增殖情况(×800) Fig. 3 Proliferation of cells in various groups detected by EdU incorporation method(×800) |
|
|
荧光显微镜下观察结果显示:对照组细胞数量最多,且多数为染色均匀且荧光弱的活细胞,而强荧光的凋亡细胞较少;与对照组比较,随着GSK126浓度升高,5.0、10.0和15.0μmol·L-1 GSK126组细胞数量减少,具有强荧光的凋亡细胞增加(图 4,见插页六)。
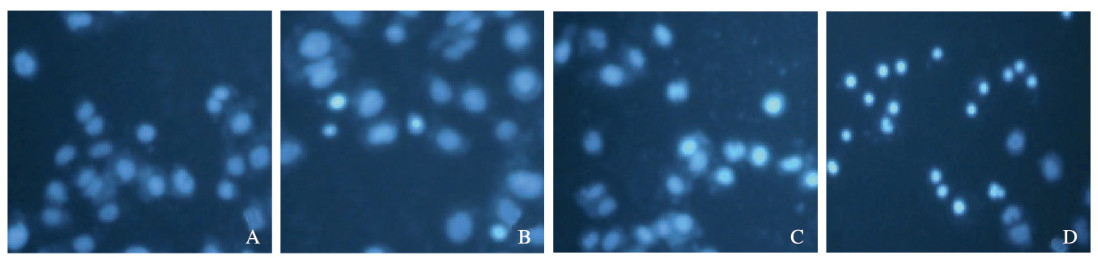
|
| A:Control group; B—D: 5.0, 10.0, and 15.0 μmol·L-1 GSK126 groups. 图 4 荧光显微镜观察各组A549细胞凋亡情况(Hoechst33342, ×400) Fig. 4 Apoptosis of A549 cells in various groups observed by fluorescence microscope (Hechst33342, ×400) |
|
|
根据流式细胞术FITC Annexin V/7-AAD双染分析,不同浓度GSK126作用A549细胞48h后,细胞凋亡率随GSK126浓度升高而升高。与对照组(3.16%±1.02%)比较,5.0、10.0和15.0 μmol·L-1 GSK126组细胞凋亡率(32.23%±3.17%、54.18%±1.21%和58.31%±3.98%)明显升高(P<0.01)。见图 5。

|
| A:Control group; B-D: 5.0, 10.0, and 15.0 μmol·L-1 GSK126 groups. 图 5 流式细胞术检测各组A549细胞凋亡率 Fig. 5 Apoptotic rates of A549 cells in various groups detectd by flow cytometry |
|
|
Western blotting法检测结果显示:与对照组比较,不同浓度GSK126组细胞中AKT蛋白表达水平差异无统计学意义(P>0.05),p-AKT蛋白表达水平逐渐降低(P<0.05或P<0.01), 且呈浓度依赖性。与对照组比较,不同浓度GSK126组细胞中Caspase-3蛋白表达水平差异无统计学意义(P>0.05),Bcl-2蛋白表达水平逐渐降低(P<0.05或P<0.01),Bax和Cleaved-Caspase-3蛋白表达水平逐渐升高(P<0.05或P<0.01),且呈浓度依赖性。见图 6。

|
| A, B:AKT and p-AKT; C, D:Bcl-2, Bax, Caspase-3 and Cleaved-Caspase-3;*P < 0.05, **P < 0.01 compared with control group; Lane 1:Control group; Lane 2-6: 1.0, 2.5, 5.0, 10.0, and 15.0 μmol·L-1 GSK126 groups; 1:Control group; 2-6:1.0, 2.5, 5.0, 10.0, and 15.0 μmol·L-1 GSK126 groups. 图 6 各组细胞中增殖和凋亡相关蛋白表达电泳图(A, C)和直条图(B, D) Fig. 6 Electrophoregram (A, C) and histogram (B, D) of expressions of proliferation and apoptosis-related proteins in cells in various groups |
|
|
EZH2作为多梳抑制复合物2(polycomb repressive complex 2, PRC2)的核心催化亚基,在人类癌症中高度扩增,在癌症的进展过程中发挥重要作用[14]。磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/AKT信号通路作为影响细胞生物学行为的重要通路之一,可通过调控下游相关蛋白影响细胞增殖和凋亡[15]。在乳腺癌中EZH2可以激活PI3K/AKT通路,加速肿瘤细胞DNA复制,而抑制PI3K/AKT信号通路可以促进细胞凋亡[16]。已往研究[17]显示:EZH2表达与PI3K/ AKT信号通路有密切关联,可以影响细胞增殖和细胞周期。PI3K激活后可促进下游AKT磷酸化进而促进细胞增殖,EZH2可通过调节AKT的磷酸化参与肿瘤的发生[18]。本研究结果显示:与对照组比较,经EZH2抑制剂GSK126处理后,肺腺癌A549细胞增殖能力随药物浓度升高逐渐降低,呈浓度依赖性, 同时随着GSK126浓度升高p-AKT表达水平逐渐降低,其机制可能是通过抑制A549细胞中的PI3K/ AKT信号通路实现的。AKT作为一种高度保守的丝氨酸/苏氨酸蛋白激酶,活化后在细胞膜上产生PIP3,PIP3与AKT N端的PH域结合,使AKT从细胞质向细胞膜转移。当p-AKT蛋白被激活后进入细胞质或细胞核时,会使底物磷酸化,促进细胞增殖[19]。
现已证实的存在最广泛的两大凋亡途径分别为死亡受体途径和线粒体介导的凋亡途径[20]。在调控凋亡基因中,Bcl-2家族与细胞凋亡发生发展最为密切,其中最重要的促凋亡蛋白是Bax、Bak、Bad等和抗凋亡蛋白Bcl-2、Bid、Bcl-xL等。Bcl-2家族在调节线粒体依赖的内源性凋亡途径中起关键作用[21]。当促凋亡蛋白和抗凋亡蛋白之间的平衡打破时,细胞就会走向凋亡。在细胞凋亡过程中Caspase家族蛋白作为线粒体内源性凋亡途径的主要执行蛋白,当Bax表达增高时可启动Caspase级联反应。Caspase家族中主要执行凋亡的基因为Caspase-3,Caspase-3通过自身裂解产生Cleaved-Caspase-3,Cleaved-Caspase-3可以通过剪切另外的Caspase底物, 达到引起级联反应的目的, 最终导致细胞凋亡[22]。本研究结果显示:与对照组比较,随着GSK126浓度升高,不同浓度GSK126组细胞凋亡率逐渐增加,并以浓度依赖的方式降低了抗凋亡蛋白Bcl-2表达,促进促凋亡蛋白Bax和Cleaved-Caspase-3的表达,说明GSK126可诱导细胞凋亡产生抗肿瘤作用,提示GSK126可能是通过激活Bax/Bcl-2/ Caspase-3凋亡途径促进肺癌A549细胞凋亡,GSK126具有治疗肺癌的潜力。
综上所述,EZH2特异性抑制剂GSK126对肺腺癌A549细胞增殖有抑制作用,对细胞凋亡有促进作用,且随着GSK126浓度升高作用增强,其机制可能通过是抑制PI3K/AKT通路并激活Bax/Bcl-2/Caspase-3通路实现的。
| [1] |
FENG R M, ZONG Y N, CAO S M, et al. Current cancer situation in China:good or bad news from the 2018 Global Cancer Statistics?[J]. Cancer Commun (Lond), 2019, 39(1): 22. DOI:10.1186/s40880-019-0368-6 |
| [2] |
SHAHABIPOUR F, CARAGLIA M, MAJEED M, et al. Naturally occurring anti-cancer agents targeting EZH2[J]. Cancer Lett, 2017, 400: 325-335. DOI:10.1016/j.canlet.2017.03.020 |
| [3] |
李杰宝, 喻晓程, 田野. 果蝇EZH2与乳腺癌分子分型及临床病理特征的关系[J]. 中国现代医学杂志, 2017, 27(6): 50-53. DOI:10.3969/j.issn.1005-8982.2017.06.010 |
| [4] |
OKI S, SONE K, ODA K, et al. Oncogenic histone methyltransferase EZH2:a novel prognostic marker with therapeutic potential in endometrial cancer[J]. Oncotarget, 2017, 8(25): 40402-40411. DOI:10.18632/oncotarget.16316 |
| [5] |
KUMARI K, DAS B, ADHYA A, et al. Nicotine associated breast cancer in smokers is mediated through high level of EZH2 expression which can be reversed by methyltransferase inhibitor DZNepA[J]. Cell Death Dis, 2018, 9(2): 152. DOI:10.1038/s41419-017-0224-z |
| [6] |
ZHOU J F, NIE D N, LI J, et al. PTEN is fundamental for elimination of leukemia stem cells mediated by GSK126 targeting EZH2 in chronic myelogenous leukemia[J]. Clin Cancer Res, 2018, 24(1): 145-157. DOI:10.1158/1078-0432.CCR-17-1533 |
| [7] |
ZHANG H K, QI J, REYES J M, et al. Oncogenic deregulation of EZH2 as an opportunity for targeted therapy in lung cancer[J]. Cancer Discov, 2016, 6(9): 1006-1021. DOI:10.1158/2159-8290.CD-16-0164 |
| [8] |
WEI S, LIU J H, LI X, et al. Repression of lncRNA-SVUGP2 mediated by EZH2 contributes to the development of non-small cell lung cancer via brisking Wnt/β-catenin signal[J]. Artif Cells Nanomed Biotechnol, 2019, 47(1): 3400-3409. DOI:10.1080/21691401.2019.1648279 |
| [9] |
TAKESHIMA H, WAKABAYASHI M, HATTORI N, et al. Identification of coexistence of DNA methylation and H3K27me3 specifically in cancer cells as a promising target for epigenetic therapy[J]. Carcinogenesis, 2015, 36(2): 192-201. DOI:10.1093/carcin/bgu238 |
| [10] |
林伟仁, 朱锋, 应荣彪, 等. EZH2抑制剂GSK126对Neuro-2a细胞增殖分化的影响及其可能机制[J]. 中国药理学通报, 2017, 33(2): 289-290. DOI:10.3969/j.issn.1001-1978.2017.02.027 |
| [11] |
YU P, GUO Y W, YUSUFU M, et al. Decreased expression of EZH2 reactivates RASSF2A by reversal of promoter methylation in breast cancer cells[J]. Cell Biol Int, 2016, 40(10): 1062-1070. DOI:10.1002/cbin.10646 |
| [12] |
QIU Z G, ZHU W L, MENG H, et al. CDYL promotes the chemoresistance of small cell lung cancer by regulating H3K27 trimethylation at the CDKN1C promoter[J]. Theranostics, 2019, 9(16): 4717-4729. DOI:10.7150/thno.33680 |
| [13] |
SERRESI M, SITEUR B, HULSMAN D, et al. Ezh2 inhibition in Kras-driven lung cancer amplifies inflammation and associated vulnerabilities[J]. J Exp Med, 2018, 215(12): 3115-3135. DOI:10.1084/jem.20180801 |
| [14] |
LIU X Y, LU X Y, ZHEN F X, et al. LINC00665 induces acquired resistance to gefitinib through recruiting EZH2 and activating PI3K/AKT pathway in NSCLC[J]. Mol Ther Nucleic Acids, 2019, 16: 155-161. DOI:10.1016/j.omtn.2019.02.010 |
| [15] |
LI J, ZHOU Z, XU F C, et al. MicroRNA-374b accelerates the development of lung cancer through downregulating PTEN expression via activating PI3K/Akt pathway[J]. Eur Rev Med Pharmacol Sci, 2019, 23(3): 1116-1124. |
| [16] |
RIQUELME E, BEHRENS C, LIN H Y, et al. Modulation of EZH2 expression by MEK-ERK or PI3K-AKT signaling in lung cancer is dictated by different KRAS oncogene mutations[J]. Cancer Res, 2016, 76(3): 675-685. |
| [17] |
KOSALAI S T, MORSY M H A, PAPAKONSTANTINOU N, et al. EZH2 upregulates the PI3K/AKT pathway through IGF1R and MYC in clinically aggressive chronic lymphocytic leukaemia[J]. Epigenetics, 2019, 14(11): 1125-1140. DOI:10.1080/15592294.2019.1633867 |
| [18] |
WANG Z Q, CAI Q, HU L, et al. Long noncoding RNA UCA1 induced by SP1 promotes cell proliferation via recruiting EZH2 and activating AKT pathway in gastric cancer[J]. Cell Death Dis, 2017, 8(6): e2839. DOI:10.1038/cddis.2017.143 |
| [19] |
SI X Q, XU F X, XU F H, et al. CADM1 inhibits ovarian cancer cell proliferation and migration by potentially regulating the PI3K/Akt/mTOR pathway[J]. Biomed Pharmacother, 2020, 123: 109717. DOI:10.1016/j.biopha.2019.109717 |
| [20] |
WARREN C F A, WONG-BROWN M W, BOWDEN N A. BCL-2 family isoforms in apoptosis and cancer[J]. Cell Death Dis, 2019, 10(3): 177. DOI:10.1038/s41419-019-1407-6 |
| [21] |
JIN J F, XIONG Y, CEN B. Bcl-2 and Bcl-xL mediate resistance to receptor tyrosine kinase-targeted therapy in lung and gastric cancer[J]. Anticancer Drugs, 2017, 28(10): 1141-1149. DOI:10.1097/CAD.0000000000000561 |
| [22] |
PAL M K, JAISWAR S P, SRIVASTAV A K, et al. Synergistic effect of piperine and paclitaxel on cell fate via cyt-c, Bax/Bcl-2-caspase-3 pathway in ovarian adenocarcinomas SKOV-3 cells[J]. Eur J Pharmacol, 2016, 791: 751-762. DOI:10.1016/j.ejphar.2016.10.019 |
 2020, Vol. 46
2020, Vol. 46


