扩展功能
文章信息
- 卜一, 张硕, 钱旭东, 王红梅, 窦志杰
- BU Yi, ZHANG Shuo, QIAN Xudong, WANG Hongmei, DOU Zhijie
- 脑梗死模型大鼠缺血脑组织中胰岛素样生长因子结合蛋白3表达水平及其与血管新生的关系
- Expression of insulin-like growth factor binding protein-3 in ischemic brain tissue of cerebral infarction model rats and its relationship with angiogenesis
- 吉林大学学报(医学版), 2020, 46(04): 759-764
- Journal of Jilin University (Medicine Edition), 2020, 46(04): 759-764
- 10.13481/j.1671-587x.20200415
-
文章历史
- 收稿日期: 2019-08-30
缺血性脑血管病致残率和死亡率高,对人类健康造成严重危害。脑梗死后新生血管形成可为缺血脑组织供血供氧,缩小梗死灶体积,减少神经细胞损伤,并有助于神经功能恢复[1]。血管生成受多种血管生成因子调节,胰岛素样生长因子结合蛋白3(insulin-like growth factor-binding protein 3, IGFBP-3)与血管生成关系密切,在不同疾病中IGFBP-3发挥作用也不同,在不同疾病中IGFBP-3可具有促进血管生成和抑制血管生成作用。KUSHLINSKII等[2]研究发现:大肠癌患者血清中IGFBP3水平与VEGF表达水平呈负相关关系,可能发挥抑制血管新生的作用;BAKOPOULOU等[3]研究认为:IGFBP3具有促血管生成的作用。但IGFBP-3在脑梗死组织中的表达情况及其与脑梗死后血管生成的关系尚不清楚。本研究旨在深入探讨脑梗死大鼠缺血脑组织中IGFBP-3表达水平及其与血管新生的关系,阐明IGFBP-3在脑梗死血管新生中的作用。
1 材料与方法 1.1 动物、主要试剂和仪器健康、清洁级SD大鼠110只,购自北京市医疗器械检验所,动物使用许可证号:SYXK(京)2015-0005。ECL发光液、逆转录(RT)试剂盒、聚合酶链反应(PCR)试剂盒、BCA试剂盒和2, 3, 5-氯化三苯基四氮唑(TTC)(美国Bioworld公司),TRIzol和水合氯醛(上海碧云天生物技术公司),兔抗鼠IGFBP-3多克隆抗体、兔抗鼠血管内皮生长因子(vascular endothelial growth factor,VEGF)多克隆抗体、兔抗鼠CD31多克隆抗体和兔抗鼠α-SMA多克隆抗体等抗体(美国Santa Cruz公司)。RT-PCR仪(美国Bio-Rad公司)。
1.2 大鼠分组和模型建立将110只大鼠分为对照组30只和模型组80只。模型组大鼠采用LONGA等[4]线栓法建立大脑中动脉栓塞缺血大鼠模型:水合氯醛腹腔麻醉大鼠,固定到动物手术台上,取颈正中切口,切开皮肤、浅筋膜,分离肌肉,暴露左侧颈总动脉、颈内动脉和颈外动脉,双重结扎颈外动脉及其分支,在颈外动脉近分叉处做小切口,从双重结中间切断颈外动脉,插入渔线,使渔线绕过颈总动脉分支,进入颈内动脉,向颅内方向推进,推进长度约18 mm,微遇阻力时停止,将线栓阻断在大脑中动脉起始处,加固结扎颈外动脉,防止线栓滑脱,缝合皮肤,阻断血流2 h;在麻醉状态下轻拉线栓,使其头端回到颈外动脉内,实现再灌注。对照组大鼠不结扎不插线,其余步骤同模型组。模型组大鼠术后24h采用神经功能评分法[4]进行神经行为学评价,评分1~3分者纳入研究,评分0分和4分者予以剔除。对照组大鼠无死亡。模型组大鼠死亡7只,神经功能评分0分者2只,4分者1只,均予以剔除,纳入研究70只。对照组和模型组各取10只大鼠用于TTC染色。模型组剩余60只大鼠根据随机数字法分为模型1d组、模型3d组和模型7d组,每组20只,分别于术后1、3和7 d处死。
1.3 神经行为学评分评估大鼠神经行为术后24h进行神经行为学评分:无神经缺损症状为0分;缺血对侧前肢不能完全伸展为1分;行走时向缺血对侧转圈为2分;行走时向缺血对侧倾倒为3分;意识受到抑制、不能行走为4分;死亡为5分。评分1~3分为建模成功。
1.4 标本采集和处理神经行为学评分后,对照组和模型组各取10只大鼠,过量麻醉处死大鼠,迅速断头取脑,用于TTC染色。对照组、模型1 d组、模型3 d组和模型7 d组各取10只大鼠,深度麻醉后,经心脏注射生理盐水,然后注射多聚甲醛,至大鼠全身僵硬,四肢微颤,取出大脑,置多聚甲醛中固定,经石蜡包埋后,进行冠状切片,切片厚4μm,用于HE染色、免疫组织化学染色和免疫荧光染色。对照组、模型1d组、模型3d组和模型7d组各取剩余10只大鼠,深度麻醉后,冰上断头取脑,投入液氮中冷冻,用于RT-PCR法检测。
1.5 大鼠脑组织TTC染色观察脑梗死情况将新鲜脑组织冰冻30min,切成厚2mm切片,置于TTC中孵育15 min,每5 min翻动1次切片,染成红色者为正常脑组织,染成白色者为梗死组织,染色后将脑组织切片置于多聚甲醛中过夜浸泡,采用Image J软件测定脑组织梗死面积,计算脑梗死体积。
1.6 HE染色观察大鼠脑组织病理形态表现将大鼠脑组织切片室温下风干。苏木素染色60s,自来水冲洗10s,盐酸乙醇处理2s,自来水冲洗2s,氨水返蓝10s,自来水冲洗15s,脱水、透明、封片后显微镜下观察脑组织中神经细胞坏死及血管水肿等情况。
1.7 免疫组织化学染色检测大鼠脑组织中IGFBP-3和VEGF蛋白表达水平取脑组织切片晾干,过氧化氢孵育10min,柠檬酸水微波炉中加热10min,加入TritonX-100孵育30min,加入一抗:兔抗鼠IGFBP-3多克隆抗体(1:200)、兔抗鼠VEGF多克隆抗体(1:200),过夜孵育,空白对照组以PBS代替一抗,加入二抗(1:500)孵育30min,DAB显色,常规复染、脱水、封片。显微镜下观察:细胞浆出现棕黄色为IGFBP-3、VEGF阳性细胞,采用IPP6.0软件检测阳性细胞的积分光密度(IOD)值,以IOD值代表目的蛋白表达水平。
1.8 RT-PCR法检测大鼠脑组织中IGFBP-3和VEGF mRNA表达水平取100 g大鼠脑组织匀浆,加入TRIzol和氯仿提取脑组织中RNA,逆转录为cDNA,对cDNA进行PCR扩增,PCR反应条件:94℃、2min;94℃、30s,56℃、30s,72℃、2min,共38个循环。以GAPDH为内参,采用2-ΔΔCT法计算IGFBP-3和VEGF mRNA表达水平。引物序列见表 1。
| Primer | Primer sequence(5′-3′) | Amplification length(bp) |
| IGFBP-3 | Upstream:AGAGCACAGATACCCAGAACT Downstream:GGTGATTCATGTTGTCTTCCATT |
210 |
| VEGF | Upstream:CGGATCAAACCTCACCAA Downstream:TCTCCGCTCTGAACGAGG |
236 |
| GAPDH | Upstream:CTCTAAGGCTGTGGGCAAGGTCAT Downstream primer:GAGATCCACCACCCTGTTGCTGTA |
318 |
取大鼠脑组织切片,PBS清洗,PBST破膜20min,加入BSA封闭1h,加入一抗兔抗鼠CD31多克隆抗体(1:200)过夜孵育,PBS清洗,加入荧光二抗(1:500)孵育2h,PBS清洗;加入一抗兔抗鼠α-SMA多克隆抗体(1:200)过夜孵育,PBS清洗,加入荧光二抗(1:500)孵育2h。采用Image-Pro Plus软件对图像进行处理。
1.10 统计学分析采用SPSS 20.0统计软件进行统计学分析。大鼠神经行为评分、脑组织中IGFBP-3和VEGF蛋白及mRNA表达水平和微血管密度均符合正态分布,以x±s表示,多组间样本均数比较采用方差分析,组间两两比较采用LSD检验。以P<0.05为差异有统计学意义。
2 结果 2.1 2组大鼠行为表现和神经行为评分对照组大鼠无神经功能缺损表现;模型组大鼠出现进食少、活动少和反应迟钝等表现及对侧前肢屈曲、向外侧转圈、同侧霍纳征、行走时向对侧倾倒等偏瘫体征。对照组大鼠神经行为学评分0分,模型组大鼠24h神经行为学评分(1.86±0.73)分。
2.2 2组大鼠脑组织TTC染色对照组大鼠脑组织红染,无白色梗死灶出现。24h后模型组大鼠脑组织均出现白色梗死灶,脑组织水肿明显,梗死灶主要位于纹状体和皮层区,脑梗死体积为(28.34±3.57)%。见图 1(插页四)。
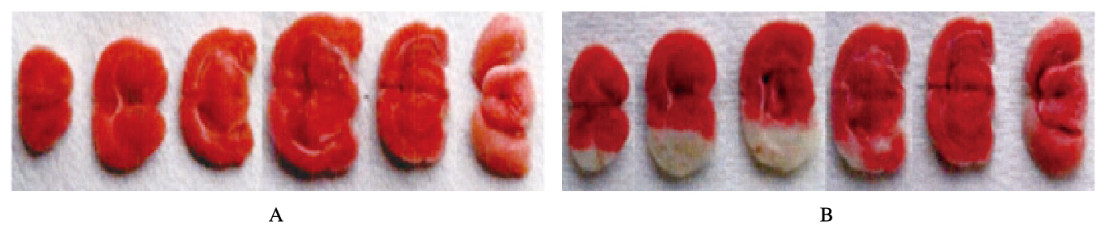
|
| A: Control group; B: Model group. 图 1 2组大鼠脑组织TTC染色结果 Fig. 1 TTC staining results of brain tissue of rats in two groups |
|
|
对照组大鼠脑组织神经细胞、毛细血管形态均正常,结构完整,胞浆无红染,结构完整,无神经细胞变性坏死。模型1d组大鼠脑组织缺血区神经细胞肿胀、结构模糊、间质水肿,出现细胞皱缩、核深染,毛细血管出现轻度水肿;模型3d组大鼠脑组织缺血区神经细胞皱缩,细胞和细胞间质明显水肿,组织间隙增宽,出现明显空泡化,毛细血管中度水肿;模型7d组大鼠脑组织缺血区神经细胞坏死,细胞和细胞间质水肿减轻,血管水肿减轻。见图 2(插页五)。
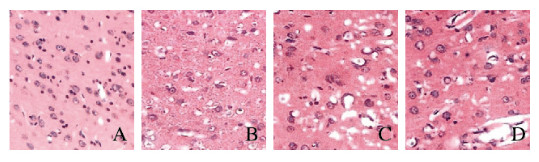
|
| A: Control group; B: Model 1 d group; C: Model 3 d group; D: Model 7 d group. 图 2 各组大鼠脑组织病理形态表现(HE, ×200) Fig. 2 Pathomorphology of brain tissue of rats in various groups(HE, ×200) |
|
|
对照组大鼠脑组织见少量IGFBP-3弱阳性细胞和少量VEGF阳性细胞。不同时间模型组大鼠脑组织中均有IGFBP-3和VEGF阳性表达,模型3 d组大鼠脑组织中IGFBP-3和VEGF阳性表达最强,模型7 d组大鼠脑组织中IGFBP-3和VEGF阳性表达减弱。见图 3(插页五)和图 4(插页五)。与对照组比较,不同时间模型组大鼠脑组织中IGFBP-3和VEGF蛋白表达水平均明显升高(P<0.01);模型3 d组大鼠脑组织中IGFBP-3和VEGF蛋白表达水平最高,模型7d组大鼠脑组织中IGFBP-3和VEGF蛋白表达水平较模型3d组有所降低。见表 2。

|
| A: Control group; B: Model 1 d group; C: Model 3 d group; D: Model 7 d group. 图 3 各组大鼠脑组织中IGFBP-3蛋白表达情况(免疫组织化学,×400) Fig. 3 Expressions of IGFBP-3 protein in brain tissue of rats in various groups (Immunohistochemistry, ×400) |
|
|

|
| A: Control group; B: Model 1 d group; C: Model 3 d group; D: Model 7 d group. 图 4 各组大鼠脑组织中VEGF蛋白表达情况(免疫组织化学,×400) Fig. 4 Expressions of VEGF protein in brain tissue of rats in various groups (Immunohistochemistry, ×400) |
|
|
| (n=10, x±s, ×103) | |||||||||||||||||||||||||||||
| Group | IGFBP-3 | VEGF | |||||||||||||||||||||||||||
| Control | 3.47±0.91 | 3.51±0.97 | |||||||||||||||||||||||||||
| Model 1 d | 7.35±1.06* | 7.58±1.56* | |||||||||||||||||||||||||||
| Model 3 d | 9.68±1.21* | 8.73±1.49* | |||||||||||||||||||||||||||
| Model 7 d | 5.62±1.17* | 4.92±1.02* | |||||||||||||||||||||||||||
| F | 57.925 | 31.502 | |||||||||||||||||||||||||||
| P | <0.01 | <0.01 | |||||||||||||||||||||||||||
| *P<0.05 compared with control group. | |||||||||||||||||||||||||||||
与对照组比较,不同时间模型组大鼠脑组织中IGFBP-3和VEGF mRNA表达水平均明显升高(P<0.05),模型3d组大鼠脑组织中IGFBP-3和VEGF mRNA表达水平最高,模型7d组大鼠脑组织中IGFBP-3和VEGF mRNA表达水平较模型3 d组有所降低。见表 3。
| (n=10, x±s) | |||||||||||||||||||||||||||||
| Group | IGFBP-3 | VEGF | |||||||||||||||||||||||||||
| Control | 1.00±0.08 | 1.00±0.11 | |||||||||||||||||||||||||||
| Model 1 d | 1.76±0.12* | 1.68±0.09* | |||||||||||||||||||||||||||
| Model 3 d | 2.25±0.14* | 2.35±0.15* | |||||||||||||||||||||||||||
| Model 7 d | 1.83±0.17* | 1.77±0.14* | |||||||||||||||||||||||||||
| F | 156.344 | 196.426 | |||||||||||||||||||||||||||
| P | <0.01 | <0.01 | |||||||||||||||||||||||||||
| *P<0.05 compared with control group. | |||||||||||||||||||||||||||||
选择CD31和α-SMA分别作为内皮细胞和周细胞标记物,对脑缺血半暗区进行免疫荧光染色,观察微血管密度。与对照组比较,不同时间模型组大鼠脑组织缺血半暗区微血管密度均升高(P<0.01),模型3d组大鼠脑组织缺血半暗区微血管密度最高,模型7d组大鼠脑组织缺血半暗区微血管密度较模型3 d组有所降低。见图 5(插页五)和表 4。

|
| A—D: CD31; E—H: α-SMA; I—L: Merge; A, E, I: Control group; B, F, J: Model 1 d group; C, G, K: Model 3 d group; D, H, L: Model 7 d group. 图 5 各组大鼠脑组织缺血半暗区微血管密度(免疫荧光,×400) Fig. 5 Microvessel densities in ischemic penumbra of brain tissue of rats in various groups (Immunofluorescence, ×400) |
|
|
| (n=10, x±s, number·mm-2) | |||||||||||||||||||||||||||||
| Group | Microvessel density | ||||||||||||||||||||||||||||
| Control | 9.34±1.25 | ||||||||||||||||||||||||||||
| Model 1 d | 21.25±1.67* | ||||||||||||||||||||||||||||
| Model 3 d | 39.61±1.58* | ||||||||||||||||||||||||||||
| Model 7 d | 26.75±1.72* | ||||||||||||||||||||||||||||
| F | 643.793 | ||||||||||||||||||||||||||||
| P | <0.01 | ||||||||||||||||||||||||||||
| *P<0.05 compared with control group. | |||||||||||||||||||||||||||||
大鼠脑组织中IGFBP-3 mRNA表达水平与VEGF mRNA表达水平和微血管密度均呈正相关关系(r=0.563,P<0.05;r=0.612,P<0.05)。
3 讨论胰岛素样生长因子(insulin like growth factor,IGF)信号系统在细胞增殖、分化、凋亡、迁移和血管生成等方面均发挥重要作用。IGF信号系统由IGF配体、IGF受体和IGFBPs组成,IGFBPs包括IGFBP-1、IGFBP-2、IGFBP-3、IGFBP-4、IGFBP-5和IGFBP-6,IGFBPs与IGF具有较高的亲和力,在IGF生物活性调控中发挥重要作用[5]。在上述6种结合蛋白中,IGFBP-3与恶性肿瘤关系密切,因此成为研究的热点[6]。IGFBP-3在多种恶性肿瘤中表达异常,具有抗肿瘤作用[7]。IGFBP-3在缺血再灌注损伤中表达也存在异常,如大鼠视网膜缺血再灌注后IGFBP-3表达先升高后降低[8],IGFBP-3可能为缺血状态下的一种生理反应。本研究结果显示:脑梗死大鼠神经功能评分升高,并出现脑梗死灶,表明脑梗死模型建立成功;HE染色结果显示:大鼠脑梗死3d时脑损伤最严重,脑梗死7d时有所恢复;大鼠脑组织中IGFBP-3蛋白和mRNA表达水平在脑梗死3d时最高,脑梗死7d时有所降低,表明IGFBP-3可能参与脑梗死的缺血再灌注过程。
急性脑梗死后缺血核心区神经细胞发生变性坏死,出现神经功能不可逆性损伤,而梗死早期周围缺血半暗区神经细胞可存活一定时间,因此尽快建立侧支循环、改善梗死灶周围缺血半暗区供血和挽救濒死神经细胞对减轻脑梗死损伤和改善预后具有重要价值。脑梗死后血管新生受多种细胞外基质、细胞分子和黏附因子等影响[9-10]。IGFBP-3和血管形成的关系也比较密切,IGFBP-3在不同疾病中对血管形成的作用不同,具有抑制血管形成和促进血管形成的双重作用。如IGFBP-3是人血清中一种主要的IGF结合蛋白,通过IGF依赖性和IGF非依赖性机制方式调节人头颈部鳞状细胞癌细胞和人脐静脉内皮细胞的血管生成活性,其可通过阻断整合素介导的肿瘤和血管内皮细胞的黏附活性进而抑制血管生成和恶性肿瘤的发展[11];在胰腺癌细胞中上调IGFBP-3水平具有抗肿瘤血管形成的作用[12];类风湿性关节炎患者血清IGFBP-3水平升高,IGF-I和IGFBP-3在类风湿性关节炎发病中发挥诱导血管生成的作用[13];ANGUIANO-HERNANDEZ等[14]研究发现:IGFBP-3水平升高与血管生成增加有关。
本文作者对脑梗死大鼠脑组织中IGFBP-3mRNA表达水平与血管形成的关系进行研究,采用CD31/αSMA共同标志微血管密度,结果显示:脑梗死大鼠脑组织中微血管密度升高,脑组织中IGFBP-3mRNA表达水平与VEGFmRNA表达水平和微血管密度呈正相关关系,表明IGFBP-3可能通过促进血管形成参与脑梗死后缺血再灌注损伤过程。VEGF与血管发生和生长关系密切,是一种特异性内皮细胞有丝分裂原,可诱导血管生成、促进内皮细胞生长和增加血管通透性[15]。VEGF促进血管生成的作用:诱导内皮细胞上表达相应配体和受体[16];促进血管内皮细胞增殖和迁移;增加血管细胞黏附分子和细胞间黏附分子水平;促进内皮细胞表面表达整合素受体;增加丝氨酸蛋白酶活性,降解细胞外基质,从而促进血管生成[17-18]。IGFBP-3在多种疾病中与VEGF关系密切,可与VEGF共同参与多种疾病的发病过程[19-21],如下调VEGF后可抑制小鼠子宫IGFBP-3表达[22]。本研究结果显示:脑梗死大鼠脑组织中IGFBP-3mRNA表达水平与VEGFmRNA表达水平呈正相关关系,表明IGFBP-3可能通过与VEGF相互作用,促进VEGF表达进而促进新生血管生成。
综上所述,脑梗死大鼠脑组织中IGFBP-3表达水平升高,其变化趋势与脑组织中VEGF和微血管密度一致,IGFBP-3可能在脑梗死后新生血管形成中发挥重要作用。
| [1] |
LIANG Y, CHEN J, ZHENG X, et al. Ultrasound-mediated kallidinogenase-loaded microbubble targeted therapy for acute cerebral infarction[J]. J Stroke Cerebrovasc Dis, 2018, 27(3): 686-696. DOI:10.1016/j.jstrokecerebrovasdis.2017.09.063 |
| [2] |
KUSHLINSKⅡ N E, GERSHTEIN E S, NIKOLAEV A A, et al. Insulin-like growth factors (IGF), IGF-binding proteins (IGFBP), and vascular endothelial growth factor (VEGF) in blood serum of patients with colorectal cancer[J]. Bull Exp Biol Med, 2014, 156(5): 684-688. DOI:10.1007/s10517-014-2425-0 |
| [3] |
BAKOPOULOU A, KRITIS A, ANDREADIS D, et al. Angiogenic potential and secretome of human apical papilla mesenchymal stem cells in various stress microenvironments[J]. Stem Cells Dev, 2015, 24(21): 2496-2512. DOI:10.1089/scd.2015.0197 |
| [4] |
LONGA E Z, WEINSTEIN P, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91. |
| [5] |
WANG W, WU B Q, CHEN G B, et al. Meta-analysis of the association of IGFBP3 and IGF1 polymorphisms with susceptibility to colorectal cancer[J]. Neoplasma, 2018, 65(6): 855-864. DOI:10.4149/neo_2018_170720N491 |
| [6] |
DENG M Y, LUO K Y, HOU T Y, et al. IGFBP3 deposited in the human umbilical cord mesenchymal stem cell-secreted extracellular matrix promotes bone formation[J]. J Cell Physiol, 2018, 233(8): 5792-5804. DOI:10.1002/jcp.26342 |
| [7] |
CHAN Y X, ALFONSO H, PAUL CHUBB S A, et al. Higher IGFBP3 is associated with increased incidence of colorectal cancer in older men independently of IGF1[J]. Clin Endocrinol (Oxf), 2018, 88(2): 333-340. DOI:10.1111/cen.13499 |
| [8] |
张冬梅, 张文芳, 鲁建华, 等. 大鼠视网膜缺血再灌注后IGF-1及IGFBP-3的表达和意义[J]. 国际眼科杂志, 2012, 12(3): 413-415. DOI:10.3969/j.issn.1672-5123.2012.03.11 |
| [9] |
PLEŞERU A M, MIHAILĂ R G. The role of thrombin in central nervous system activity and stroke[J]. Clujul Med, 2018, 91(4): 368-371. |
| [10] |
WU H, GUO P, LI X, et al. Hydroxybutyrate promotes the recovery from cerebral infarction by activating Amp-activated protein kinase signaling[J]. Exp Ther Med, 2018, 16(2): 1195-1202. |
| [11] |
LEE H J, LEE J S, HWANG S J, et al. Insulin-like growth factor binding protein-3 inhibits cell adhesion via suppression of integrin β4 expression[J]. Oncotarget, 2015, 6(17): 15150-15163. DOI:10.18632/oncotarget.3825 |
| [12] |
MIWA T, KOKURYO T, YOKOYAMA Y, et al. Therapeutic potential of targeting protein for Xklp2 silencing for pancreatic cancer[J]. Cancer Med, 2015, 4(7): 1091-1100. DOI:10.1002/cam4.453 |
| [13] |
SUZUKI S, MORIMOTO S, FUJISHIRO M, et al. Inhibition of the insulin-like growth factor system is a potential therapy for rheumatoid arthritis[J]. Autoimmunity, 2015, 48(4): 251-258. DOI:10.3109/08916934.2014.976631 |
| [14] |
ANGUIANO-HERNANDEZ Y M, CONTRERAS-MENDEZ L, DE LOS ANGELES HERNANDEZ-CUETO M, et al. Modification of HIF-1α, NF-κB, IGFBP-3, VEGF and adiponectin in diabetic foot ulcers treated with hyperbaric oxygen[J]. Undersea Hyperb Med, 2019, 46(1): 35-44. |
| [15] |
HEGDE P S, WALLIN J J, MANCAO C. Predictive markers of anti-VEGF and emerging role of angiogenesis inhibitors as immunotherapeutics[J]. Semin Cancer Biol, 2018, 52(Pt 2): 117-124. |
| [16] |
KIM T K, PARK C S, JANG J, et al. Inhibition of VEGF-dependent angiogenesis and tumor angiogenesis by an optimized antibody targeting CLEC14a[J]. Mol Oncol, 2018, 12(3): 356-372. |
| [17] |
MELINCOVICI C S, BOŞCA A B, ŞUŞMAN S, et al. Vascular endothelial growth factor (VEGF)-key factor in normal and pathological angiogenesis[J]. Rom J Morphol Embryol, 2018, 59(2): 455-467. |
| [18] |
HU W H, WANG H Y, KONG X P, et al. Polydatin suppresses VEGF-induced angiogenesis through binding with VEGF and inhibiting its receptor signaling[J]. FASEB J, 2019, 33(1): 532-544. DOI:10.1096/fj.201800750R |
| [19] |
JIANG Y D, ZHANG Q H, STEINLE J J. Beta-adrenergic receptor agonist decreases VEGF levels through altered eNOS and PKC signaling in diabetic retina[J]. Growth Factors, 2015, 33(3): 192-199. |
| [20] |
戚红霞, 李晓虹, 胡海强. 血清IGF-1、IGFBP-3、VEGF及多项白介素在结直肠癌转移监测中的意义[J]. 海南医学院学报, 2013, 19(2): 176-179. |
| [21] |
KARLIKOVA M, TOPOLCAN O, NARSANSKA A, et al. Circulating growth and angiogenic factors and lymph node status in early-stage breast cancer-a pilot study[J]. Anticancer Res, 2016, 36(8): 4209-4214. |
| [22] |
芦小单, 方艳秋, 纪艳, 等. 可逆抑制血管内皮生长因子(VEGF)表达转基因小鼠子宫基因转录谱分析[J]. 生殖与避孕, 2015, 35(7): 446-451. |
 2020, Vol. 46
2020, Vol. 46


