扩展功能
文章信息
- 董媛, 李建华, 贾俊臻, 冯文卓, 孟晨阳, 贺佳美, 唐一鑫, 王会岩
- DONG Yuan, LI Jianhua, JIA Junzhen, FENG Wenzhuo, MENG Chenyang, HE Jiamei, TANG Yixin, WANG Huiyan
- 人COX1蛋白真核表达载体的构建及其生物信息学分析
- Construction of eukaryotic expression vector of human COX1 protein and its bioinformatics analysis
- 吉林大学学报(医学版), 2020, 46(04): 745-750
- Journal of Jilin University (Medicine Edition), 2020, 46(04): 745-750
- 10.13481/j.1671-587x.20200413
-
文章历史
- 收稿日期: 2019-11-04
前列腺素E1(prostaglandin E1,PGE1)也称前列地尔,是临床上治疗勃起功能障碍的局部用药物[1],对糖尿病[2]和肾损伤[3]等疾病也有疗效。目前市场上合成PGE1主要通过化学合成法和生物合成法[4],但是产出率低,且增加了环境污染的风险。利用羊精囊中存在的天然环氧合酶(cyclooxygenase,COX),催化二十碳不饱和脂肪酸发生环氧化反应可生成PGE1[5]。但是羊精囊资源有限,成本极高,且存在人畜共患病的潜在风险。如果能够通过基因工程手段实现COX的体外表达,既能提高PGE1产量,又能控制生产过程,降低风险。
COX有2种亚型:COX1和COX2[6],二者是同工酶,COX1是结构酶,而COX2是诱导酶,主要作用是促进PGE的合成。目前,对于COX1研究多倾向于药理学和药效学研究领域,如COX1对化学肝损伤的保护作用、调节动脉粥样硬化、参与直肠癌和胃癌的发生发展等,而对其真核表达载体的构建和体外表达COX1的酶活性报道较少。COX1为一种膜整合蛋白,由599或600个氨基酸残基组成,含有23或24个氨基酸残基构成的信号肽[7]。本研究通过构建人COX1基因真核表达载体,并在HEK-293F细胞中表达,验证COX1酶催化活性,以期寻找替代羊精囊合成PGE1的新途径。
1 材料与方法 1.1 细胞、主要试剂和仪器新鲜羊精囊,购于吉林省吉林市江南批发市场。pCMV6-Entry Vector和感受态细胞E.coli DH5-α购自北京天根生化科技有限公司,人胚肾细胞HEK-293F由实验室保存,人微血管内皮细胞(human microvascular endothelial cells, HMECs)购自上海研谨生物科技有限公司。质粒提取试剂盒和RNA提取试剂盒购自北京全式金生物科技有限公司,逆转录试剂盒购自江苏省吴江近岸蛋白质科技有限公司,EndoFectinTM-Expi293转染试剂购自北京义翘神州生物科技有限公司,T4 DNA连接酶、Sgf Ⅰ和Mlu Ⅰ限制性内切酶购自北京NEB生物科技有限公司,PGE1检测试剂盒购于上海泽叶生物科技有限公司,Anti-Myc-Tag mAb (HRP- Conjugated)、HRP-Goat Anti-Mouse IgG(H+L)和ECL化学发光试剂盒购自美国Abmart公司。K160 PCR扩增仪(力康生物科技有限公司),GelDoc EZ凝胶成像仪(美国Bio-Rad公司),CO2培养箱(美国赛默飞公司)。
1.2 PCR扩增目的基因COX1根据GenBank中COX1编码基因序列(coding sequence,CDS)NM_000962,由生工生物工程(上海)股份有限公司设计特异性引物并合成。引物序列(上游引物下划线为Sgf Ⅰ酶切位点,下游引物下划线为Mlu Ⅰ酶切位点):上游引物5′- ATGCGATCGC-ATGAGCCGGAGTCTCTTGCTCC-3′,下游引物5′-CGACGCGTTCAGAGCTCTGTGGATGGTCG-CTC-3′。
采用RNA提取试剂盒提取HMECs总RNA后,逆转录成cDNA,以cDNA为模板,采用常规PCR扩增COX1基因。逆转录体系及步骤参照逆转录试剂盒说明书。PCR反应体系:模板1 μL,上游引物1 μL,下游引物1 μL,2×Taq Mix 12 μL,灭菌水10 μL。PCR反应条件:95℃、5 min;95℃、45 s, 60℃、45 s, 72℃、1 min,30个循环;72℃、10 min。
1.3 重组真核表达载体pCMV6-COX1的构建将PCR产物利用胶回收试剂盒纯化回收,采用Sgf Ⅰ酶和Mlu Ⅰ酶分别对pCMV6载体和COX1 PCR扩增产物37℃双酶切1 h,DNA电泳,胶回收目的条带(载体约4 900 bp,COX1目的基因约1 800 bp),T4 DNA连接酶16℃连接过夜。连接产物转化大肠杆菌DH5-α感受态细胞,涂布于Kana+的LB平板,37℃倒置培养12~16 h。
1.4 COX1重组真核表达质粒的鉴定挑取单菌落,接种于LB液体培养基,37℃、180 r·min-1振荡培养24 h,提取质粒,分别采用双酶切法和PCR法鉴定。阳性克隆测序,与COX1基因序列进行比对。
1.5 COX1蛋白生物信息学分析采用Expasy数据库中的ProtParam工具分析蛋白质的疏水性[8];采用SignalP 4.1软件分析蛋白信号肽,采用TMHMM Server v.2.0在线分析软件预测COX1蛋白跨膜区域[9],采用NetPhos 3.1 Server在线工具分析磷酸化位点,采用PSIPRED方法预测蛋白质的二级结构[10];采用SWISS-MODEL程序进行折叠模式识别,并用Qmean工具进行评估,选取最佳三级结构结果[11]。
1.6 COX1基因真核表达载体转染HEK-293F细胞接种阳性克隆于150 mL LB液体培养基中,37℃、180 r·min-1振荡培养24 h,提取质粒,取30 μg无内毒素质粒,根据EndoFectinTM-Expi293转染试剂操作说明书,转染入7.5×107 mL-1的HEK-293F细胞中(25 mL),5% CO2培养箱中培养,分为转染重组质粒2 d组和转染重组质粒5 d组,同时设未转染的HEK-293F细胞为对照组,分别收集各组细胞培养上清及细胞,细胞超声破碎提取总蛋白,细胞培养上清经超滤浓缩,Western blotting法检测COX1蛋白表达水平,以Image J V1.8.0软件分析条带灰度值,以目的蛋白条带灰度值与GAPDH条带灰度值比值代表COX1蛋白表达水平。
1.7 羊精囊提取粗酶混合物将5个羊精囊去除脂肪和结缔组织后称质量,剪碎后加入2倍质量的0.154 mol·L-1 KCl匀浆,9 000 r·min-1离心10 min,取上清,重复2次,合并上清液,用2 mol·L-1柠檬酸调节pH值至4.8~5.0,9 000 r·min-1离心10 min,取沉淀,加入25 mL磷酸盐/EDTA-Na2缓冲液(pH值8.2磷酸盐缓冲液:0.125 mol·L-1 EDTA-Na2=9:1)重悬,备用[5]。
1.8 COX1酶催化二高-γ-亚麻酸合成PGE1含量的测定酶促反应体系[5]:转染后HEK-293F细胞上清或羊精囊提取的COX1粗酶(40%)、对苯二酚(0.01%)、还原型谷胱甘肽(0.1%)和二高- γ-亚麻酸(1%和5%),以磷酸盐/EDTA-Na2缓冲液补足体积至5 mL,加入二高-γ-亚麻酸后立即搅拌,通入足量空气,37℃水浴或者温箱中反应1 h,2000 r·min-1离心10 min,取上清,采用PGE1试剂盒检测,以梯度稀释的标准品浓度为横坐标,吸光度(A)值为纵坐标,绘制标准曲线,每个样品重复测定3次。
1.9 统计学分析采用Origin 8.0统计软件进行统计学分析。各组细胞中和培养上清中COX1蛋白表达水平及PGE1含量均符合正态分布,以x±s表示,2组间样本均数比较采用t检验。以P<0.05为差异有统计学意义。
2 结果 2.1 PCR扩增目的基因COX1以HMECs的cDNA为模板,利用PCR法扩增目的基因COX1,扩增产物与实际大小一致,约1800 bp。见图 1。

|
| Lane 1:DNA marker; Lane 2:COX1 gene. 图 1 COX1基因PCR扩增产物琼脂糖凝胶电泳图 Fig. 1 Agarose gel electrophoregram of PCR amplification product of COX1 gene |
|
|
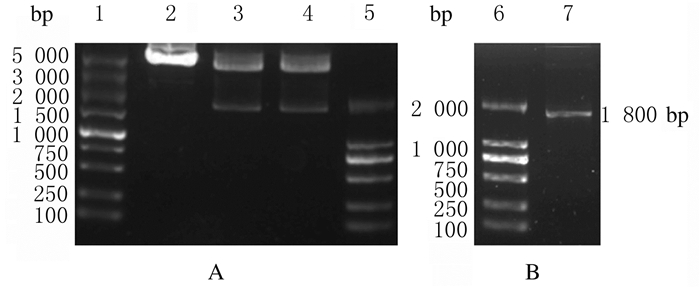
提取的重组质粒经Sgf Ⅰ和Mlu Ⅰ双酶切,酶切5 min和10 min效果比较无明显差异,得到目的基因COX1和载体pCMV6-Entry2个片段。见图 2。
|
| Lane 1: DL5 000 DNA marker; Lane 2: Recombinant plasmid; Lane 3: Product digested by double enzyme for 5 min; Lane 4: Product digested by double enzyme for 10 min; Lane 5, 6: DL2 000 DNA marker; Lane 7: COX1 gene. 图 2 重组质粒pCMV6-COX1双酶切鉴定(A)和PCR法鉴定(B)琼脂糖凝胶电泳图 Fig. 2 Agarose gel electrophoregram of pCMV6-COX1 identified by double enzyme digestion (A) and PCR (B) |
|
|
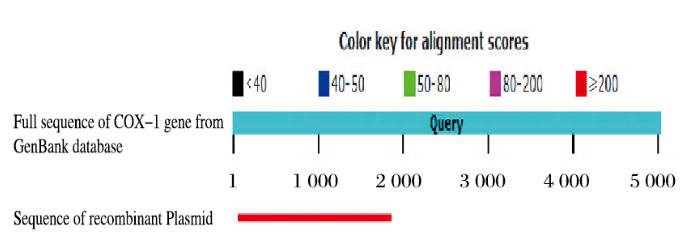
经双酶切鉴定成功的质粒送往生工生物工程(上海)股份有限公司测序,测序结果与美国国家生物技术信息公司(NCBI)网站上的COX1全基因序列进行比对,结果显示无明显差异,测序比对结果见图 3(插页四)。
|
| 图 3 COX1重组质粒与GenBank数据库序列BLAST比对分析 Fig. 3 BLAST analysis of COX1 sequence between recombinant plasmid and GenBank database |
|
|
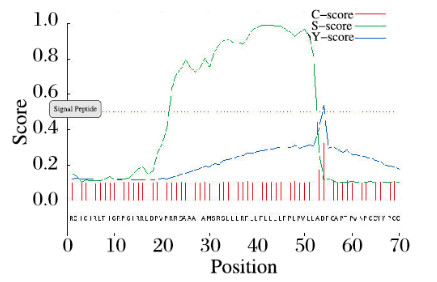
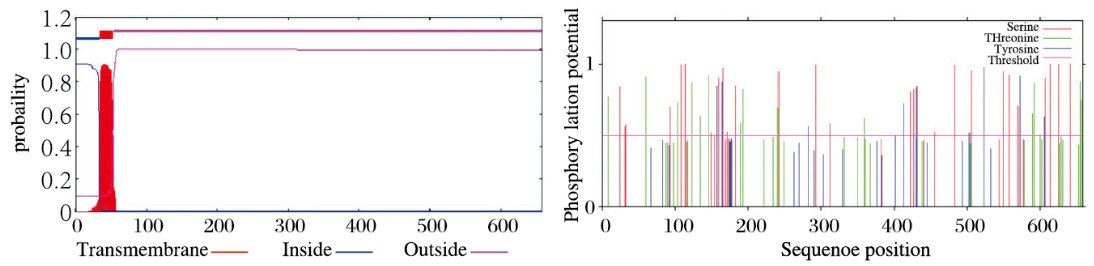
COX1编码区蛋白有658个氨基酸,总平均亲水性(grand average of hydropathicity, GRAVY)值为-0.217,相对分子质量为75 321.09,等电点为8.28,不稳定指数为46.36,说明该蛋白为水溶性蛋白,但稳定型差。采用SignalP 4.1软件在线分析COX1蛋白,显示其含有信号肽,位置在1~53位氨基酸(图 4, 见插页四)。采用TMHMM Server v.2.0在线分析软件预测COX1蛋白跨膜区域,采用NetPhos 3.1 Server在线工具分析磷酸化位点,结果显示:34~53位氨基酸处于跨膜区域(图 5A, 见插页四),COX1蛋白有36个丝氨酸磷酸化位点,14个苏氨酸磷酸化位点,9个酪氨酸磷酸化位点(图 5B, 见插页四)。
|
| 图 4 SignalP 4.1在线软件预测COX1蛋白信号肽序列 Fig. 4 Signal peptide sequence of COX1 protein predicted by SignalP 4.1 online tool |
|
|
|
| 图 5 TMHMM Server v.2.0在线分析软件预测COX1蛋白跨膜区域(A)和NetPhos 3.1 Server在线工具预测COX1蛋白磷酸化位点(B) Fig. 5 Transmembrane regions of COX1 protein predicted by TMHMM Server v.2.0 online analysis software (A) and phosphorylation sites of COX1 protein predicted by NetPhos 3.1 Server online tool (B) |
|
|
采用PSIPRED方法预测COX1蛋白的二级结构,采用SWISS-MODEL程序预测三级结构。COX1二级结构中,不规则卷曲所占比例最大(46.2%),其次为α螺旋(41.03%),延伸链和β-转角分别占10.18%和2.58%。COX1蛋白三级结构较为致密,分子结构中存在较多的α螺旋和不规则卷曲,与二级结构预测结果一致。见图 6(插页四)和图 7(插页四)。
|
| 图 6 PSIPRED在线工具预测COX1蛋白二级结构 Fig. 6 Secondary structure of COX1 protein predicted by PSIPRED online tool |
|
|

|
| 图 7 SWISS-MODEL在线工具预测COX1蛋白三级结构 Fig. 7 Tertiary structure of COX1 protein predicted by SWISS-MODEL online tool |
|
|
分别收集转染重组质粒2 d和5 d组HEK-293F细胞和细胞培养上清,利用Western blotting法检测COX1蛋白表达水平,结果显示:COX1蛋白相对分子质量约为70 000,与实际大小一致。转染COX1基因的HEK-293F细胞和细胞培养上清中均表达COX1蛋白,转染重组质粒2 d组与转染重组质粒5 d组细胞中COX1蛋白表达水平(0.71±0.03和0.67±0.08)比较差异无统计学意义(P>0.05),但转染重组质粒5 d组细胞培养上清中COX1蛋白表达水平(5.93±0.25)明显高于转染重组质粒2 d组(4.93±0.37)(P<0.05)。见图 8。
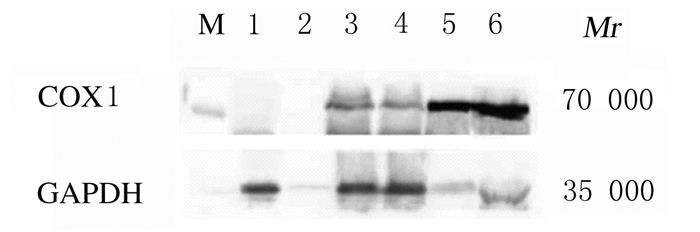
|
| M: Protein marker; Lane 1:Cells in control group; Lane 2: Cell culture supernatants in control group; Lane 3: Cells in transfection 2 d group; Lane 4: Cells in transfection 5 d group; Lane 5: Cell culture supernatants in transfection 2 d group; Lane 6: Cell culture supernatants in transfection 5 d group. 图 8 Western blotting法检测各组HEK-293F细胞和细胞培养上清中COX1蛋白表达电泳图 Fig. 8 Electropherogram of COX1 protein expressions in HEK-293F cells and cell culture supernatants in various groups detected by Western blotting method |
|
|
以二高-γ-亚麻酸(1%和5%)为底物,按照PGE1检测试剂盒使用说明书,绘制得标准曲线Y= 671.32X-33.113(R2= 0.9993),分别计算细胞培养上清中真核表达COX1蛋白和羊精囊提取粗酶混合物催化底物合成PGE1含量,真核表达COX1蛋白能够催化底物合成PGE1,其活性相当于为5个羊精囊提取的粗酶活性的(90.30±0.06)%。见表 1。
| [n=3, x±s, ρB/(ng·L-1)] | |||||||||||||||||||||||||||||
| Group | PGE1 | ||||||||||||||||||||||||||||
| (Substrate) 1% | 5% | ||||||||||||||||||||||||||||
| Eukaryotic expression COX1 protein | 50.01±1.37 | 47.39±2.14 | |||||||||||||||||||||||||||
| Crude enzyme extract from sheep seminal vesicle | 55.64±0.84 | 46.44±1.83 | |||||||||||||||||||||||||||
PGE1具有广泛的药理和生理作用,包括扩张血管、保护缺血心肌、改善心功能和治疗糖尿病等[12-13],临床上用来治疗各种心脏病、慢性呼吸疾病和各种类型肝炎等多种疾病[14-16],市场需求量大。目前虽然实现了PGE1的生物合成和化学合成,但是化学合成方法步骤复杂,副产物多,纯化困难,生产量一直受限;而生物合成由于使用的羊精囊属于动物组织来源,受到原料局限,且容易增加人畜共患病风险,导致PGE1产品价格居高不下。
研究[17-18]表明:COX1是生物合成PGE1的关键酶,COX1通过催化花生四烯酸氧化合成PGE1,一般情况COX1主要存在于胃、肠道上皮细胞和血管内皮细胞中,起到保护黏膜细胞和改变血管张力的作用。在胃肠疾病中,尤其是胃肠道炎症和肿瘤组织中,常见COX1异常表达[19-20],但其在各种胃肠疾病中的作用机制至今尚不清楚。研究[21]显示:COX1在正常黏膜组织中长期存在,是稳态的维持者和PGE1的分泌者。生理条件下,COX1的表达量维持在一个稳定的状态,很难满足PGE1大量生产的要求。
获取COX1的编码区并构建其真核表达载体是研究COX1生理功能及其在PGE1体外生物合成过程中作用的基础。本研究首先成功构建pCMV6-COX1重组载体,双酶切、PCR和测序结果表明:目的基因COX1成功连接到真核表达载体pCMV6。随后通过生物信息学分析了COX1蛋白编码区的结果显示:COX蛋白含有信号肽,包含跨膜区,属于分泌型蛋白,在真核表达系统HEK-293F细胞中表达后,COX1蛋白主要分泌在细胞培养基中,也验证了生物信息学预测结果的可靠性,真核表达的COX1蛋白有利于后续纯化,且蛋白结构更接近天然活性蛋白状态,结构完整,可用于研究COX1的更多生理功能和新型抑制剂的开发。
为了验证真核表达的COX1有环氧合酶催化活性,能够催化二高-γ-亚麻酸合成PGE1,本研究建立了一个体外酶促反应体系,同时与羊精囊粗酶提取物活性进行比较,结果表明:25 mL细胞培养上清预处理后,其酶活性与5个羊精囊制备的粗酶活性相当,解决了羊精囊提取的粗酶混合物催化合成PGE1生产方法效率低、质量不稳定的瓶颈,为高效合成PGE1提供了新的方法。故通过优化表达工艺和纯化COX1蛋白等手段可以进一步提高COX1蛋白的酶活性,进而提高PGE1产量。
综上所述,本研究获得的COX1蛋白具有理想的体外催化特性,构建的pCMV6-COX1重组载体为后续深入研究COX1的生理功能和其在病理过程中的作用以及筛选COX1抑制剂的研究奠定了基础。
| [1] |
汤育新, 文甲明, 蒋先镇, 等. 应用前列腺素E1注射治疗勃起功能障碍8年经验[J]. 中国男科学杂志, 2007, 21(9): 16-18, 25. |
| [2] |
陈雪莲. 贝那普利联合前列腺素E1治疗糖尿病肾病疗效观察[J]. 临床合理用药杂志, 2019, 12(4): 70-71. |
| [3] |
李霞, 王明. 贝那普利与前列腺素E1联合在糖尿病肾病治疗中的疗效及对蛋白尿的影响效果分析[J]. 糖尿病新世界, 2018(1): 176-177. |
| [4] |
ARNOLD L A, NAASZ R, MINNAARD A J, et al. Catalytic enantioselective synthesis of prostaglandin E(1) methyl ester using a tandem 1, 4-addition-aldol reaction to a cyclopenten-3, 5-dione monoacetal[J]. J Am Chem Soc, 2001, 123(24): 5841-5842. |
| [5] |
王焕玲. 二高-γ-亚麻酸和阳精囊生物合成前列腺素E1[J]. 世界最新医学信息文摘, 2016, 16(97): 57. |
| [6] |
刘永杰, 方永清, 张帆, 等. 精浆环氧化酶(COX)1、COX2的检测及其临床应用价值[J]. 宁夏医学杂志, 2019, 41(6): 540-542. |
| [7] |
POON R W S, TAM E W T, LAU S K P, et al. Molecular identification of cestodes and nematodes by cox1 gene real-time PCR and sequencing[J]. Diagn Microbiol Infect Dis, 2017, 89(3): 185-190. |
| [8] |
何楚琦, 钟浩, 龙鼎新. Hsa-miR-139-3p靶基因预测及生物信息学分析[J]. 中国现代医学杂志, 2019, 29(17): 22-28. |
| [9] |
陈瑛琪, 蔡瑶, 李雨濛, 等. 塞内加谷病毒3C蛋白生物信息学分析及真核质粒构建表达[J]. 东北农业大学学报, 2019, 50(8): 32-39. |
| [10] |
吴喆瑜, 于越, 巩建业, 等. 黑曲霉α-L-鼠李糖苷酶Rha1的二级结构预测及三级结构模拟[J]. 现代食品科技, 2017, 33(6): 62-73, 227. |
| [11] |
相伟芳, 杨艺新, 郭美琪, 等. 白蛾周氏啮小蜂气味结合蛋白CcOBP3的生物信息学分析[J]. 天津师范大学学报(自然科学版), 2019, 39(2): 45-49. |
| [12] |
WU J D, TAO S, JIN X, et al. PGE1 improves diabetic peripheral neuropathy in patients with type 2 diabetes[J]. Prostaglandins Other Lipid Mediat, 2016, 126: 24-28. |
| [13] |
俞建强. 前列地尔治疗急性缺血性脑卒中对神经功能、凝血功能和炎症指标的影响[J]. 现代实用医学, 2019, 31(7): 964-965. |
| [14] |
杨玲.前列地尔临床应用疗效及安全性的系统评价和某医院临床应用合理性评价[D].合肥: 安徽中医药大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10369-1016113068.htm
|
| [15] |
王冬琼. 老年冠心病心绞痛患者急性发作期前列地尔临床用药研究[J]. 临床医药文献电子杂志, 2018, 5(21): 87. |
| [16] |
朱磊, 刘健, 李斌, 等. 前列地尔对脓毒性休克患者复苏达标后微循环的影响[J]. 解放军医学杂志, 2018, 43(4): 328-332. |
| [17] |
JENSEN T S R, MAHMOOD B, DAMM M B, et al. Combined activity of COX-1 and COX-2 is increased in non-neoplastic colonic mucosa from colorectal neoplasia patients[J]. BMC Gastroenterol, 2018, 18(1): 31. |
| [18] |
俞欢.益气活血方对消化性溃疡复发患者血清Cox-1、COX-2及PGE2的影响[D].南京: 南京中医药大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10315-1014413652.htm
|
| [19] |
LI S F, MINER K, FANNIN R, et al. Cyclooxygenase-1 and 2 in normal and malignant human ovarian epithelium[J]. Gynecol Oncol, 2004, 92(2): 622-627. |
| [20] |
顾桓.直肠癌细胞中环氧合酶1的下调通过NF-κB通路诱导细胞凋亡[D].昆明: 云南大学, 2018.
|
| [21] |
徐俊, 宋于刚, 桑显富, 等. 大鼠应激性溃疡自愈过程中环氧合酶表达的变化[J]. 南方医科大学学报, 2006, 26(1): 91-93, 97. |
 2020, Vol. 46
2020, Vol. 46


