扩展功能
文章信息
- 王晶瑶, 赵岩, 蔡恩博, 祝洪艳, 李平亚, 刘金平
- WANG Jingyao, ZHAO Yan, CAI Enbo, ZHU Hongyan, LI Pingya, LIU Jinping
- 刺五加果水提物和醇提物对小鼠的镇静催眠作用及其机制
- Sedative and hypnotic effects of water and alcohol extracts from fruits of Acanthopanax senticosus in mice and their possible mechanisms
- 吉林大学学报(医学版), 2020, 46(04): 714-721
- Journal of Jilin University (Medicine Edition), 2020, 46(04): 714-721
- 10.13481/j.1671-587x.20200408
-
文章历史
- 收稿日期: 2019-10-09
2. 吉林大学药学院新药研究室, 吉林 长春 130021
2. New Drug Research Laboratory, School of Pharmacy, Jilin University, Changchun 130021, China
睡眠是人体十分重要的生理功能。随着社会竞争的加剧,人们的压力越来越大,熬夜的人群数量逐年递增,失眠已经十分普遍。睡眠亚健康状态严重地影响着人们的生活质量和身体健康。近年来,随着失眠患者数量的增多和人们自我保健意识的建立,镇静催眠药的需求量已经逐年增加。西医的镇静催眠药物存在较多不良反应,如依赖性、成瘾性和戒断症状等[1],因而其应用受到限制。近年来研究[2]显示:许多天然药物(中药复方、中药提取物及中药活性成分)具有良好的镇静催眠作用,而且不良反应少,具有良好的开发利用价值,现已经成为寻找潜在天然镇静催眠药物的重要选择。
五加科(Araliaceae)药用植物刺五加[Acanthopanax senticosu (Rupr.et Maxim.) Harms],也称为“西伯利亚人参”,别名五加参、刺拐棒,为多年生落叶灌木,其根、茎、叶、皮和果实均可入药[3]。研究[4]显示:刺五加含有多种活性成分,自身毒性弱且不良反应少,在全球医学界的应用已得到广泛关注。现代药理学研究[5-12]表明:刺五加叶具有血小板聚集、抗炎和α-葡萄糖苷酶抑制活性,刺五加根具有抗疲劳作用,刺五加茎皮具有抗胃溃疡作用,刺五加果具有抗疲劳和降血脂活性,但是关于刺五加资源的应用主要是集中在其根、茎和叶部分,而有关刺五加果的药理作用报道较少,以刺五加果为原料开发的产品较早是以药酒的形式出现,到目前为止以刺五加果为原料开发的产品多为刺五加果酒和饮料等[13]。有研究[14-16]显示:刺五加果提取物中含有多种人体必需微量元素、全部必需氨基酸、葡萄糖和果糖等单寡糖以及皂苷、维生素C等多种对机体有益的成分。也有研究[17]显示:刺五加果口服液具有延长戊巴比妥钠睡眠时间、缩短戊巴比妥钠睡眠潜伏期及协同阈下剂量戊巴比妥钠催眠的功效,提示刺五加果具有镇静催眠的作用,但其作用机制尚不清楚。为促进刺五加果的开发和利用,本研究利用刺五加果水提物(Acanthopanax senticosus fruit water extract, ASF-WE)和刺五加果醇提物(Acanthopanax senticosus fruit alcohol extract, ASF-AE)与5-羟色氨酸(5-hydroxytryptophan,5-HTP)、氟马西尼(flumazenil,FLU)的联合给药实验、ASF-WE和ASF-AE改善对氯苯丙氨酸(parachloropheny lalanine,pCPA)诱导失眠小鼠的睡眠实验及观察小鼠脑内海马区神经递质水平的变化,初步考察ASF-WE和ASF-AE的镇静催眠机制,为以刺五加果为原料的保健食品和药品的研发提供依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器ICR雄性小鼠,体质量18~22 g,由长春亿斯实验动物技术有限公司提供,动物生产许可证号:SCXK (吉) 2016-0003。小鼠在标准实验室条件下(温度25℃±2℃,相对湿度60%±5%,12h光/12h暗循环)饲养,饲养期间随意饮水摄食;驯化1周后,将所有小鼠随机分为不同实验组。刺五加果实采自吉林农业大学药用植物园,经韩忠明副教授鉴定为五加科五加属刺五加的果实,阴干备用。地西泮(diazepam,DZP)由太原振兴制药有限公司提供,戊巴比妥钠购于上海默克化工技术有限公司,FLU注射剂由海南灵康制药有限公司生产,pCPA和5-HTP均购自大连美隆药业有限公司,ELISA试剂盒购自南京建成生物工程研究所。JA2003J电子天平购于上海舜宇恒平科学仪器有限公司,Avanti TM J-3OI冷冻离心机购于海南赫敏仪器有限公司,Spectra MAX 190酶标仪购于上海美谷分子仪器有限公司,DY89-1电动玻璃匀浆机购于宁波新芝生物科技股份有限公司,ZZ-6小鼠自主活动测试仪购于成都泰盟软件有限公司。
1.2 ASF-WE和ASF-AE的制备ASF-WE:干燥的刺五加果样品粉碎(过40目筛),取200 g加蒸馏水浸泡过夜,10倍量蒸馏水100℃蒸煮3次,每次1 h,过滤,合并滤液,旋转蒸发仪减压浓缩后置于水浴锅60℃蒸发至稠膏,即得水提浸膏,得率为22.3 %,按照参考文献[18]中方法,测定ASF-WE总黄酮含量为4.50 %,总皂苷含量为2.65 %。
ASF-AE:干燥的刺五加果样品粉碎(过40目筛),取200 g加95%乙醇浸泡过夜,10倍量95%乙醇超声波辅助(频率100 Hz,温度30℃)提取3次,每次1 h,过滤,合并滤液,旋转蒸发仪减压浓缩后置水浴锅60℃蒸发至稠膏,即得醇提浸膏,得率为6.8%,按照参考文献[18]中方法,测定ASF-AE总黄酮含量为6.21%,总皂苷含量为3.79%。
1.3 实验动物分组及给药 1.3.1 自主活动仪测定小鼠自主活动次数雄性ICR小鼠120只,适应性饲养1周后,随机分为空白对照组、阳性对照(DZP)组、不同剂量(4、8、16、32和64 mg·kg-1)ASF-WE组和不同剂量(4、8、16、32和64 mg·kg-1)ASF-AE组。药物以蒸馏水配置成相应浓度的药液,各给药组小鼠每日灌胃给予相应剂量的药物,给药量为0.1 mL·10g-1;空白对照组小鼠给予等体积的蒸馏水,每天1次,连续给药5d;DZP组小鼠灌胃给予等体积生理盐水,连续给予4 d,第5天一次性灌胃给予3mg·kg-1 DZP,给药量为0.1mL·10g-1。末次给药30min后,将各组小鼠放置于自主活动记录仪中,先适应10min,再开始记录,记录各组小鼠5min内的自主活动次数[19]。在每次测量结束时,用75%酒精彻底清洗自主活动记录仪外壳,以避免对下一只小鼠活动产生影响。
1.3.2 测定ASF-WE和ASF-AE协同阈下剂量戊巴比妥钠诱导小鼠睡眠实验中小鼠入睡率分组及给药方法同“1.3.1”,末次给药前8 h小鼠禁食不禁水,末次给药30min后,各组小鼠分别腹腔注射阈下剂量戊巴比妥钠(使90%~100%小鼠翻正反射不消失的最大剂量,预实验测定最大剂量为28 mg·kg-1)。在30min内小鼠翻正反射消失达到1min以上者视为发生睡眠现象,记录睡眠小鼠数量。
1.3.3 测定ASF-WE和ASF-AE协同催眠剂量戊巴比妥钠诱导小鼠睡眠实验中小鼠睡眠潜伏期和睡眠时间分组及给药方法同“1.3.1”,末次给药前8 h禁食不禁水,末次给药30min后,各组小鼠分别腹腔注射催眠剂量戊巴比妥钠(使100%小鼠入睡最小剂量,预实验测定最小剂量为48 mg·kg-1)。以小鼠从腹腔注射戊巴比妥钠到翻正反射消失的这段时间作为睡眠潜伏期,而翻正反射消失至恢复的时间作为小鼠的睡眠时间[20],观察并记录小鼠睡眠潜伏期和睡眠持续时间。
1.3.4 测定亚催眠剂量ASF-WE和ASF-AE与5-HTP协同诱导小鼠睡眠实验中小鼠睡眠潜伏期和睡眠时间ASF-WE和ASF-AE的亚催眠剂量为8 mg·kg-1,由“1.3.1~1.3.3”实验确定。雄性ICR小鼠40只,适应性饲养1周后随机分为4组,每组10只,分别为空白对照组、5-HTP组、ASF-WE(8 mg·kg-1)+5-HTP组和ASF-AE(8 mg· kg-1)+5-HTP组。各组小鼠每日灌胃给予相应剂量的药物,给药量为0.1mL·10g-1,空白对照组和5-HTP组小鼠给予等体积蒸馏水,每天1次,连续给药5d。末次给药前8h禁食不禁水,末次给药30min后,除空白对照组外各组小鼠分别给予5-HTP(2.5 mg·kg-1,腹腔注射),间隔15min后,再给予各组小鼠催眠剂量的戊巴比妥钠(48 mg·kg-1,腹腔注射),观察并记录各组小鼠睡眠潜伏期和睡眠持续时间[21]。
1.3.5 测定催眠剂量ASF-WE和ASF-AE改善pCPA诱导的失眠小鼠睡眠实验中小鼠睡眠潜伏期和睡眠时间由“1.3.1~1.3.3”实验确定ASF-WE和ASF-AE的催眠剂量为32 mg· kg-1。雄性ICR小鼠40只,适应性饲养1周后,随机分为4组,每组10只,分别为空白对照组、pCPA组、ASF-WE(32 mg· kg-1)+pCPA组和ASF-AE(32 mg· kg-1)+pCPA组。ASF-WE+pCPA组和ASF-AE+pCPA组小鼠每日上午灌胃给予相应剂量药物,每天1次,连续给药5 d;下午腹腔注射pCPA(100 mg·kg-1),每天1次,连续给药4 d。pCPA组小鼠每日腹腔注射pCPA(100 mg·kg-1),每天1次,连续给药4 d;空白对照组小鼠给予等量蒸馏水,每天1次,连续给药5d;各组小鼠给药量均为0.1mL·10g-1。末次给药前8h禁食不禁水,末次给药30min后,各组小鼠给予催眠剂量的戊巴比妥钠(48 mg·kg-1,腹腔注射),观察并记录各组小鼠睡眠潜伏期和睡眠持续时间[22]。
1.3.6 测定催眠剂量ASF-WE和ASF-AE改善FLU诱导的失眠小鼠睡眠实验中小鼠睡眠潜伏期和睡眠时间雄性ICR小鼠80只,适应性饲养1周后,随机分成8组,每组10只,分别为空白对照组、FLU组、DZP组、ASF-WE (32 mg·kg-1)组、ASF-AE(32 mg·kg-1)组、DZP+FLU组、ASF-WE(32 mg·kg-1)+FLU组和ASF-AE(32 mg·kg-1)+FLU组。各给药组小鼠每日灌胃给予相应剂量的药物;空白对照组和FLU组小鼠给予等体积蒸馏水,每天1次,连续给药5d;DZP组小鼠灌胃给予等体积生理盐水,连续给予4d,第5天一次性灌胃给予DZP(3 mg·kg-1);各组小鼠给药量均为0.1mL·10g-1。末次给药前8h禁食不禁水,末次给药30min后,FLU组和各联合给药组小鼠分别腹腔注射FLU(8 mg·kg-1),间隔15 min后,各组小鼠给予催眠剂量的戊巴比妥钠(48 mg·kg-1,腹腔注射),观察并记录各组小鼠睡眠潜伏期和睡眠持续时间。
1.3.7 ELISA法检测各组小鼠大脑海马组织中5-羟色胺(5-hydroxytryptamine, 5-HT)和γ-氨基丁酸(γ-amino butyric acid, GABA)水平行为学实验后,立刻同一时间断颈处死小鼠,在冰盘上解剖分离小鼠大脑海马组织,用冰凉生理盐水冲洗海马组织,匀浆,4℃、12000 r·min-1离心10 min,收集上清液,采用ELISA法并按照试剂盒说明书操作,检测小鼠海马组织中5-HT和GABA水平,尽量在同一时间同一条件下检测。
1.4 统计学分析采用SPSS 17.0统计软件进行统计学分析。采用Prism 6(GraphPad)软件作图。小鼠自主活动次数、睡眠潜伏期、睡眠时间和小鼠大脑海马组织中相关神经递质水平经正态性检验,均符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t法。以P<0.05为差异有统计学意义。
2 结果 2.1 各组小鼠自主活动次数与空白对照组比较,DZP组小鼠自主活动次数明显减少(P<0.01),32、64 mg·kg-1 ASF-WE组和16、32、64 mg·kg-1 ASF-AE组小鼠自主活动次数不同程度减少(P<0.05或P<0.01),32 mg·kg-1ASF-WE组和32mg·kg-1 ASF-AE组小鼠自主活动次数明显减少(P<0.01)。见表 1。
| (n=10, x±s) | |||||||||||||||||||||||||||||
| Group | Number of locomotor activity | ||||||||||||||||||||||||||||
| Blank control | 124.50±12.68 | ||||||||||||||||||||||||||||
| DZP | 56.50±7.18** | ||||||||||||||||||||||||||||
| ASF-WE(mg·kg-1) | |||||||||||||||||||||||||||||
| 4 | 127.00±15.34 | ||||||||||||||||||||||||||||
| 8 | 120.50±10.78 | ||||||||||||||||||||||||||||
| 16 | 113.50±8.02 | ||||||||||||||||||||||||||||
| 32 | 99.50±9.14** | ||||||||||||||||||||||||||||
| 64 | 105.75±9.28* | ||||||||||||||||||||||||||||
| ASF-AE(mg·kg-1) | |||||||||||||||||||||||||||||
| 4 | 111.50±8.73 | ||||||||||||||||||||||||||||
| 8 | 110.00±10.55 | ||||||||||||||||||||||||||||
| 16 | 102.00±13.29* | ||||||||||||||||||||||||||||
| 32 | 85.50±8.22** | ||||||||||||||||||||||||||||
| 64 | 96.75±14.97* | ||||||||||||||||||||||||||||
| *P<0.05,**P<0.01 vs blank control group. | |||||||||||||||||||||||||||||
给予各组小鼠亚催眠剂量戊巴比妥钠后,与空白对照组比较,16、32、64 mg·kg-1 ASF-WE组和8、16、32、64 mg·kg-1ASF-AE组小鼠入睡率有不同程度增加,且呈一定的剂量依赖性。见表 2。当给予各组小鼠催眠剂量戊巴比妥钠后,与空白对照组比较,16、32、64 mg·kg-1 ASF-WE组和16、32、64 mg·kg-1ASF-AE组小鼠睡眠潜伏期缩短(P<0.05或P<0.01),睡眠持续时间延长(P<0.05或P<0.01),且呈一定的剂量依赖性。32 mg·kg-1ASF-WE组和32 mg· kg-1ASF-AE组小鼠入睡潜伏期明显缩短(P<0.01),小鼠睡眠时间明显延长(P<0.01),故确定该剂量为催眠剂量;而ASF-WE和ASF-AE在8 mg·kg-1剂量以下各组小鼠,无论是睡眠潜伏期还是睡眠时间均无明显改变,故确定该剂量为亚催眠剂量。见表 3。
| Group | No. of falling asleep/total | Sleep rate (η/%) |
| Blank control | 0/10 | 0 |
| DZP | 9/10 | 90 |
| ASF-WE(mg·kg-1) | ||
| 4 | 0/10 | 0 |
| 8 | 0/10 | 0 |
| 16 | 3/10 | 30 |
| 32 | 6/10 | 60 |
| 64 | 5/10 | 50 |
| ASF-AE(mg·kg-1) | ||
| 4 | 0/10 | 0 |
| 8 | 1/10 | 10 |
| 16 | 4/10 | 40 |
| 32 | 7/10 | 70 |
| 64 | 6/10 | 60 |
| (n=10, x±s, t/min) | |||||||||||||||||||||||||||||
| Group | Sleep latency | Sleep time | |||||||||||||||||||||||||||
| Blank control | 8.25±1.25 | 23.00±3.74 | |||||||||||||||||||||||||||
| DZP | 2.50±0.57 | 84.75±5.56 | |||||||||||||||||||||||||||
| ASF-WE(mg·kg-1) | |||||||||||||||||||||||||||||
| 4 | 9.25±0.50 | 21.50±6.75 | |||||||||||||||||||||||||||
| 8 | 8.75±0.95 | 28.00±3.65 | |||||||||||||||||||||||||||
| 16 | 6.25±0.50* | 35.50±7.18* | |||||||||||||||||||||||||||
| 32 | 4.75±0.95** | 47.00±6.83** | |||||||||||||||||||||||||||
| 64 | 5.50±1.73* | 40.00±8.32* | |||||||||||||||||||||||||||
| ASF-AE(mg·kg-1) | |||||||||||||||||||||||||||||
| 4 | 8.50±1.29 | 25.50±7.32 | |||||||||||||||||||||||||||
| 8 | 7.25±1.70 | 26.50±6.45 | |||||||||||||||||||||||||||
| 16 | 5.50±0.57* | 34.00±9.96* | |||||||||||||||||||||||||||
| 32 | 4.00±0.81** | 55.25±11.89** | |||||||||||||||||||||||||||
| 64 | 6.00±0.81* | 43.75±10.68* | |||||||||||||||||||||||||||
| *P<0.05,**P<0.01 vs blank control group. | |||||||||||||||||||||||||||||
为了确定ASF-WE和ASF-AE的催眠作用是否与5-HT能神经系统有关,分别采用亚催眠剂量(8 mg·kg-1)ASF-WE和ASF-AE与亚有效剂量5-HTP(2.5 mg· kg-1)进行联合给药实验,结果显示:与空白对照组和5-HTP组比较,ASF-WE+5-HTP组和ASF-AE+5-HTP组小鼠睡眠潜伏期明显缩短(P<0.01),睡眠时间明显延长(P<0.01)。见表 4。
| (n=10, x±s, t/min) | |||||||||||||||||||||||||||||
| Group | Sleep latency | Sleep time | |||||||||||||||||||||||||||
| Blank control | 8.50±1.29 | 13.00±3.16 | |||||||||||||||||||||||||||
| 5-HTP | 8.00±0.81 | 21.25±7.71 | |||||||||||||||||||||||||||
| ASF-WE+5-HTP | 5.00±1.41*△ | 46.75±13.69*△ | |||||||||||||||||||||||||||
| ASF-AE+5-HTP | 5.25±1.25*△ | 48.25±15.26*△ | |||||||||||||||||||||||||||
| *P<0.01 vs blank control group; △P<0.01 vs 5-HTP group. | |||||||||||||||||||||||||||||
与空白对照组比较,pCPA组小鼠睡眠潜伏期明显延长(P<0.01),睡眠时间明显缩短(P<0.01),表明失眠模型成功建立。与pCPA组比较,ASF-WE+pCPA组和ASF-AE+pCPA组小鼠睡眠潜伏期明显缩短(P<0.05),睡眠时间明显延长(P<0.01)。见表 5。
| (n=10, x±s, t/min) | |||||||||||||||||||||||||||||
| Group | Sleep latency | Sleep time | |||||||||||||||||||||||||||
| Blank control | 5.25±0.50 | 46.00±4.32 | |||||||||||||||||||||||||||
| pCPA | 8.50±1.73* | 26.00±9.09* | |||||||||||||||||||||||||||
| ASF-WE+pCPA | 5.75±0.95△ | 47.50±4.20*△△ | |||||||||||||||||||||||||||
| ASF-AE+pCPA | 6.00±0.81△ | 47.25±6.20*△△ | |||||||||||||||||||||||||||
| *P<0.01 vs blank control group; △P<0.05, △△P<0.01 vs pCPA group. | |||||||||||||||||||||||||||||
与空白对照组比较,FLU组小鼠睡眠潜伏期明显延长(P<0.01),睡眠时间明显缩短(P<0.05);与FLU组比较,DZP+FLU组、ASF-WE+FLU组和ASF-AE+FLU组小鼠睡眠潜伏期明显缩短(P<0.05或P<0.01),睡眠潜伏期明显延长(P<0.01);与DZP组比较,DZP+FLU组小鼠睡眠潜伏期明显延长(P<0.05),睡眠时间明显缩短(P<0.01)。与ASF-WE组比较,ASF-WE+FLU组小鼠睡眠潜伏期明显延长(P<0.05),睡眠时间明显缩短(P<0.01)。与ASF-AE组比较,ASF-AE+FLU组小鼠睡眠潜伏期虽有延长,但差异无统计学意义(P>0.05),而睡眠时间明显缩短(P<0.01)。见表 6。
| (n=10, x±s, t/min) | |||||||||||||||||||||||||||||
| Group | Sleep latency | Sleep time | |||||||||||||||||||||||||||
| Blank control | 5.25±0.50 | 44.50±11.26 | |||||||||||||||||||||||||||
| FLU | 8.00±0.81** | 27.75±10.59* | |||||||||||||||||||||||||||
| DZP | 2.00±0.81 | 123.00±12.93 | |||||||||||||||||||||||||||
| DZP+FLU | 3.25±0.50△△# | 94.75±12.28△△## | |||||||||||||||||||||||||||
| ASF-WE | 4.50±0.57 | 94.50±17.54 | |||||||||||||||||||||||||||
| ASF-WE+FLU | 5.75±0.95△○ | 59.00±12.24△△○○ | |||||||||||||||||||||||||||
| ASF-AE | 4.00±0.81 | 95.75±15.23 | |||||||||||||||||||||||||||
| ASF-AE+FLU | 4.75±0.95△ | 61.50±10.40△△▲ | |||||||||||||||||||||||||||
| *P<0.05, **P<0.01 vs blank control group; △ P<0.05, △△P<0.01 vs FLU group; #P<0.05, ##P<0.01 vs DZP group; ○P<0.05, ○○P<0.01 vs ASF-WE group; ▲P<0.01 vs ASF-AE group. | |||||||||||||||||||||||||||||
与空白对照组比较,5-HTP(2.5 mg·kg-1)组、ASF-WE(8 mg·kg-1)组和ASF-AE(8 mg·kg-1)组小鼠海马组织中5-HT水平无明显变化(P>0.05);与5-HTP组比较,ASF-WE+ 5-HTP组和ASF-AE+5-HTP组小鼠海马组织中5-HT水平明显升高(P<0.05)。见图 1A。
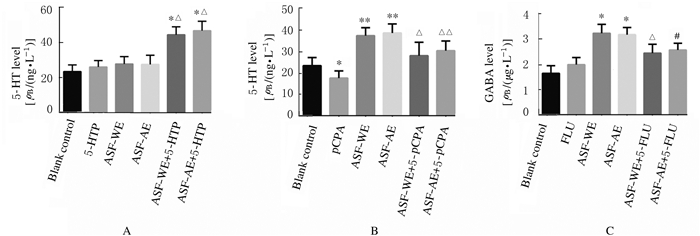
|
| A: 5-HTlevel (*P < 0.05 vs blank control group; △P < 0.05 vs 5-HTP group); B:5-HT level(*P < 0.05, * *P < 0.01 vs blank control group; △P < 0.05, △△P < 0.01 vs pCPA group); C: GABA level(*P < 0.05 vs blank control group; △P < 0.05 vs ASF-WE group; #P < 0.05 vs ASF-AE group). 图 1 各组小鼠海马组织中5-HT和GABA水平 Fig. 1 Levels of 5-HT and GABA in hippocampus tissue of mice in various groups |
|
|
与空白对照组比较,pCPA(100 mg·kg-1)组小鼠海马组织中5-HT水平明显降低(P<0.05);与pCPA组比较,ASF-WE(32 mg·kg-1)+pCPA组和ASF-AE(32 mg·kg-1)+pCPA组小鼠海马组织中5-HT水平明显升高(P<0.05或P<0.01)。见图 1B。
与空白对照组比较,ASF-WE(32 mg·kg-1)组和ASF-AE(32 mg·kg-1)组小鼠海马组织中GABA水平明显升高(P<0.05);与ASF-WE组和ASF-AE组比较,ASF-WE+FLU组和ASF-AE+FLU组小鼠海马组织中GABA水平均明显降低(P<0.05)。见图 1C。
3 讨论本文作者通过小鼠自主活动实验、激动剂拮抗剂联合给药实验及对海马区相关神经递质影响实验,评价ASF-WE和ASF-AE的镇静催眠活性,并探讨了其初步作用机制。
中枢神经系统兴奋性降低时,小鼠自主活动将减弱,小鼠的自主活动性通常作为评价试验药物是否具有镇静作用的指标[23]。戊巴比妥钠诱导睡眠实验以小鼠入睡率、入睡潜伏期和睡眠持续时间作为评价试验药物与戊巴比妥钠的协同催眠作用效应指标[24]。本研究结果表明:ASF-WE和ASF-AE均能明显减少小鼠自主活动次数,提高催眠剂量戊巴比妥钠诱导睡眠的小鼠入睡率,缩短小鼠入睡潜伏期,延长睡眠持续时间,发挥镇静催眠作用,并且ASF-AE的镇静催眠作用一定程度上优于ASF-WE。研究[25]显示:刺五加中的异嗪皮啶可能是其发挥镇静催眠作用的主要有效成分,而异嗪皮啶作为香豆素类有机小分子,更易溶于乙醇而难溶于水,这可能是刺五加果在镇静催眠方面ASF-AE优于ASF-WE的原因之一。
脑内有多种中枢神经递质参与个体的精神活动,其中5-HT是调节机体睡眠的主要神经递质之一,直接或间接地参与睡眠-觉醒系统的功能。5-HTP可以在5-羟色胺脱羧酶作用下产生5-HT,提高脑组织中5-HT水平,研究[26]证实:小鼠注射5-HTP后脑组织中5-HT水平明显升高,可缓解失眠症状,提高睡眠质量。而pCPA是色氨酸羟化酶的抑制剂,可阻断5-HT的合成,降低5-HT水平,从而缩短小鼠的睡眠时间[27]。本研究结果显示:亚催眠剂量的ASF-WE和ASF-AE均可与5-HT前体物质5-HTP发挥协同作用,使小鼠海马组织中5-HT水平升高,进而促进小鼠的睡眠;进一步结合刺五加果提取物可改善由pCPA引起的小鼠失眠现象的实验结果推测:ASF-WE和ASF-AE的镇静催眠作用与5-HT能神经系统有密切关联,其机制尚待进一步深入研究。
除5-HT外,GABA是与调节睡眠相关的另一种重要的神经递质。作为中枢神经系统内最重要的抑制性神经递质,GABA维持着脑内兴奋抑制的平衡,其水平低下时会导致其脑内抑制功能不足,引起头痛、焦虑、紧张不安和暴躁易怒等[28]。GABA可通过与GABAA型受体(GABAA)结合,导致大量Cl-内流,引起细胞膜超极化使神经元兴奋性降低,发挥镇静催眠作用[29]。DZP作为一种具有代表性的镇静催眠药,通过与GABAA -苯二氮卓类(BZD)受体结合释放GABA,调节睡眠;相反,FLU作为一种特异性BZD拮抗剂,能有效诱导小鼠失眠[30]。本研究结果表明:FLU可抑制ASF-WE和ASF-AE的催眠作用,并可阻断其对小鼠海马组织中GABA水平的提升作用,说明ASF-WE和ASF-AE的镇静睡眠作用与GABA能系统也有密切关联。
综上所述,ASF-WE和ASF-AE均有良好的镇静催眠效果,并初步推测其镇静催眠作用与5-HT能和GABA能中枢神经系统有关。本研究为促进刺五加果的开发,实现刺五加资源的综合利用提供了科学依据。
| [1] |
燕霞. 口服镇静催眠药中毒66例临床及药物分析[J]. 中国继续医学教育, 2019, 11(27): 129-131. |
| [2] |
魏欣, 杨圣俊, 任炳南, 等. 新型镇静催眠药的临床应用及其进展[J]. 中国医院用药评价与分析, 2015, 15(6): 841-843. |
| [3] |
JIN LJ, WU FF, LI XY, et al. Anti-depressant effects of aqueous extract from Acanthopanax senticosus in mice[J]. Phytother Res, 2013, 27(12): 1829-1833. |
| [4] |
XIE YL, ZHANG B, ZHANG YJ. Protective effects of Acanthopanax polysaccharides on cerebral ischemia-reperfusion injury and its mechanisms[J]. Int J Biol Macromol, 2015, 72: 946-950. |
| [5] |
JIN J L, LEE S, LEE Y Y, et al. Platelet anti-aggregating triterpenoids from the leaves of acanthopanax senticosus and the fruits of A. sessiliflorus[J]. Planta Med, 2004, 70(6): 564-566. |
| [6] |
JUNG H J, NAM J H, CHOI J, et al. Antiinflammatory effects of chiisanoside and chiisanogenin obtained from the leaves of Acanthopanax chiisanensis in the carrageenan- and Freund's complete adjuvant-induced rats[J]. J Ethnopharmacol, 2005, 97(2): 359-367. |
| [7] |
WANG Z B, JIANG H, XIA Y G, et al. α-Glucosidase inhibitory constituents from Acanthopanax senticosus harm leaves[J]. Molecules, 2012, 17(6): 6269-6276. |
| [8] |
ZHOU H, XING J, LIU S, et al. Screening and determination for potential α-glucosidase inhibitors from leaves of Acanthopanax senticosus harms by using UF-LC/MS and ESI-MS(n)[J]. Phytochem Analy, 2012, 23(4): 315-323. |
| [9] |
HUANG L Z, HUANG B K, YE Q, et al. Bioactivity-guided fractionation for anti-fatigue property of Acanthopanax senticosus[J]. J Ethnopharmacol, 2011, 133(1): 213-219. |
| [10] |
FUJIKAWA T, YAMAGUCHI A, MORITA I, et al. Protective effects of Acanthopanax senticosus Harms from Hokkaido and its components on gastric ulcer in restrained cold water stressed rats[J]. Biol Pharm Bull, 1996, 19(9): 1227-1230. |
| [11] |
丛登立, 王浩天, 高笑一, 等. 刺五加果的抗疲劳作用[J]. 吉林大学学报(医学版), 2010, 36(5): 891-894. |
| [12] |
闫兆威, 周明娟, 刘金平, 等. 刺五加果肉总皂苷对实验性高脂血症小鼠血脂的影响[J]. 特产研究, 2009, 31(4): 35-36, 43. |
| [13] |
姜瑞平, 徐晶, 朱俊义. 刺五加果实的综合利用现状[J]. 人参研究, 2009, 21(2): 25-26. |
| [14] |
张丽萍, 陈丽颖, 孙棫久, 等. 刺五加果化学成分的分析[J]. 东北师大学报(自然科学版), 1992, 24(1): 123-127. |
| [15] |
姚慧敏, 关颖丽, 朱俊义, 等. UPLC法同时测定野生刺五加果和根中5种主要成分的含量[J]. 中国药房, 2016, 27(12): 1668-1671. |
| [16] |
闫兆威, 周明娟, 卢丹, 等. 刺五加果肉化学成分的研究[J]. 天然产物研究与开发, 2010, 22(6): 1015-1017, 1030. |
| [17] |
粘成贺.刺五加果实口服液的制备及其睡眠功能的研究[D].长春: 长春师范大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10205-1018847857.htm
|
| [18] |
胡勇超, 符群. 刺五加不同部位的乙醇提取物成分分析[J]. 森林工程, 2018, 34(6): 1-6. |
| [19] |
刘瑾, 李岩, 王爱洁, 等. 桑椹补脑膏对小鼠镇静催眠作用实验研究[J]. 辽宁中医药大学学报, 2015, 17(3): 17-19. |
| [20] |
刘威良, 黄艾祥. 天麻素注射液对小鼠镇静的催眠作用[J]. 热带农业科学, 2019, 39(9): 51-57. |
| [21] |
巨帅, 张英英, 潘婷婷. 酸枣仁-五味子提取物对小鼠的镇静催眠作用研究[J]. 科技与创新, 2019(16): 49-51. |
| [22] |
肖成荣, 马增春, 李海静, 等. PCPA失眠大鼠模型的制作及其机制[J]. 毒理学杂志, 2007, 21(4): 326. |
| [23] |
涂人顺, 张国玺, 孙斌辉. 关于小鼠自主活动规律的研究[J]. 中国药理学通报, 2002, 18(4): 464-465. |
| [24] |
王敏, 许春艳. 近十年失眠症的研究进展[J]. 内蒙古民族大学学报(自然科学版), 2002, 17(4): 364-368. |
| [25] |
康施瑶, 李廷利. 异嗪皮啶镇静催眠作用的研究[J]. 中医药学报, 2016, 44(6): 30-32. |
| [26] |
XIONG YF, ULLMAN B, CHOI J S K, et al. Identification of fused bicyclic heterocycles as potent and selective 5-HT (2A) receptor antagonists for the treatment of insomnia[J]. Bioorg Med Chem Lett, 2012, 22(5): 1870-1873. |
| [27] |
SCHAEFER T L, VORHEES C V, WILLIAMS M T. Mouse plasmacytoma-expressed transcript 1 knock out induced 5-HT disruption results in a lack of cognitive deficits and an anxiety phenotype complicated by hypoactivity and defensiveness[J]. Neuroscience, 2009, 164(4): 1431-1443. |
| [28] |
CHO S M, SHIMIZU M, LEE C J, et al. Hypnotic effects and binding studies for GABA(a) and 5-HT(2C) receptors of traditional medicinal plants used in Asia for insomnia[J]. J Ethnopharmacol, 2010, 132(1): 225-232. |
| [29] |
FERNANDEZ-MENDOZA J, BAKER J H, VGONTZAS A N, et al. Insomnia symptoms with objective short sleep duration are associated with systemic inflammation in adolescents[J]. Brain Behav Immun, 2017, 61: 110-116. |
| [30] |
MÜLLER HERDE A, BENKE D, RALVENIUS W T, et al. GABAA, receptor subtypes in the mouse brain:Regional mapping and diazepam receptor occupancy by in vivo, [18F]flumazenil PET[J]. NeuroImage, 2017, 150(Complete): 279-291. |
 2020, Vol. 46
2020, Vol. 46


