扩展功能
文章信息
- 李环, 曲振廷, 钱鸿昊, 徐晗, 曲莉, 张晶, 王洪艳, 徐小磊
- LI Huan, QU Zhenting, QIAN Honghao, XU Han, QU Li, ZHANG Jing, WANG Hongyan, XU Xiaolei
- 人参皂苷Rg1联合人参皂苷Rg3对雄性生殖功能损伤模型小鼠生殖功能的改善作用
- Improvement effect of ginsenoside Rg1 combined with ginsenoside Rg3 on reproductive function in male model mice with reproductive function injury
- 吉林大学学报(医学版), 2020, 46(04): 707-713
- Journal of Jilin University (Medicine Edition), 2020, 46(04): 707-713
- 10.13481/j.1671-587x.20200407
-
文章历史
- 收稿日期: 2020-01-20
2. 吉林省吉林中西医结合医院儿科, 吉林 吉林 132012
2. Department of Pediatrics, Jilin Combined Traditional Chinese and Western Hospital, Jilin 132012, China
男性不育为男科病中常见病和多发病。与十年前比较,男性精子质量和数量均有较大幅度下降,生育能力低下及不育的患者日益增多[1]。目前,西医对不育症治疗的临床效果并不理想,因此开发新的更安全和更有效的中药制剂对临床男性不育症患者进行治疗具有重要意义。
明朝医药学家李时珍认为“人参治男妇一切虚症”。服用人参粗提物后可以提高精子数量和精子活力,可以促进下丘脑-垂体-睾丸轴发挥作用[2-3]。人参皂苷Rg1(ginsenoside Rg1)和人参皂苷Rg3(ginsenoside Rg3)是人参中最具活性的成分,已有研究[4]表明:人参皂苷Rg1能明显逆转棉酚所致的精子数量降低,增强受损伤的精子活力,提高生精能力。但有关人参皂苷Rg1的生精作用机制目前国内外尚未见报道。人参皂苷Rg3能改善糖尿病大鼠抗链脲霉素的勃起功能障碍[5],并能通过下调miR-26a保护小鼠睾丸间质细胞[6]。为了能取得较好的不育症防治的效果, 多药联用是现代临床医学的新手段。目前,人参皂苷Rg1联合人参皂苷Rg3对生殖功能损伤的改善作用及相关机制尚未见报道。
邻苯二甲酸二丁酯(dinbutyl phthalate, DBP)是公认的环境污染物,文献[7]报道及本课题组前期研究[8]表明:DBP具有明显的生殖毒性,可引起睾丸质量减轻、生精小管萎缩和生精功能受损。因此,本研究采用DBP灌胃制备雄性生殖功能损伤小鼠模型[9],同时给予人参皂苷Rg1和人参皂苷Rg3皮下注射,观察小鼠精子质量、睾丸组织病理学、血清性激素水平及睾丸组织中缝隙连接蛋白43(connexin 43,Cx43)蛋白表达的变化,探讨人参皂苷Rg1和人参皂苷Rg3联合应用对雄性生殖功能损伤小鼠生殖功能的改善作用及相关机制,为探索和开发天然、高效及安全的生精药物提供科学依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器清洁级C57BL/6雄性小鼠,6周龄,由吉林大学实验动物中心提供,动物生产许可证号:SCXK(吉)2010-0005。人参皂苷Rg1和Rg3(R)由吉林大学药学院提供。DBP购自美国Santa Cruz Biotechnology公司,苏木素和伊红购于北京鼎国昌盛生物技术有限公司,免疫荧光剂盒由武汉博士德生物公司提供,小鼠血清黄体生成素(luteinizing hormone,LH)、卵泡刺激素(follicle-stimulating hormone,FSH)和睾酮(testosterone,T)试剂盒由上海江来生物公司提供,Cx43兔多克隆抗体购于上海碧云天生物技术有限公司。WLJY-9000彩色精子质量检测系统购自北京伟力公司,DP20型正置荧光显微镜购于日本东京奥林巴斯公司。
1.2 实验动物分组、造模和给药采用DBP灌胃方法制作雄性生殖功能损伤小鼠模型[9]。本课题组前期实验[8]结果显示:400 mg·kg-1 DBP灌胃给药35d可以成功制备雄性生殖功能损伤小鼠模型,故此方法用于本次模型制备。本研究选用28只清洁级6周龄C57BL/6雄性小鼠,适应环境1周后,按2×2析因实验设计并依据体质量随机分为模型组(400 mg·kg-1DBP)、人参皂苷Rg1+DBP组(20 mg·kg-1人参皂苷Rg1,400 mg·kg-1DBP)、人参皂苷Rg3+DBP组(20 mg·kg-1人参皂苷Rg3,400 mg·kg-1DBP)和联合组(20 mg·kg-1人参皂苷Rg1,20 mg·kg-1人参皂苷Rg3,400 mg·kg-1DBP),每组7只。DBP溶于玉米油于每天上午8点灌胃给药,人参皂苷Rg1和人参皂苷Rg3溶于生理盐水于每天下午2点皮下注射给药,每天DBP灌胃给药和人参皂苷Rg1、人参皂苷Rg3皮下注射给药各1次。小鼠饲养环境:温度(22±2)℃,相对湿度(55±15)%,12h/12 h明/暗交替;各组小鼠均自由进食和饮水,实验期为35 d。实验结束后,各组小鼠眼球取血,室温静置后,2 500 r·min-1离心10 min,取血清,4℃冰箱保存样品;脊髓脱臼处死,取睾丸称质量并计算睾丸脏器系数,睾丸脏器系数=睾丸质量(mg)/小鼠体质量(g)。
1.3 小鼠精子质量分析精子滤液制备:将双侧附睾放入平皿中,剪碎附睾组织,在预热的生理盐水中37℃温育1~2 min,制备精子混悬液,然后滴加到预温的精子计数板上,应用WLJY-9000型精子质量检测系统检测各组小鼠的精子密度、精子活力和总畸形率。取4个视野,于2 min内完成检测。
1.4 小鼠睾丸组织病理学检查取小鼠一侧睾丸(左),4%多聚甲醛固定,将固定好的睾丸组织常规脱水、浸蜡、包埋和切片处理,常规苏木精-伊红(HE)染色,显微镜下拍照, 观察小鼠睾丸组织病理形态表现。
1.5 ELISA法检测小鼠血清中性激素水平采用ELISA法测定各组小鼠血清中T、FSH和LH水平,所有的操作均按照试剂盒说明进行。
1.6 免疫荧光法检测小鼠睾丸组织中Cx43蛋白表达水平将固定的睾丸组织病理切片经脱蜡至水、酶法修复抗原、血清封闭非特异性抗原(室温孵育10 min),滴加一抗(用5%BSA配制,浓度为1:100)于湿盒内4℃孵育过夜。第2天取出湿盒后室温复温1h,滴加生物素化二抗IgG(1:100稀释)于湿盒内,37℃孵育30 min;滴加DyLight 488-SABC(1:200稀释),37℃避光孵育30min。采用含有防荧光淬灭的甘油封片,1 h内完成采集图像(荧光显微镜),在每个切片中选取总面积,使用Image J软件分析荧光强度,以平均荧光强度表示Cx43蛋白表达水平。
1.7 统计学分析采用SPSS 13.0统计软件进行统计学分析。睾丸脏器系数、精子密度、精子活力、精子总畸形率和小鼠血清中T、FSH和LH及睾丸组织中Cx43蛋白表达水平经正态性检验呈正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。采用2×2析因实验设计分析方法评价联合作用特征,析因分析中,以P<0.05表示联合组2种药物间有交互作用,即人参皂苷Rg1和人参皂苷Rg3联合应用为协同作用或拮抗作用;以P>0.05表示联合组2种药物间无交互作用。
2 结果 2.1 各组小鼠睾丸脏器系数与模型组比较,联合组小鼠睾丸脏器系数明显升高(t=1.34,P= 0.034),人参皂苷Rg1+DBP组和人参皂苷Rg3+DBP组小鼠睾丸脏器系数差异无统计学意义(P>0.05)。见表 1。
| [n=7, x±s, wB/(mg·g-1)] | |||||||||||||||||||||||||||||
| Group | Organ coefficients of testis | ||||||||||||||||||||||||||||
| Model | 7.00±0.88 | ||||||||||||||||||||||||||||
| Ginsenoside Rg1+DBP | 7.57±0.87 | ||||||||||||||||||||||||||||
| Ginsenoside Rg3+DBP | 7.95±1.16 | ||||||||||||||||||||||||||||
| Combination | 8.64±1.45* | ||||||||||||||||||||||||||||
| *P<0.05 compared with model group. | |||||||||||||||||||||||||||||
与模型组比较,人参皂苷Rg1+DBP组、人参皂苷Rg3组+DBP和联合组小鼠精子密度和精子活力均明显升高(P<0.01),精子总畸形率差异无统计学意义(P>0.05)。见表 2。
| (n=7, x±s) | |||||||||||||||||||||||||||||
| Group | Sperm density(×106mL-1) | Sperm viability(η/%) | Total malformation rate(η/%) | ||||||||||||||||||||||||||
| Model | 29.00±2.61 | 17.12±2.90 | 14.76±3.08 | ||||||||||||||||||||||||||
| Ginsenoside Rg1+DBP | 35.93±5.19* | 24.69±2.79* | 14.03±3.07 | ||||||||||||||||||||||||||
| Ginsenoside Rg3+DBP | 37.53±6.01* | 24.22±2.43* | 13.89±2.52 | ||||||||||||||||||||||||||
| Combination | 46.05±5.06* | 37.55±3.53* | 13.72±2.87 | ||||||||||||||||||||||||||
| *P<0.01 compared with model group. | |||||||||||||||||||||||||||||
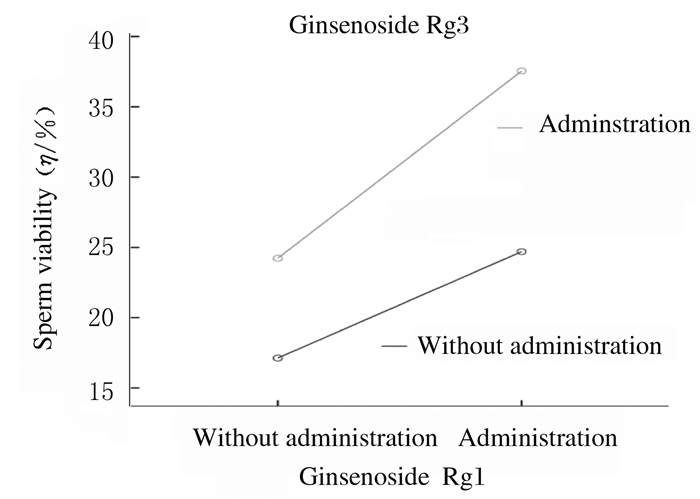
联合作用的析因分析结果显示:人参皂苷Rg1和人参皂苷Rg3联合应用与小鼠精子活力存在交互作用(F=6.704, P=0.016)。由图 1可见:2条量-效曲线随剂量增加而远离,提示人参皂苷Rg1和人参皂苷Rg3联合应用可使小鼠精子活力升高,具有协同作用。
|
| 图 1 人参皂苷Rg1与人参皂苷Rg3联合作用后小鼠精子活力分析 Fig. 1 Analysis on sperm viabilities of mice after treated with ginsenoside Rg1 and ginsenoside Rg3 |
|
|
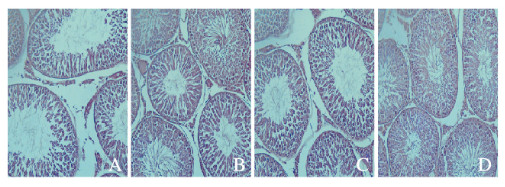
小鼠睾丸组织经HE染色后,光学显微镜400倍下观察生精上皮细胞层次、形态结构、脱落细胞和管腔受损程度。模型组小鼠睾丸组织生精上皮较薄,生精上皮细胞层次紊乱,甚至缺失,数量明显减少,管腔中生精细胞严重脱落,而且管腔内精子数量稀少;与模型组比较,人参皂苷Rg1+DBP组和人参皂苷Rg3+DBP组小鼠睾丸组织生精上皮变厚,生精上皮细胞排列较规则,数量有所增加,管腔中脱落细胞较少,支持细胞结构较完整,腔内精子数量增多;联合组小鼠睾丸组织生精上皮较厚,生精上皮结构完整,各级生精细胞排列规则且数量较多,曲细精管之间排列紧密,腔内精子丰富,在生精小管之间均匀分布间质细胞。见图 2(插页二)。
|
| A: Model group; B: Ginsenoside Rg1 + DBF group; C: Ginsenoside Rg3 + DBP group; D:Combination group. 图 2 各组小鼠睾丸组织病理形态表现(HE, ×400) Fig. 2 Pathomorphology of testis tissue of mice in various groups (HE, ×400) |
|
|
与模型组比较,人参皂苷Rg1+DBP组、人参皂苷Rg3组+DBP和联合组小鼠血清中T和LH水平明显升高(P<0.01),FSH水平明显降低(P<0.01)。见表 3。
| (n=7, x±s) | |||||||||||||||||||||||||||||
| Group | T [cB / (nmol·L-1)] | LH [ρB / (μg·L-1)] | FSH [λB / (IU·L-1)] | ||||||||||||||||||||||||||
| Model | 17.80±1.30 | 64.40±7.61 | 115.83±12.12 | ||||||||||||||||||||||||||
| Ginsenoside Rg1+DBP | 24.95±4.21* | 140.99±16.90* | 50.72±3.25* | ||||||||||||||||||||||||||
| Ginsenoside Rg3+DBP | 23.37±2.92* | 147.36±19.04* | 52.89±3.45* | ||||||||||||||||||||||||||
| Combination | 40.34±5.38* | 164.40±11.65* | 41.33±3.86* | ||||||||||||||||||||||||||
| *P<0.01 compared with model group. | |||||||||||||||||||||||||||||
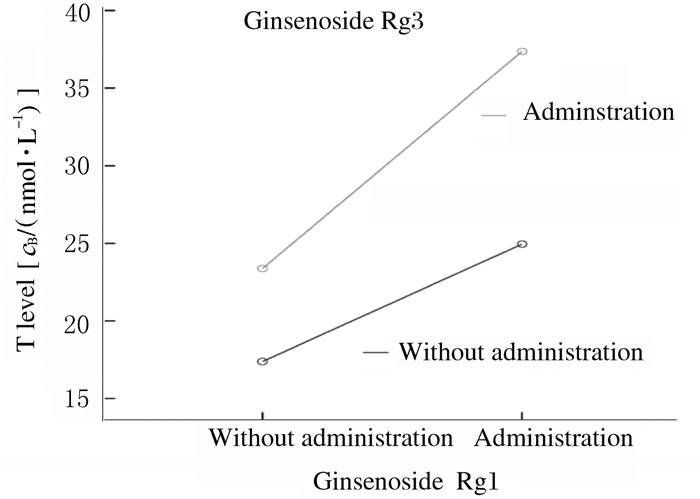
联合作用的析因分析结果显示:人参皂苷Rg1和人参皂苷Rg3联合应用与小鼠血清中T水平存在明显交互作用(F=4.912, P=0.036),而与LH和FSH水平交互作用不明显(P>0.05)。由图 3可见:2条量-效曲线随药物剂量增加而远离,提示人参皂苷Rg1和人参皂苷Rg3联合应用可使小鼠血清中T水平升高,具有协同作用。
|
| 图 3 人参皂苷Rg1与人参皂苷Rg3联合作用后小鼠血清中T水平分析 Fig. 3 Analysis on serum T levels of mice after treated with ginsenoside Rg1 and ginsenoside Rg3 |
|
|
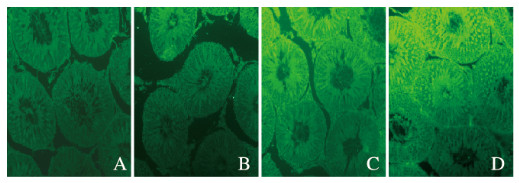
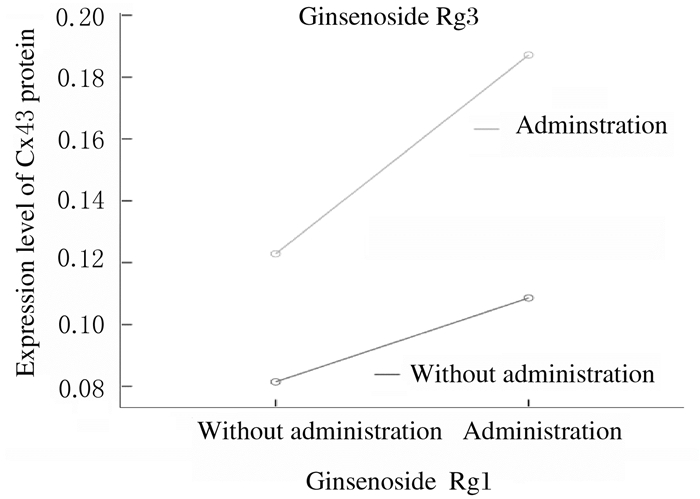
与模型组(0.081 4±0.013 5)比较,人参皂苷Rg1+DBP组、人参皂苷Rg3+DBP组和联合组小鼠睾丸组织中Cx43蛋白表达水平(0.108 6±0.006 9、0.122 9±0.025 0和0.187 1±0.025 6)均明显升高(P<0.05)。见图 4(插页二)。
|
| A: Model group; B: Ginsenoside Rg1 + DBF group; C: Ginsenoside Rg3 + DBP group; D:Combination group. 图 4 各组小鼠睾丸组织中Cx43蛋白表达情况(免疫荧光,×200) Fig. 4 Expressions of Cx43 protein in testis tissue of mice in various groups(Immunofluorescence, ×200) |
|
|
联合作用的析因分析结果显示:2条量-效曲线随药物剂量增加而远离(F=6.937, P= 0.018),提示人参皂苷Rg1、人参皂苷Rg3联合应用可增加小鼠睾丸组织中Cx43蛋白表达水平,具有协同作用。见图 5。
|
| 图 5 人参皂苷Rg1与人参皂苷Rg3联合作用后小鼠睾丸组织中Cx43蛋白表达水平 Fig. 5 Expressions levels of Cx43 protein in testis tissue of mice after treated with ginsenoside Rg1 and ginsenoside Rg3 |
|
|
全球男性不育发生率呈明显上升趋势,其中70%~90%是精子出现问题,表现为精子生成障碍、精子缺乏和精子活力不足。DBP作为一种重要工业原料,广泛应用于各种生产和生活中,如增塑剂、橡胶、胶黏剂和香料等。人体通过空气、水体和土壤等接触DBP,从而干扰生殖系统内分泌激素水平,使血清T睾酮水平降低和FSH水平升高[10],引发睾丸组织病理改变,表现为生精细胞脱落、生精小管损伤、生精细胞和支持细胞分离[11]。
在不育症的治疗中,现有的很多药物都有明显的不良反应,辅助生殖技术的使用也可能会增加婴儿出生缺陷和儿童癌症的风险。因此,寻求安全而有效的自然疗法来提高生育能力成为大多数受不孕影响的人的主要选择。被誉为“中草药之王”的人参是治疗不孕不育的常选药物[12]。人参中的有效成份包括皂苷类、小分子肽、多肽和多糖等,其中人参皂苷是人参中最重要的有效成分。目前对人参皂苷的研究主要集中在其对中枢神经系统、心血管系统和血液系统等的保护作用及抗肿瘤的功效方面。近年来研究[4]显示:人参皂苷能够诱导生精、提高精子活力和数量及促进精子获能。人参皂苷Rg1和人参皂苷Rg3在诱导生精、提高精子活力和数量的效果明显,人参皂苷Rg3作为蛋白质能量合成促进因子,作用于细胞生殖周期的G2期。药理学研究[13]证明:人参对生殖功能的2个主要方面,即性功能和生育能力都有较强影响。下丘脑-垂体-睾丸轴是调节睾丸功能的主要内分泌反馈系统。激素水平过高或过低都不利于精子的形成,如LH和FSH等能够调节T的合成分泌,影响精子的质量。研究[14]表明:人参皂苷及人参皂苷Rb1、人参皂苷Rg1单体能刺激体外培养的垂体前叶细胞分泌FSH和LH。人参皂苷Rg1、人参皂苷Rh1和人参皂苷Ppt等对棉酚所致大鼠睾丸组织的结构损伤有一定的修复作用,使生精组织的形态和结构逐渐恢复,从而对生精障碍的治疗起到一定作用[5]。人参皂苷还能通过抑制大鼠精子的凋亡来提高精子质量。
睾丸质量和脏器系数等指标可反映生殖器官的发育情况及损害情况。本研究结果显示:人参皂苷Rg1和人参皂苷Rg3联合应用可使小鼠睾丸脏器系数明显升高,单独应用人参皂苷Rg1或人参皂苷Rg3睾丸脏器系数变化不明显;精子质量分析,与模型组比较,人参皂苷Rg1+DBP组、人参皂苷Rg3+DBP组和联合组小鼠精子密度、精子活力均升高,而各组小鼠精子总畸形率差异不明显;人参皂苷Rg1和人参皂苷Rg3联合应用对于精子活力存在交互作用,提示人参皂苷Rg1和人参皂苷Rg3联合使用对于改善小鼠精子质量具有协同作用;小鼠睾丸组织HE染色后观察,模型组小鼠睾丸组织损伤严重,表现为生精上皮变薄且细胞层次紊乱,管腔中有生精细胞脱落,人参皂苷Rg1+DBP组、人参皂苷Rg3+DBP组和联合组小鼠睾丸组织的损伤减轻,其中联合组大鼠睾丸组织形态结构最好。本研究结果表明:人参皂苷Rg1和人参皂苷Rg3单独和联合应用均能抑制DBP所致的小鼠睾丸组织损伤,与文献[15]报道一致。
DBP可通过破坏男性内分泌系统而间接损害睾丸,而DBP毒性作用的直接靶点可能是睾丸中的细胞[16-17]。本研究中血清性激素检测结果显示:与模型组比较,人参皂苷Rg1+DBP组、人参皂苷Rg3+DBP组和联合组小鼠血清T和LH水平均升高,FSH水平降低,联合作用的析因分析结果显示人参皂苷Rg1和人参皂苷Rg3具有协同作用,提示人参皂苷Rg1和人参皂苷Rg3联合应用可最大程度地减轻DBP诱导的小鼠内分泌系统损伤,从而保护小鼠睾丸组织。
大量研究[18-19]表明:睾丸内支持细胞-支持细胞间连接或者支持细胞-生殖细胞间细胞连接是内分泌干扰物作用于生殖系统的靶点,其作用于支持细胞的紧密连接,破坏细胞骨架组件;作用于细胞锚定连接蛋白,使细胞内蛋白质分布异常。睾丸和雄性生殖道中,作为相邻细胞间的重要的细胞连接-缝隙连接(gap junction, GJ)广泛存在。GJ是一种膜通道结构,对睾丸发育以及对精子发生具有重要意义[20]。如果睾丸支持细胞和血液睾丸屏障(blood-testis barrier, BTB)的完整性破坏,就可以导致精子生成出现障碍。有研究[21-22]显示:BTB的细胞连续重塑和细胞连接动力必须通过GJ的紧密协调和调控,说明GJ在大鼠睾丸中维持BTB功能的重要性。在睾丸中构建GJ细胞间缝隙通道[23]的十余种连接蛋白中,Cx43具有重要的生理功能,支持细胞特异性缺失Cx43会导致小鼠不育症[16]。Cx43具有重要和独特的生理功能,同时也可能是环境毒物诱导生殖功能障碍的良好靶标[24-25]。本课题组研究结果[26-27]也显示:DBP诱导的支持细胞损伤与Cx43的下调有密切关联,可扰乱肌动蛋白和波性蛋白等相关蛋白表达,破坏间质细胞GJ通透性屏障功能,进而影响生精功能。本研究结果显示:人参皂苷Rg1+DBP组、人参皂苷Rg3+DBP组和联合组小鼠睾丸组织中Cx43蛋白表达水平均高于模型组,联合作用的析因分析结果表明人参皂苷Rg1和人参皂苷Rg3联合应用可增加小鼠睾丸组织中Cx43蛋白表达,两者具有协同作用。
综上所述,人参皂苷Rg1和人参皂苷Rg3可通过上调Cx43表达发挥生精保护作用,改善DBP所致的生殖功能损伤。人参皂苷Rg1和人参皂苷Rg3联合应用可最大限度地减轻DBP所致的小鼠精子质量下降和小鼠睾丸组织损伤,通过调节生殖激素的水平来发挥保护生殖功能的作用,其机制可能与上调Cx43表达有关。本研究结果为人参皂苷的进一步开发和合理利用奠定了理论基础,但人参皂苷Rg1和人参皂苷Rg3生精作用的确切机制尚未明确,需从分子生物学水平继续探讨。
| [1] |
李青花. 环境因素导致男性不育症的机理探讨[J]. 中国计划生育学杂志, 2004, 12(5): 319-320. DOI:10.3969/j.issn.1004-8189.2004.05.046 |
| [2] |
SALVATI G, GENOVESI G, MARCELLINI L, et al. Effects of Panax Ginseng C.A. Meyer saponins on male fertility[J]. Panminerva Med, 1996, 38(4): 249-254. |
| [3] |
PARK W S, SHIN D Y, KIM D R, et al. Korean ginseng induces spermatogenesis in rats through the activation of cAMP-responsive element modulator (CREM)[J]. Fertil Steril, 2007, 88(4): 1000-1002. DOI:10.1016/j.fertnstert.2006.12.014 |
| [4] |
许慧.人参皂苷Rg1及其代谢产物Rh1、Ppt生精保护作用的分子机制研究[D].开封: 河南大学, 2013.
|
| [5] |
LIU T, PENG Y F, JIA C, et al. Ginsenoside Rg3 improves erectile function in streptozotocin-induced diabetic rats[J]. J Sex Med, 2015, 12(3): 611-620. DOI:10.1111/jsm.12779 |
| [6] |
LIANG H Y, ZHANG S W, LI Z L. Ginsenoside Rg3 protects mouse leydig cells against triptolide by downregulation of miR-26a[J]. Drug Des Devel Ther, 2019, 13: 2057-2066. DOI:10.2147/DDDT.S208328 |
| [7] |
CHATONNET P, BOUTOU S, PLANA A. Contamination of wines and spirits by phthalates:types of contaminants present, contamination sources and means of prevention[J]. Food Addit Contam Part A Chem Anal Control Expo Risk Assess, 2014, 31(9): 1605-1615. DOI:10.1080/19440049.2014.941947 |
| [8] |
赵金昌, 靳曙光, 徐一波, 等. ERK-MAPK通路在DBP致大鼠睾丸缝隙连接损伤中作用[J]. 中国公共卫生, 2017, 33(2): 206-210. |
| [9] |
吴冠宇.邻苯二甲酸二丁酯对雄性小鼠生殖系统的影响[D].长春: 吉林大学, 2015.
|
| [10] |
常兵, 梁玉香, 王珥梅. 邻苯二甲酸二丁酯对青春期雄性大鼠的生殖毒性研究[J]. 中国自然医学杂志, 2007, 21(3): 194-197. |
| [11] |
FISHER J S, MACPHERSON S, MARCHETTI N, et al. Human 'testicular dysgenesis syndrome':a possible model using in-utero exposure of the rat to dibutyl phthalate[J]. Hum Reprod, 2003, 18(7): 1383-1394. DOI:10.1093/humrep/deg273 |
| [12] |
ZHOU S H, DENG Y F, WENG Z W, et al. Traditional Chinese medicine as a remedy for male infertility:a review[J]. World J Mens Health, 2019, 37(2): 175-185. |
| [13] |
王晓英, 张均田. 人参皂苷Rb1对小鼠性功能的改善作用及其机制探讨[J]. 药学学报, 2000, 35(7): 492-495. DOI:10.3321/j.issn:0513-4870.2000.07.004 |
| [14] |
YAO Y. Ginsenosides reduce body weight and ameliorate hepatic steatosis in high fat dietinduced obese mice via endoplasmic reticulum stress and pSTAT3/STAT3 signaling[J]. Mol Med Rep, 2020, 21(3): 1059-1070. |
| [15] |
郝杰, 王应雄, 何俊琳, 等. 人参皂甙Rg1对镉诱导的大鼠睾丸损伤的保护作用[J]. 重庆医科大学学报, 2007, 32(3): 236-238. DOI:10.3969/j.issn.0253-3626.2007.03.004 |
| [16] |
LARA N L M, VAN DEN DRIESCHE S, MACPHERSON S, et al. Dibutyl phthalate induced testicular dysgenesis originates after seminiferous cord formation in rats[J]. Sci Rep, 2017, 7(1): 2521. |
| [17] |
LI N, MRUK D D, CHEN H Q, et al. Rescue of perfluorooctanesulfonate (PFOS)-mediated Sertoli cell injury by overexpression of gap junction protein connexin 43[J]. Sci Rep, 2016, 6: 29667. DOI:10.1038/srep29667 |
| [18] |
CHU D S, SHAKES D C. Spermatogenesis[J]. Adv Exp Med Biol, 2013, 757: 171-203. |
| [19] |
CHENG C Y, MRUK D D. A local autocrine axis in the testes that regulates spermatogenesis[J]. Nat Rev Endocrinol, 2010, 6(7): 380-395. DOI:10.1038/nrendo.2010.71 |
| [20] |
POINTIS G, GILLERON J, CARETTE D, et al. Physiological and physiopathological aspects of connexins and communicating gap junctions in spermatogenesis[J]. Philos Trans R Soc Lond B Biol Sci, 2010, 365(1546): 1607-1620. DOI:10.1098/rstb.2009.0114 |
| [21] |
CHENG C Y. Toxicants target cell junctions in the testis:Insights from the indazole-carboxylic acid model[J]. Spermatogenesis, 2014, 4(2): e981485. DOI:10.4161/21565562.2014.981485 |
| [22] |
MOK K W, MRUK D D, LEE W M, et al. Spermatogonial stem cells alone are not sufficient to re-initiate spermatogenesis in the rat testis following adjudin-induced infertility[J]. Int J Androl, 2012, 35(1): 86-101. DOI:10.1111/j.1365-2605.2011.01183.x |
| [23] |
BAI D L. Structural analysis of key gap junction domains:Lessons from genome data and disease-linked mutants[J]. Semin Cell Dev Biol, 2016, 50: 74-82. DOI:10.1016/j.semcdb.2015.11.015 |
| [24] |
GÜNTHER S, FIETZ D, WEIDER K, et al. Effects of a murine germ cell-specific knockout of Connexin 43 on Connexin expression in testis and fertility[J]. Transgenic Res, 2013, 22(3): 631-641. |
| [25] |
MRUK D D, CHENG C Y. The mammalian blood-testis barrier:its biology and regulation[J]. Endocr Rev, 2015, 36(5): 564-591. |
| [26] |
ZHANG J, LI H. PGE2 regulating Cx43 to affect testosterone synthesis in rats leydig cell exposed at DBP[J]. Int J Clin Exp Pathol, 2016, 9(4): 4574-4578. |
| [27] |
张燚, 李环. DBP介导Cx43对大鼠睾丸Leydig细胞睾酮合成的影响[J]. 北华大学学报(自然科学版), 2015, 16(2): 191-194. |
 2020, Vol. 46
2020, Vol. 46


