扩展功能
文章信息
- 房晓雪, 徐伟, 周婷婷, 唐燕, 王春驰, 姜瑞芝, 邱智东, 罗浩铭
- FANG Xiaoxue, XU Wei, ZHOU Tingting, TANG Yan, WANG Chunchi, JIANG Ruizhi, QIU Zhidong, LUO Haoming
- 人参活性糖肽的荧光标记鉴定及其在小鼠主要脏器组织中的分布
- Fluorescence labelingand identification of panax ginseng active glycopeptide and its distribution in main organ tissues of mice
- 吉林大学学报(医学版), 2020, 46(04): 687-692
- Journal of Jilin University (Medicine Edition), 2020, 46(04): 687-692
- 10.13481/j.1671-587x.20200404
-
文章历史
- 收稿日期: 2019-09-03
2. 长春中医药大学药学院药物化学与中药化学教研室, 吉林 长春 130117;
3. 吉林省吉测检测技术有限公司研发部, 吉林 长春 130117
2. Department of Pharmaceutical Chemistry and Traditional Chinese Medicine Chemistry, School of Pharmacy, Changchun University of Chinese Medicine, Changchun 130117, China;
3. Department Research and Development, Jilin Jice Inspection Technology Co., Lid., Changchun 130117, China
天然产物中糖复合物如糖蛋白、核酸和多糖类成分均具有多样的生物活性,在生理病理过程如免疫识别、组织修复和细胞功能等方面均扮演重要角色[1-4]。人参为五加科多年生草本植物,具有补气固脱、健脾补肺和开心益智等作用[5-7]。前期动物实验[8-12]证实:人参活性糖肽(panax ginseng active glycopeptide, PGG)可改善老年痴呆模型小鼠的学习记忆功能,并具有镇痛和镇静催眠的功效。研究[13-16]表明:PGG可明显抑制β淀粉样蛋白25-35(Aβ25-35)诱导的细胞凋亡活性,具有潜在的神经保护作用。本研究分析PGG在动物体内的分布,确定其是否以脑组织为靶点。由于此类化合物结构复杂且缺少发光基团,难以进行体内示踪,阻碍了对PGG作用机制的进一步研究。目前,常采用酶、金属离子、同位素和荧光素等物质对糖复合物进行标记,以便对其组织内分布及代谢过程进行监测[17-19]。异硫氰酸荧光素(fluoresceine isothiocyanate,FITC)是一种在细胞生物学、免疫学和药物研究领域应用较为广泛的荧光素衍生物,其主要与被标记物中的伯胺基团反应形成硫脲键,从而实现荧光标记,因此常被用来标记蛋白质、抗体和核酸分子等[20-22]。PGG结构中除肽链N端的伯胺之外,带有伯胺基团的赖氨酸质量分数为2.15%(与总蛋白比较),为进行FITC标记提供了理论可能。此外,PGG较大的相对分子质量和极性限制了其通过血脑屏障(blood brain barrier, BBB)进入中枢神经系统(center nervous system, CNS)发挥药效的能力。在PAN等[23]证明促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)等肽类物质可完整穿越BBB之前,学术界普遍认为肽类等大分子难以穿越BBB。随着研究技术的不断深入,越来越多的大分子,如神经营养因子3(neurotrophin-3,NT-3)、神经生长因子(nerve growth factor,NGF)、脑源性神经营养因子(brain derived neurotrophic factor,BDNF)、IgG、白蛋白和P-糖蛋白等已被证明可透过BBB到达CNS发挥药效作用[24-25],因此PGG具有通过BBB的潜力。目前关于PGG在小鼠不同组织中的分布情况及其靶向趋势的研究较少。本研究利用FITC对PGG进行标记,并利用荧光分光光度法测定小鼠体内药物的组织分布和靶向效率,探讨PGG通过BBB到达CNS发挥药效的依据,以期为今后研究人参糖肽类成分通过BBB的转运机制奠定基础。
1 材料与方法 1.1 动物、主要试剂和仪器昆明种小鼠78只,雄性,体质量(20±2)g,由吉林大学实验动物中心提供,动物生产许可证号:SCXK(辽)2015-0001。PGG由本课题组自制[5-12]。FITC(山东西亚化学股份有限公司),苯酚、碳酸钠和硫酸(北京化工厂)。透析袋(上海源叶公司),MS105DU型电子分析天平(吉林省计量科学研究院),UV-5100型紫外可见分光光度计、IRAffinity-1S型傅里叶红外光谱仪和F-2700型荧光分光光度计(日本岛津公司),WH-2型涡旋混匀器(上海沪西分析仪器厂有限公司),78-1型磁力加热搅拌器(金坛市江南仪器厂),R-201型旋转蒸发仪(上海申须生物科技有限公司),H/T16MM型台氏高速离心机(湖南赫西仪器装备有限公司)。
1.2 PGG的标记和纯化称取200 mgPGG,溶于10 mL蒸馏水中,采用0.5 mol·L-1碳酸钠调节pH值至8.5,加入25 mg FITC室温下避光反应过夜,将反应物用0.1 kD的透析袋透析24 h。透析内液上Sephadex G-75柱纯化,蒸馏水洗脱,流速1 mL·min -1,每管5 mL,共80管,分别于波长280 nm处检测肽类吸光度(A)值,苯酚-硫酸法反应后于波长490 nm处检测糖类A值,以A值为纵坐标,管数为横坐标,绘制折线图。根据洗脱图形,收集相应洗脱液,减压浓缩,冷冻干燥,得到PGG-FITC,避光保存。
1.3 紫外光谱扫描分别称取PGG、PGG-FITC、FITC 1.5 mg,加入PBS缓冲液,配制成质量浓度为1.5 mg·L-1的溶液,在波长200~800 nm内进行紫外光谱扫描。
1.4 红外光谱扫描分别称取PGG 1.085 mg、PGG-FITC 1.1 mg、FITC 0.015 mg和干燥的溴化钾450 mg(按照PGG的荧光取代度为1.435%计算),在玛瑙研钵中研磨、混匀,取适量的混合品放入压片模具中,在约12 MPa的压力下2 min后,样品被压成半透明的薄片。将上述样品置于红外光谱仪中,在波数4000~400 cm-1内进行红外光谱测定(扫描样品前需先压1个溴化钾空白片扣除水和CO2的干扰)。
1.5 荧光取代度测定[26]精密移取质量浓度为0.1220 mg·L-1的FITC溶液0.2、0.4、0.6、0.8、1.0、1.2和1.4 mL,分别加入7支锡箔纸包裹的刻度试管中,再加入PBS缓冲液定容至10 mL。以PBS缓冲液为空白对照,依次测定各管的荧光强度。以FITC的质量浓度为横坐标(X)、荧光强度为纵坐标(Y),绘制标准曲线,并计算回归方程。将PGG-FITC样品配制成质量浓度为1.0201和2.5503 mg·L-1的PBS缓冲液,测定其荧光强度,代入回归方程,计算PGG-FITC的荧光取代度。
1.6 方法学验证(以心脏组织中PGG-FITC的定量分析方法为例) 1.6.1 对照品溶液的配制精密称取FITC样品6.01 mg,加入PBS缓冲液,配制成2.404 mg·L-1的对照品溶液。
1.6.2 标准曲线的绘制精密移取空白组小鼠心脏匀浆液200 μL,分别加入“1.6.1”中对照品溶液0、1、5、20、60、80和100 μL,再加入PBS缓冲液2.5 mL,以0 μL为空白对照,测定荧光强度。分别以匀浆液中FITC质量浓度为横坐标(X)、荧光强度为纵坐标(Y)绘制标准曲线,并计算回归方程。
1.6.3 精密度实验精密移取空白组小鼠心脏匀浆液200 μL,再精密移取“1.6.1”中对照品溶液,配制成低、中和高质量浓度(0.000 89、0.052 17和0.126 32 mg·L-1)FITC溶液。1 d内连续测定6次荧光强度,计算精密度和相对标准方差(relative standard deviation, RSD),RSD值越小,准确度越高。
1.6.4 回收率实验取“1.6.3”中制备的低、中和高质量浓度FITC溶液,测定荧光强度,计算回收率和RSD值。
1.6.5 稳定性实验取“1.6.3”中制备的低、中和高质量浓度FITC溶液,-4 ℃放置24 h,分别于2、4、6、8、12和24 h测定荧光强度,综合评价该方法稳定性。
1.7 PGG在小鼠不同组织中的分布78只小鼠随机分为13组,每组6只,其中6组小鼠按照355 mg·kg-1剂量尾静脉注射PGG-FITC(PGG-FITC组),6组小鼠按照5.09 mg·kg-1剂量尾静脉注射FITC(FITC组),1组小鼠尾静脉注射PBS缓冲液作为空白对照组。给药后分别于0.5、1.0、2.0、4.0、8.0和24.0 h颈椎脱臼处死小鼠并解剖,采集各组小鼠心、肝、脾、肺、肾、脑、肠和胃组织。采用PBS缓冲液洗净,滤纸吸干,精密称质量,加入9倍体积PBS缓冲液,研磨,收集组织匀浆液,3 000 r·min-1离心15 min,取上清液200 μL,加入PBS缓冲液2.5 mL,混匀,采用荧光分光光度计在发射波长494 nm、激发波长515 nm条件下测定荧光强度。利用“1.6”中的回归方程计算小鼠主要脏器组织中PGG-FITC和FITC水平。根据小鼠主要脏器组织中PGG-FITC和FITC水平绘制药物浓度-时间曲线,采用梯形法计算药时曲线下面积(AUC)值,并以AUC总和为参比,计算小鼠主要脏器组织中的靶向效率(Te)值,Te=AUC/∑AUC×100%。
1.8 统计学分析采用SPSS 11.0统计软件进行统计学分析。对FITC的质量浓度与荧光强度进行相关性分析和线性回归分析。各组小鼠主要脏器组织中AUC值以x±s表示,组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 PGG-FITC的纯化和收率为除去游离FITC,将反应产物通过24 h透析,透析内液经Sephadex G-75进一步纯化,利用苯酚-硫酸法(490 nm)和紫外测定法(280 nm)分别间管检测A值,以管数为横坐标(X)、A值为纵坐标(Y)绘制折线图,多糖和蛋白洗脱峰重合,按照洗脱图收集30~60管洗脱液,浓缩,冻干,得到PGG-FITC 60 mg,收率为27%。见图 1。
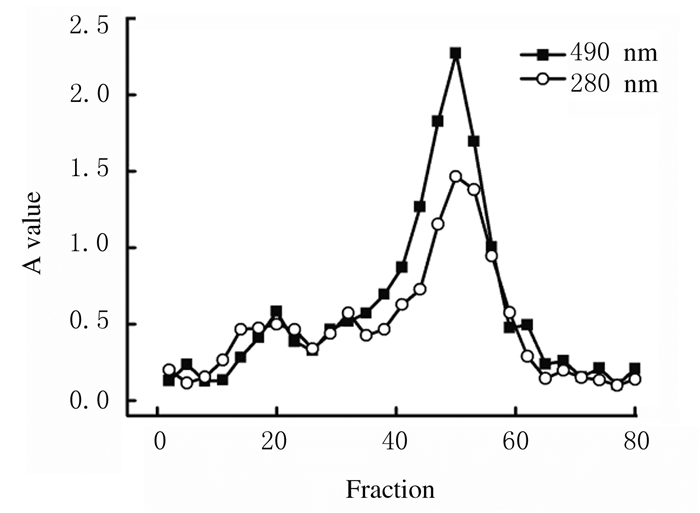
|
| 图 1 Sephadex G-75洗脱曲线图 Fig. 1 Sephadex G-75 elution profile |
|
|
PGG在200~800 nm区间无明显吸收峰,FITC在280和490 nm处有明显吸收峰,PGG-FITC在280和490 nm处有吸收峰出现,说明实现了FITC对PGG的荧光标记。见图 2(插页一)。
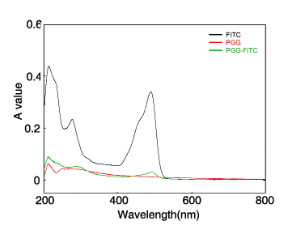
|
| 图 2 PGG、FITC和PGG-FITC的紫外光谱图 Fig. 2 Ultraviolet spectra of PGG, FITC and PGG-FITC |
|
|
PGG在3 600、2 900和1 600 cm-1附近出现明显糖类物质专属吸收峰,FITC在2 050、1 541、1 508、1 454、1 117和849 cm-1处出现明显专属吸收峰。PGG-FITC在1 600~1 400 cm-1区间的吸收峰明显增强,1117和849 cm-1处出现明显特征峰,进一步验证了FITC对PGG的荧光标记。见图 3(插页一)。
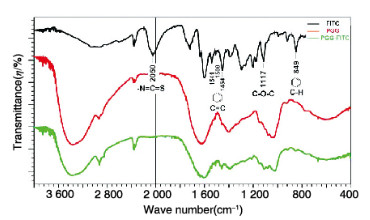
|
| 图 3 PGG、FITC和PGG-FITC的红外光谱图 Fig. 3 Infrared spectra of PGG, FITC and PGG-FITC |
|
|
以FITC作为标准品,相关性分析结果显示:FITC质量浓度与荧光强度存在相关性(P<0.05),其标准曲线回归方程为:Y=22460X+29.479 (r=0.9997),线性范围2.44×10-3~1.71×10-2 mg·L-1,检测质量浓度为1.020 1和2.550 3 mg·L-1PGG-FITC溶液的荧光强度分别为329.6和922.9,计算PGG-FITC的荧光取代度为1.435%。
2.5 方法学验证 2.5.1 线性关系以FITC作为对照品,相关性分析结果显示:FITC质量浓度与荧光强度存在相关性(P<0.05),分别以组织匀浆液中FITC的质量浓度为横坐标(X)、测定的荧光强度为纵坐标(Y)绘制标准曲线,线性回归方程和相关系数(r)结果见表 1,均满足生物样品测定要求。
| Sample | Standard curve | Linear range(mg·L-1) | r |
| Heart | Y=20 489X+24.860 | 8.50×10-6-1.52×10-3 | 0.999 0 |
| Liver | Y=8 306.3X+12.089 | 4.06×10-3-1.86×10-1 | 0.999 1 |
| Spleen | Y=26 026X+29.761 | 8.15×10-6-7.86×10-4 | 0.997 7 |
| Lung | Y=16 497X+21.467 | 8.15×10-6-3.43×10-3 | 0.999 1 |
| Kidney | Y=13 480X+120.020 | 8.15×10-4-1.52×10-1 | 0.999 3 |
| Brain | Y=13 554X-41.279 | 8.15×10-4-1.52×10-1 | 0.996 4 |
| Intestine | Y=9 376.4X+44.630 | 4.06×10-3-1.52×10-1 | 0.998 1 |
| Stomach | Y=17 310X+40.777 | 8.15×10-4-1.52×10-1 | 0.999 8 |
按“1.6.3”中的方法测定低、中和高质量浓度各样品的荧光强度,精密度RSD值均小于8%,均满足生物样品测定要求。
2.5.3 回收率按“1.6.4”中的方法测定低、中和高质量浓度各样品的荧光强度,回收率为90.12%~110.89%,RSD值均小于11%,均满足生物样品测定要求。
2.5.4 稳定性按“1.6.5”中的方法测定低、中、高质量浓度各样品的荧光强度,其稳定性良好,RSD值均小于10%,均满足生物样品测定要求。
2.6 FITC和PGG-FITC在小鼠主要脏器组织中的分布FITC组小鼠主要脏器组织中药物水平从高到低依次为肝、脑、胃、肾、肠、心、脾和肺组织,PGG-FITC组小鼠主要脏器组织中药物水平从高到低依次为脑、心、肝、肾、脾、胃、肺和肠组织。与FITC组比较,PGG-FITC组小鼠主要脏器组织中药物水平均明显升高(P<0.01),且脑组织中的药物水平升高更为明显。比较小鼠主要脏器组织中PGG-FITC和FITC的Te值,脑组织中PGG-FITC的Te值最高(53%),说明PGG具有脑靶向趋势。见表 2。
| (n=6) | |||||||||||||||||||||||||||||
| Tissue | Group | AUC [mg·L-1·h] | Te [η/%] | ||||||||||||||||||||||||||
| Heart | FITC | 0.25±0.04 | 2 | ||||||||||||||||||||||||||
| PGG-FITC | 86.29±2.07* | 23 | |||||||||||||||||||||||||||
| Liver | FITC | 6.33±0.14 | 60 | ||||||||||||||||||||||||||
| PGG-FITC | 26.26±0.69* | 7 | |||||||||||||||||||||||||||
| Spleen | FITC | 0.28±0.04 | 3 | ||||||||||||||||||||||||||
| PGG-FITC | 12.19±1.19* | 3 | |||||||||||||||||||||||||||
| Lung | FITC | 0.27±0.06 | 3 | ||||||||||||||||||||||||||
| PGG-FITC | 10.35±0.91* | 3 | |||||||||||||||||||||||||||
| Kidney | FITC | 0.39±0.05 | 4 | ||||||||||||||||||||||||||
| PGG-FITC | 18.45±0.90* | 5 | |||||||||||||||||||||||||||
| Brain | FITC | 2.22±0.10 | 21 | ||||||||||||||||||||||||||
| PGG-FITC | 195.31±1.80* | 53 | |||||||||||||||||||||||||||
| Intestine | FITC | 0.26±0.05 | 2 | ||||||||||||||||||||||||||
| PGG-FITC | 8.86±0.08* | 2 | |||||||||||||||||||||||||||
| Stomach | FITC | 0.50±0.05 | 5 | ||||||||||||||||||||||||||
| PGG-FITC | 11.44±0.10* | 3 | |||||||||||||||||||||||||||
| *P<0.01 compared with FITC group. | |||||||||||||||||||||||||||||
本研究通过PGG与FITC发生亲核反应生成PGG-FITC,利用紫外分光光度法和红外分光光度法对标记产物进行结构分析。在紫外光谱图中,PGG在200~800 nm区间无吸收峰,而标记后产物PGG-FITC在280和490 nm处出现明显吸收峰,且2个吸收峰与FITC吸收峰基本重合,说明实现了FITC对PGG的荧光标记。在红外光谱图中,PGG在3 600、2 900和1 600 cm-1附近出现糖类物质吸收峰,表明PGG为糖类化合物。FITC在特征区的吸收峰以及归属:2 050 cm-1为S=C=N-吸收峰,1 541、1 508和1 454 cm-1为苯环中C=C骨架吸收峰,1 117 cm-1为C-O-C吸收峰,849 cm-1为苯环中C-H吸收峰;而标记后产物PGG-FITC的红外光谱图2 050 cm-1处未出现吸收峰,这是由于PGG中伯胺与FITC结构中S=C=N-基团反应生成-NH-(S=C)-NH-基团所引起,同时在1 600~1 400 cm-1区间及1 117和849 cm-1处吸收峰都明显增强,这些特征峰均来自FITC结构中C=C、C-O-C和C-H基团,进一步证明实现了FITC对PGG的荧光标记。同时,红外分光光度法检测结果也说明反应产物通过透析、Sephadex G-75两步纯化可完全排除PGG-FITC中的游离FITC。以上2种鉴别方法均证明:PGG与FITC通过共价键相连,实现了FITC对PGG的荧光标记,其荧光取代度为1.435%。该方法操作简单,价格低廉。此外本研究使用荧光分光光度法建立了小鼠不同组织中PGG-FITC和FITC的定量分析方法,经方法学验证,该研究方法准确可靠。
近年来研究[27-28]显示:不仅脂溶性较高、相对分子质量较小的药物易透过BBB到达CNS发挥作用,相对分子质量较大的化合物也可以通过不同的转移机制透过BBB发挥药效,如多肽或蛋白等大分子物质可以通过吸附介导转运、受体介导转运或载体介导转运等途径实现跨BBB转运,从而可以使大分子药物透过BBB到达CNS。随着研究的不断深入,越来越多的实验数据证明:氢键键能对多肽或蛋白等大分子物质透过BBB也具有一定的影响,此外大分子药物还可以通过胞吞、胞吐作用透过BBB到达CNS发挥作用。本实验通过小鼠尾静脉分别注射PGG-FITC和FITC,采用荧光分光光度法测定小鼠不同组织中药物水平,并计算药时AUC和Te值,结果显示:PGG具有明显的脑靶向趋势,说明脑组织对PGG有较强的摄取能力,证明PGG可以通过某些转移机制透过BBB到达CNS发挥药效。本研究结果可进一步证明本课题组前期药效学实验结果的正确性和可靠性,同时也为今后研究人参糖肽类成分通过BBB的转运机制奠定了基础。
| [1] |
YU Y, SHEN M Y, SONG Q Q, et al. Biological activities and pharmaceutical applications of polysaccharide from natural resources:a review[J]. Carbohyd Polym, 2018, 183: 91-101. DOI:10.1016/j.carbpol.2017.12.009 |
| [2] |
MAJEED F, MALIK F Z, AHMED Z, et al. Ginseng phytochemicals as therapeutics in oncology:Recent perspectives[J]. Biomed Pharmacother, 2018, 100: 52-63. DOI:10.1016/j.biopha.2018.01.155 |
| [3] |
CRISTINA A, LAURA M, ARZOZ S, et al. Free radical scavenging activity of extracts from seaweeds Macrocystis pyrifera and Undaria pinnatifida:applications as functional food in the diet of prawn Artemesia longinaris[J]. Lat Am J Aquat Res, 2017, 45(1): 104-112. DOI:10.3856/vol45-issue1-fulltext-10 |
| [4] |
HE X R, WANG X X, FANG J C, et al. Structures, biological activities, and industrial applications of the polysaccharides from Hericium erinaceus (Lion's Mane) mushroom:a review[J]. Int J Biol Macromol, 2017, 97: 228-237. DOI:10.1016/j.ijbiomac.2017.01.040 |
| [5] |
MANCUSO C, SANTANGELO R. Panax ginseng and Panax quinquefolius:From pharmacology to toxicology[J]. Food Chem Toxicol, 2017, 107(Pt A): 362-372. |
| [6] |
KIM J H, YI Y S, KIM M Y, et al. Role of ginsenosides, the main active components of Panax ginseng, in inflammatory responses and diseases[J]. J Ginseng Res, 2017, 41(4): 435-443. DOI:10.1016/j.jgr.2016.08.004 |
| [7] |
ROKOT N T, KAIRUPAN T S, CHENG K C, et al. A role of ginseng and its constituents in the treatment of central nervous system disorders[J]. Evid Based Complement Alternat Med, 2016, 2016: 2614742. |
| [8] |
罗浩铭, 陈英红, 周婷婷, 等. 人参糖蛋白对小鼠学习和记忆能力的影响[J]. 吉林大学学报(医学版), 2016, 42(3): 439-445. |
| [9] |
王颖, 陈英红, 徐宏, 等. 人参糖蛋白的结构及其镇静安眠作用研究[J]. 特产研究, 2017, 39(2): 1-4, 8. |
| [10] |
WANG Y, ZHU D F, CHEN Y H, et al. Metabonomics study of ginseng glycoproteins on improving sleep quality in mice[J]. Biomed Res Int, 2019, 2019: 2561828. |
| [11] |
WANG Y, CHEN Y H, XU H, et al. Analgesic effects of glycoproteins from Panax ginseng root in mice[J]. J Ethnopharmacol, 2013, 148(3): 946-950. DOI:10.1016/j.jep.2013.05.049 |
| [12] |
LUO H M, JIANG R Z, YANG X H, et al. Purification and characterization of a novel tetradecapeptide from ginseng polypeptides with enhancing memory activity for mice[J]. Chem Res Chin Univ, 2013, 29(4): 638-641. DOI:10.1007/s40242-013-3012-z |
| [13] |
罗浩铭, 王颖, 陈英红, 等. 人参糖蛋白对Aβ25~35诱导SH-SY5Y细胞凋亡的影响[J]. 中国老年学杂志, 2016, 36(24): 6077-6080. DOI:10.3969/j.issn.1005-9202.2016.24.014 |
| [14] |
胡婧婷, 邱智东, 朱迪夫, 等. 人参糖肽的结构及其对Aβ25-35处理PC12细胞的抗凋亡作用[J]. 吉林大学学报(医学版), 2019, 45(2): 286-293. |
| [15] |
LUO H M, HU J, WANG Y, et al. In vivo and in vitro neuroprotective effects of Panax ginseng glycoproteins[J]. Int J Biol Macromol, 2018, 113: 607-615. DOI:10.1016/j.ijbiomac.2018.02.015 |
| [16] |
LUO H M, ZHU D F, WANG Y, et al. Study on the structure of ginseng glycopeptides with anti-inflammatory and analgesic activity[J]. Molecules, 2018, 23(6): E1325. DOI:10.3390/molecules23061325 |
| [17] |
MARTEL J D, YAMAGATA M, DEERINCK T J, et al. A split horseradish peroxidase for the detection of intercellular protein-protein interactions and sensitive visualization of synapses[J]. Nat Biotechnol, 2016, 34(7): 774-780. DOI:10.1038/nbt.3563 |
| [18] |
WOO C M, BERTOZZI C R. Isotope targeted glycoproteomics (IsoTaG) to characterize intact, metabolically labeled glycopeptides from complex proteomes[J]. Curr Protoc Chem Biol, 2016, 8(1): 59-82. |
| [19] |
ZHENG Y M, JI S D, CZERWINSKI A, et al. FITC-conjugated cyclic RGD peptides as fluorescent probes for staining integrin αvβ3/αvβ5 in tumor tissues[J]. Bioconjug Chem, 2014, 25(11): 1925-1941. DOI:10.1021/bc500452y |
| [20] |
张雅娟, 俞洁, 张冬未, 等. 异硫氰酸荧光素标记尿激酶的制备与性能研究[J]. 宁波大学学报(理工版), 2016, 29(3): 78-82. |
| [21] |
TANG A M, MEI B, WANG W J, et al. FITC-quencher based caspase 3-activatable nanoprobes for effectively sensing caspase 3 in vitro and in cells[J]. Nanoscale, 2013, 5(19): 8963-8967. DOI:10.1039/c3nr03339b |
| [22] |
NIE K, YU X, KUMAR N, et al. Versatile layer-by-layer highly stable multilayer films:study of the loading and release of FITC-labeled short peptide in the drug delivery field[J]. Materials (Basel), 2019, 12(8): E1206. DOI:10.3390/ma12081206 |
| [23] |
PAN W H, KASTIN A J, ZANKEL T C, et al. Efficient transfer of receptor-associated protein (RAP) across the blood-brain barrier[J]. J Cell Sci, 2004, 117(Pt 21): 5071-5078. |
| [24] |
解一舟, 李玉珍, 朱慧, 等. 蛋白和肽类物质跨血脑屏障转运研究进展[J]. 中国比较医学杂志, 2019, 29(2): 128-134. DOI:10.3969/j.issn.1671-7856.2019.02.022 |
| [25] |
王焱超, 梁锐超, 方芳. 中枢神经系统药物穿透血脑屏障的研究进展[J]. 华西医学, 2015, 30(7): 1351-1356. |
| [26] |
师志强, 张雪梅, 薛志远, 等. 红芪多糖3的荧光标记及其组织分布研究[J]. 西北药学杂志, 2018, 33(5): 611-615. DOI:10.3969/j.issn.1004-2407.2018.05.011 |
| [27] |
THOM G, HATCHER J, HEARN A, et al. Isolation of blood-brain barrier-crossing antibodies from a phage display library by competitive elution and their ability to penetrate the central nervous system[J]. MAbs, 2018, 10(2): 304-314. DOI:10.1080/19420862.2017.1409320 |
| [28] |
MAGER I, MEYER A H, LI J H, et al. Targeting blood-brain-barrier transcytosis-perspectives for drug delivery[J]. Neuropharmacology, 2017, 120: 4-7. DOI:10.1016/j.neuropharm.2016.08.025 |
 2020, Vol. 46
2020, Vol. 46


