扩展功能
文章信息
- 刘岚清, 李瑞林, 周晓敏, 孟峻
- LIU Lanqing, LI Ruilin, ZHOU Xiaomin, MENG Jun
- CDC14B在小鼠1-细胞期受精卵各细胞周期的动态表达及其定位
- Dynamic expression and localization of CDC14B in each cell cycle of mouse one-cell fertilized eggs
- 吉林大学学报(医学版), 2020, 46(04): 675-679
- Journal of Jilin University (Medicine Edition), 2020, 46(04): 675-679
- 10.13481/j.1671-587x.20200402
-
文章历史
- 收稿日期: 2019-08-22
2. 内蒙古医科大学附属医院检验科, 内蒙古 呼和浩特 010050
2. Department of Laboratory, Affiliated Hospital, Inner Mongolia Medical University, Hohhot 010050, China
细胞分裂周期蛋白14B(cell division cycle 14B, CDC14B)广泛参与细胞减数分裂、有丝分裂、胞质分裂、中心体复制、维持纺锤体稳定性、G2期损伤检查点激活、DNA损伤修复、细胞癌变和纤毛形成等生理病理过程[1-2]。CDC14B是一种高度保守的双特异性磷酸酶,通过使靶蛋白的丝氨酸和苏氨酸去磷酸化,进而调节靶蛋白的生物学活性[3]。POWERS等[4]研究表明:在鼠卵母细胞发生减数分裂时,过表达的CDC14B可减慢卵母细胞减数分裂的恢复,甚至导致卵母细胞停止发育,而缺乏CDC14B的表达会促进减数分裂的恢复。研究[5-6]表明:CDC14B在MⅠ-MⅡ期定位在纺锤体,可通过调节E-钙黏蛋1(cadherin, CDH1)和降解细胞周期素B1(cyclin B1, CCNB1)的表达,减少CCNB1与细胞周期依赖性激酶CDK1的结合,对抗CDC2活性,从而阻滞鼠卵母细胞减数分裂的恢复,表明CDC14B可能是减数分裂的负性调控因子。对人骨肉瘤细胞系U2OS的研究[7]表明:CDC14B在间期定位于细胞核中,在后期聚集到纺锤体中央区,沉默CDC14B会引起染色体分离错误,多极纺锤轴的形成,表明CDC14B具有捆绑和稳定微管的功能。在对U2OS的研究[8]中发现:CDC14B通过激活细胞周期检测点激酶1(checkpoint kinase 1, Chk1),激活DNA修复通路,修复损伤的DNA。另有学者[9-13]发现:下调人结肠癌细胞系HCT116中CDC14B的表达可导致细胞DNA修复能力缺陷,人类喉癌组织中CDC14B表达增强, 宫颈癌中CDC14B基因的5-羟甲基胞嘧啶高于5-甲基胞嘧啶, 特殊类型的甲状腺髓样癌中CDC14B明显失活。此外,还有研究者[14-15]发现:CDC14B突变的鼠胚胎成纤维细胞(mouse embryonic fibroblasts, MEFs)会提前表现出衰老状态,DNA损伤情况较为严重,也表明CDC14B具有DNA损伤修复作用。以上研究充分说明CDC14B在细胞分裂过程中具有重要的生物学作用,有重要的研究价值。但关于小鼠1-细胞期受精卵中是否存在CDC14B及其在有丝裂分裂中的调控作用尚不清楚,其是否也定位于纺锤体进而调控纺锤体的功能,目前国内外尚未见报道。本研究以小鼠1-细胞期受精卵为研究对象,主要研究CDC14B在小鼠不同细胞周期1-细胞期受精卵中的表达和定位,为研究CDC14B在小鼠受精卵G2/M期转换中的作用机制研究提供理论依据。
1 材料与方法 1.1 动物、主要试剂和仪器昆明系SPF级小鼠由内蒙古大学实验动物中心提供,动物生产许可证号:SCXK(蒙)2016-0001。雌鼠4~6周,体质量18~20g;雄鼠8周龄以上,体质量25~30g。fast200 RNA提取试剂盒(上海飞捷生物技术有限公司),CDC14B抗体、β-Actin抗体和β微管蛋白(β-tubulin)抗体(美国SantaCruz公司),MB培养基(美国Invitrogen公司),M16培养液、矿物油和透明质酸酶(美国Sigma公司),孕马血清促性腺激素和人绒毛膜促性腺激素(hCG)(赤峰博恩药业有限公司), Hoechst33258和细胞裂解液(碧云天生物技术公司),Alexa Fluor 594标记的驴抗兔IgG(H+L)和Alexa Fluor 488标记的驴抗山羊IgG(H+L)(美国Jackson Immuno Research公司),ECL化学发光试剂盒(美国Piece Biotechnology公司),预染蛋白Marker(立陶宛MBI公司提供),RNA PCR(AMV)ver3.0试剂盒(日本TaKaRa公司),TransStart Tip Green qPCR SuperMix试剂盒(北京全式金公司)。35mm和60mm培养皿(丹麦Nunc公司),高速微量冷冻离心机(5427R)和生物安全柜(1300系列Ⅱ级A2型)[赛默飞世尔科技(中国)有限公司],万分之一电子天平(110S) (德国Sartorius公司),CO2培养箱(CB115) (德国WTB-binder公司),纯水机(JCHRO-40Z)(北京捷创伟业环保设备公司),恒温培养箱(江苏省宏华仪器厂),涡旋混合器(海门市其林贝尔仪器制造公司),台式高速离心机(LG16-WA)(北京京立离心机有限公司),实时荧光定量PCR仪和电泳槽0.75ram垂直板(美国Bio-Tad公司),激光共聚焦扫描显微镜(德国Leica公司),相差显微镜(日本奥林巴斯公司),
1.2 小鼠受精卵的采集和培养4~6周的成熟雌性小鼠10只,在明暗交替、温度适宜的环境中喂养4~6d。将腹腔注射当日作为第1天,于中午12:00每只雌性小鼠腹腔内注射孕马血清10IU,于第3天中午12:00每只雌性小鼠腹腔内注射hCG10IU。在注射hCG后,将雄性小鼠和雌性小鼠合笼过夜。至次日早晨分别检查与雄鼠合笼过夜的每只雌性小鼠的阴栓,雌性小鼠有阴栓则表明已经成功交配。将雌性小鼠脱颈处死解剖,取出两侧卵巢,放入备有生理盐水滴的培养皿上,在体视显微镜下撕开输卵管壶腹部膨大处,流出受精卵细胞团,吸入溶有透明质酸酶(0.3 g·L-1)的M2培养液中,清洗受精卵细胞团,去除颗粒细胞,再用M16培养液清洗2~3次,直到无颗粒细胞为止。清洗完成后,将G1期受精卵移入M16培养液中,覆盖一层矿物油,于CO2培养箱中培养,培养条件为37℃、5%CO2和饱和湿度。
不同细胞周期1-细胞期受精卵的收集主要根据受精卵细胞的形态和hCG注射后的时间,分别收集G1、S、G2和M期4个阶段的受精卵。G1期受精卵:在注射hCG后19~20 h收集G1期受精卵,此时卵细胞中雄雌原核的距离较远,雄原核较雌原核稍微大一些;S期受精卵:在注射hCG后23~24 h收集S期受精卵,此时雄雌原核的体积渐渐增大并靠近,核仁已经出现;G2期受精卵:在注射hCG后27~28h收集G2期受精卵,此时雌雄原核的轮廓慢慢消失,胞浆呈粗大颗粒状,细胞膜边缘开始出现凹陷;M期受精卵:在注射hCG后30h收集M期受精卵,此时出现胞质分裂,受精卵胞体拉长,染色体分散到两极。
1.3 RT-PCR法检测1-细胞期受精卵中CDC14B mRNA表达水平将收集到的每组100个1-细胞期受精卵按fast200试剂盒操作步骤提取RNA, 用微量紫外分光光度计在波长280nm和260nm处测定2μL所提mRNA的吸光度(A)值,计算A(260)/A(280)的比值,若比值为1.8~2.0,说明纯度较高,所提取的mRNA可以进行反转录实验。采用RNA PCR(AMV)ver3.0试剂盒按操作步骤进行反转录,反应体系为10μL。反转录条件:42℃、30 min,99℃、5 min,4℃、5 min,1个循环。采用TransStart Tip Green qPCR SuperMix试剂盒进行RT-PCR, PCR引物由日本TaKaRa公司设计,引物序列:CDC14B(NM_001122989.1),5′-ATGACCTGTCCTTAAATGGGCTTG-3′和5′-TTCAGGGCCCGAAGTCTGTC-3′;β-actin(NM_007393),5′-CATCCGTAAAGACCTCTATGCCAAC-3′和5′-ATGGAGCCACCGATCCACA-3′。PCR反应体系为20μL,反应条件: 94℃预变性30s,94℃、5s,60℃、15s,45个循环;95℃、15s,56℃、30s,95℃、15s,1个循环。采用2-ΔΔct法计算CDC14B mRNA表达水平。
1.4 Western blotting法检测1-细胞期受精卵中CDC14B蛋白表达水平分别收集G1、S、G2和M期4个时期的小鼠1-细胞期受精卵各200个,从培养皿转移到1.5mL Eppendof管中,4℃、3 000 r·min-1离心10min,尽量去除培养液,加入适量缓冲液(20 mmol·L-1Tris-Hcl,pH 7.5,2 mmol·L-1EDTA,0.25 mmol·L-1Glucose,10 mmol·L-1 EGTA),充分振荡混匀,然后经3~4次冻融循环,使所有受精卵完全裂解,-20℃保存备用。加入适量SDS缓冲液,100℃煮沸5min使蛋白变性,加入电泳液后开始准备上样,SDS-PAGE电泳分离。将蛋白转至硝酸纤维素膜上,将膜用TBS浸湿后,移至含有封闭液的平皿中,室温下脱色摇床上封闭1 h。与CDC14B抗体(稀释比为1:100)和β-actin抗体(稀释比为1:500)4℃孵育过夜,在室温下脱色摇床上洗涤3次。将HRP偶联的兔抗羊IgG或羊抗兔IgG用TBST溶液室温下孵育2h,在室温下脱色摇床上洗涤3次,ECL化学发光法显影成像,以CDC14B条带的灰度值与β-actin条带的灰度值比值代表蛋白表达水平。
1.5 细胞免疫荧光法检测CDC14B和β-tubulin在小鼠1-细胞期受精卵中各期的亚细胞共定位将培养得到的G1、S、G2和M期受精卵分别用PBS(含1%BSA)洗涤3次,然后用4%多聚甲醛室温固定1 h,PBST溶液(PBS加入0.01%Tween20)洗涤3次,0.1%Triton X-100(溶解于PBS)打孔30min。用含5%BSA的PBS封闭液封闭1h,将上述处理好的受精卵转入一抗即CDC14B和β-tubulin抗体,与封闭液按1:500稀释,室温2h,洗液洗涤3次后将受精卵转入二抗(Alexa Fluor 594标记的驴抗兔IgG和Alexa Fluor 488标记的驴抗山羊IgG, 按1:50稀释)中,孵育条件为室温、避光1 h,洗涤3次,再用Hoechst33258染色10 min,使核酸染色,在激光共聚焦扫描显微镜下观察CDC14B和β-tubulin在受精卵中的定位及核酸染色情况。
1.6 统计学分析采用GraphPad Prism 6统计软件进行统计学分析。小鼠不同细胞周期1-细胞期受精卵中CDC14B mRNA和蛋白表达水平符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果 2.1 小鼠不同细胞周期1-细胞期受精卵中CDC14B mRNA表达水平RT-PCR结果显示:小鼠不同细胞周期1-细胞期受精卵中均有CDC14B mRNA表达,G1、S、G2和M期1-细胞期受精卵中CDC14B mRNA表达水平分别为1.00±0.06、1.17±0.03、2.59±0.05和1.75±0.01,与G1期比较,S、G2和M期1-细胞期受精卵中CDC14B mRNA表达水平均明显升高(P<0.05或P<0.01)。见图 1。
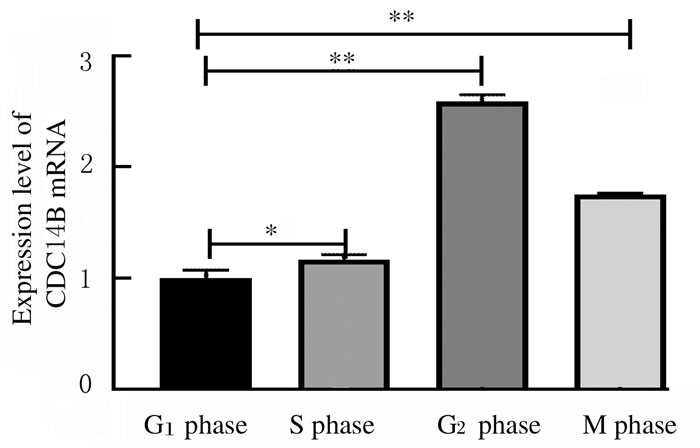
|
| *P < 0.05, **P < 0.01 compared with G1 phase. 图 1 小鼠不同细胞周期1-细胞期受精卵中CDC14B mRNA表达水平 Fig. 1 Expression levels of CDC14B mRNA in one-cell fertilized eggs of mice in different cell cycles |
|
|
Western blotting法检测结果显示:小鼠不同细胞周期1-细胞期受精卵中均有CDC14B蛋白表达,其表达规律与其mRNA表达规律相符。CDC14B蛋白从G1期开始表达(0.50±0.02),S期其表达水平(0.57±0.03)升高,高表达持续到G2期(0.90±0.02),M期CDC14B蛋白表达水平(0.71±0.05)降低。与G1期比较,S、G2和M期的1-细胞期受精卵中CDC14B蛋白表达水平均明显升高(P<0.05或P<0.01)。见图 2。
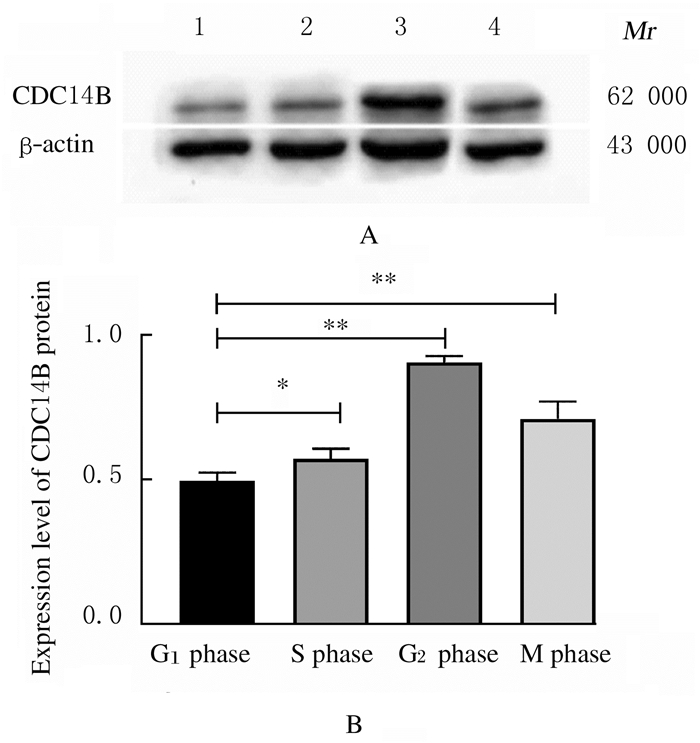
|
| Lane1:G1 phase; Lane2:S phase; Lane3:G2 phase; Lane4:M phase.*P < 0.05, **P < 0.01 compared with G1 phase. 图 2 小鼠不同细胞周期1-细胞期受精卵中CDC14B蛋白表达电泳图(A)和直条图(B) Fig. 2 Electrophoregram(A) and histogram(B) of expressions of CDC14B protein in one-cell fertilized eggs of mice in different cell cycles |
|
|
细胞免疫荧光实验结果显示:在小鼠1-细胞期受精卵中,CDC14B(红色荧光)和β-tubulin(绿色荧光)在G1期和S期共定位于小鼠受精卵皮质;在G2早期,CDC14B和β-tubulin共定位于细胞质;在G2晚期,部分CDC14B入核;在M期,CDC14B和β-tubulin共定位于纺锤体。见图 3 (插页一)。

|
| A —E: G1 phase; F — J: S phase; K — O: Early G2 phase; P —T; Late G2 phase; U — Y: M phase; A, F, K, P, U:Bright field; B, G, L, Q, V: DNA; C, H, M, R, W:β-tubulin; D, I, N, S, X:CDC14B;E, J, O, T, Y:Merge.Blue signal: DNA; Green signal: β-tubulin; Red signal: CDC14B. 图 3 小鼠不同细胞周期1-细胞期受精卵中CDC14B和β-tubulin的免疫荧光定位(×400) Fig. 3 Immunofluorescence location of CDC14B and β-tubulin in mouse one-cell fertilized eggs in different cell cycles(× 400) |
|
|
1970年,HARTWELL通过对出芽酵母的研究首次发现CDC14,并将其定义为有丝分裂退出因子[16]。CDC14B作为一种丝/苏氨酸蛋白磷酸酶,可使细胞周期依赖性激酶的多种底物去磷酸化,进而参与调节多种生理病理过程[17-20],而CDC14B在小鼠受精卵早期发育过程中的表达及定位目前尚未见报道。本研究结果表明:小鼠G1、S、G2和M 4个时期1-细胞期受精卵中CDC14B mRNA均有表达,在G2期其表达水平最高,至M期下降,且其蛋白表达规律与mRNA表达规律相符,G2/M期的过渡是细胞发育、生长和增殖的重要时期,与G1期比较,G2和M期1-细胞期受精卵中CDC14B的表达水平均明显升高,表明CDC14B可能调控小鼠1-细胞期受精卵G2/M期的转换。
蛋白定位与其功能密切联系,本实验通过细胞免疫荧光证实:在小鼠1-细胞期受精卵中,G1和S期CDC14B与β-tubulin共定位于受精卵皮质,G2期CDC14B与β-tubulin共定位于细胞质和细胞核,M期CDC14B与纺锤体共定位。在小鼠卵母细胞中,CDC14B与纺锤体共定位,可通过调节纺锤体的功能进而调节减数分裂。在本研究中,小鼠受精卵细胞与微管蛋白β-tubulin也共定位,表明CDC14B可能参与调控纺锤体的功能。CDC14B是一种重要的蛋白磷酸酶,具有广泛的研究前景,本课题组接下来的研究就是通过构建CDC14B的表达质粒,过表达或沉默CDC14B,观察过表达和敲减的CDC14B对小鼠受精卵生长发育的影响,探讨CDC14B在受精卵G2/M期转换中是否具有调控作用,再进一步研究CDC14B蛋白直接作用的相关靶蛋白,与靶蛋白的相互作用及具体作用位点,为癌症的诊断和治疗开辟一条新的途径。对具有天然细胞周期模型的小鼠受精卵的研究,将有利于揭示哺乳动物生殖发育的调控机制,更全面地认识细胞生长、发育、癌变和凋亡的内在机制,对动物繁殖、人类生殖辅助技术和肿瘤的靶向治疗具有重要的社会实用价值。
| [1] |
HAYASHI Y, FUJIMURA A, KATO K, et al. Nucleolar integrity during interphase supports faithful Cdk1 activation and mitotic entry[J]. Sci Adv, 2018, 4(6): eaap7777. DOI:10.1126/sciadv.aap7777 |
| [2] |
MOCCIARO A, SCHIEBEL E. Cdc14:a highly conserved family of phosphatases with non-conserved functions?[J]. J Cell Sci, 2010, 123(Pt 17): 2867-2876. |
| [3] |
YELLMAN C M, ROEDER G S. Cdc14 early anaphase release, FEAR, is limited to the nucleus and dispensable for efficient mitotic exit[J]. PLoS One, 2015, 10(6): e0128604. DOI:10.1371/journal.pone.0128604 |
| [4] |
POWERS B L, HALL M C. Re-examining the role of Cdc14 phosphatase in reversal of Cdk phosphorylation during mitotic exit[J]. J Cell Sci, 2017, 130(16): 2673-2681. DOI:10.1242/jcs.201012 |
| [5] |
DE WULF P, MONTANI F, VISINTIN R. Protein phosphatases take the mitotic stage[J]. Curr Opin Cell Biol, 2009, 21(6): 806-815. DOI:10.1016/j.ceb.2009.08.003 |
| [6] |
KRASINSKA L, DE BETTIGNIES G, FISHER D, et al. Regulation of multiple cell cycle events by Cdc14 homologues in vertebrates[J]. Exp Cell Res, 2007, 313(6): 1225-1239. DOI:10.1016/j.yexcr.2006.12.022 |
| [7] |
MILLER D P, HALL H, CHAPARIAN R, et al. Dephosphorylation of Iqg1 by Cdc14 regulates cytokinesis in budding yeast[J]. Mol Biol Cell, 2015, 26(16): 2913-2926. DOI:10.1091/mbc.E14-12-1637 |
| [8] |
侯艳军, 孟峻. 细胞分裂周期25磷酸化酶家族与肿瘤的研究进展[J]. 检验医学与临床, 2016, 13(4): 551-553. DOI:10.3969/j.issn.1672-9455.2016.04.051 |
| [9] |
TUMURBAATAR I, CIZMECIOGLU O, HOFFMANN I, et al. Human Cdc14B promotes progression through mitosis by dephosphorylating Cdc25 and regulating Cdk1/cyclin B activity[J]. PLoS One, 2011, 6(2): e14711. |
| [10] |
SCHINDLER K, SCHULTZ R M. CDC14B acts through FZR1(CDH1) to prevent meiotic maturation of mouse oocytes[J]. Biol Reprod, 2009, 80(4): 795-803. |
| [11] |
SUN P, ZHANG D, HUANG H P, et al. MicroRNA-1225-5p Acts as a tumor-suppressor in laryngeal cancer via targeting CDC14B[J]. Biol Chem, 2019, 400(2): 237-246. |
| [12] |
WANG J, SU Y, TIAN Y J, et al. Characterization of DNA hydroxymethylation profile in cervical cancer[J]. Artif Cells Nanomed Biotechnol, 2019, 47(1): 2706-2714. DOI:10.1080/21691401.2019.1634578 |
| [13] |
OCZKO-WOJCIECHOWSKA M, SWIERNIAK M, KRAJEWSKA J, et al. Differences in the transcriptome of medullary thyroid cancer regarding the status and type of RET gene mutations[J]. Sci Rep, 2017, 7: 42074. DOI:10.1038/srep42074 |
| [14] |
KIM J, ZHAO H B, DAN J M, et al. Maternal Setdb1 is required for meiotic progression and preimplantation development in mouse[J]. PLoS Genet, 2016, 12(4): e1005970. |
| [15] |
李瑞林, 孟峻. 细胞分裂周期蛋白14B在肿瘤中的研究进展[J]. 临床检验杂志, 2018, 36(8): 632-633. |
| [16] |
BUFFONE M G, SCHINDLER K, SCHULTZ R M. Overexpression of CDC14B causes mitotic arrest and inhibits zygotic genome activation in mouse preimplantation embryos[J]. Cell Cycle, 2009, 8(23): 3904-3913. DOI:10.4161/cc.8.23.10074 |
| [17] |
BASSERMANN F, FRESCAS D, GUARDAVACCARO D, et al. The Cdc14B-Cdh1-Plk1 axis controls the G2 DNA-damage-response checkpoint[J]. Cell, 2008, 134(2): 256-267. |
| [18] |
MOCCIARO A, BERDOUGO E, ZENG K, et al. Vertebrate cells genetically deficient for Cdc14A or Cdc14B retain DNA damage checkpoint proficiency but are impaired in DNA repair[J]. J Cell Biol, 2010, 189(4): 631-639. DOI:10.1083/jcb.200910057 |
| [19] |
LEEM J, BAI G Y, KIM J S, et al. Melatonin protects mouse oocytes from DNA damage by enhancing nonhomologous end-joining repair[J]. J Pineal Res, 2019, 67(4): e12603. |
| [20] |
刘儒, 谢基明, 孟峻. 细胞分裂周期蛋白14生物学功能的研究进展[J]. 吉林大学学报(医学版), 2019, 45(4): 960-964. |
 2020, Vol. 46
2020, Vol. 46


