扩展功能
文章信息
- 王荣荣, 王琦, 李伟, 张捷
- WANG Rongrong, WANG Qi, LI Wei, ZHANG Jie
- 以肺部多发磨玻璃样结节影为主要表现的肺原发弥漫大B细胞淋巴瘤1例报告及文献复习
- Primary pulmonary diffused large B-cell lymphoma with multiple ground glass nodule shadows in lungs as main manifestation: A case report and literature review
- 吉林大学学报(医学版), 2020, 46(03): 630-633
- Journal of Jilin University (Medicine Edition), 2020, 46(03): 630-633
- 10.13481/j.1671-587x.20200332
-
文章历史
- 收稿日期: 2019-05-24
肺原发淋巴瘤(primary pulmonary lymphoma,PPL)是原发于肺内淋巴组织的恶性淋巴瘤,是结外淋巴瘤的一种罕见类型,多数为非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL),多起源于支气管黏膜相关淋巴结组织(mucosa-associated lymphoid tissue,MALT)。肺原发弥漫大B细胞淋巴瘤(diffused large B-cell lymphoma,DLBCL)是PPL的一种类型,该类型更为罕见,占PPL的10%~20%,占所有类型淋巴瘤的0.4%[1-2]。国内外研究[3-7]显示:肺原发DLBCL患者的胸部CT表现以单侧肺部团块影或实变影为主, 患者中有多发性肺结节伴有胸腔积液和早期表现为渗出性病变者,也有空洞形成者。目前关于肺原发DLBCL患者影像学表现(多发磨玻璃样结节影)的文献报道较少。肺原发DLBCL患者因缺乏特异性临床表现,临床上容易漏诊和误诊。本文作者总结并分析本科诊治的1例以肺部多发磨玻璃样结节影为主要表现的肺原发DLBCL患者的临床资料,以提高临床医生对肺原发DLBCL的认识。
1 临床资料 1.1 一般资料患者,女性,60岁,因“咳嗽和咳痰2个月”于2018年12月3日收入本科。该患者于入院前2个月无明显诱因出现咳嗽和咳痰。行胸部CT检查未见明显异常,自行口服莫西沙星后自觉症状好转,1个月前再次出现咳嗽和咳痰症状,于当地医院行肺部CT检查显示“多发结节影”,诊断为“肺炎”,行抗感染(莫西沙星联合哌拉西林舒巴坦)治疗2周后患者自觉症状好转,再次复查胸部CT(2018年12月3日):两肺纹理增多,两肺多发结节状磨玻璃密度影(图 1)。患者为求进一步诊治就诊于本科。既往:体健。否认吸烟和大量饮酒史。查体:全身浅表淋巴结未触及肿大,听诊双肺呼吸音清,未闻及干、湿啰音和胸膜摩擦音。入院后患者行血常规、血沉、结核抗体、风湿系列相关检查、肿瘤标记物和痰液检查均未见明显异常。腹部彩超、腋窝和乳房彩超未见淋巴结异常。PET-CT检查提示:双肺多发磨玻璃结节伴部分代谢增高。结合患者的临床表现和辅助检查,建议患者进一步行纤维支气管镜取活检行组织病理学检查。
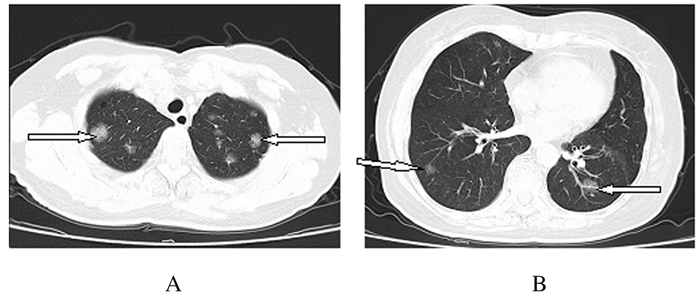
|
| A:Superior lobe; B: Inferior lobe. 图 1 肺原发DLBCL患者入院时肺组织CT影像 Fig. 1 CT images of lung tissue of one patient with primary DLBCL at admission |
|
|
病理结果为(右肺上叶)NHL,大B细胞(图 2,见封三)。免疫组织化学CD20(+),BCL-2(+), CD10(—), BCL-6(+/—), MUM-1(+), CD30(+), CyclinD1(—), C-myc约(30%+),Ki-67增殖指数大于50%,EBER(—)。最终诊断为肺原发DLBCL,病理诊断:非霍奇金DLBCL,起源于生发中心外活化B细胞。
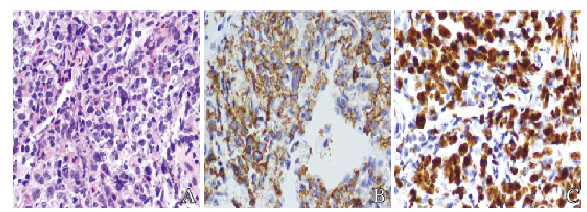
|
| A: Pathomorphology of lung tissue(HE); B, C: Immunohistochemistry; B:Expression of CD20; C:Expression of Ki67. 图 2 肺原发DLBCL患者肿瘤组织病理形态表现(×400) Fig. 2 Pathomorphology of tumor tissue of patient with primary DLBCL (×400) |
|
|
因患者符合DLBCL诊断标准,最终诊断为肺原发DLBCL,故转入本院肿瘤科,给予R-CHOP方案进行化疗,按疗程规律治疗,随访3个月后再次复查胸部CT(2019年3月8日),检查结果显示:两肺纹理增强、紊乱和模糊,两肺多发类圆形结节状病变消失(图 3)。
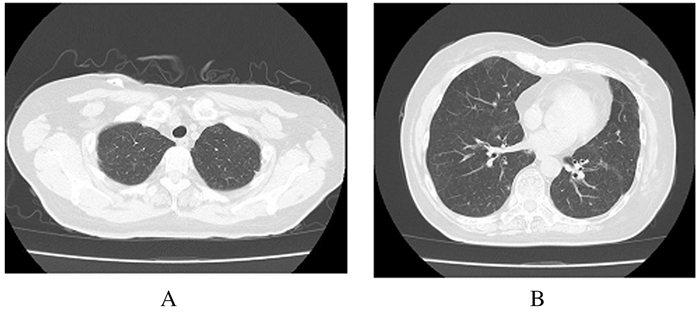
|
| A:Superior lobe; B: Inferior lobe. 图 3 肺原发DLBCL患者规律治疗3个月后肺组织CT影像 Fig. 3 CT images of lung tissue of one patient with primary DLBCL after regular treatment for 3 months |
|
|
PPL是一种较为罕见的结外淋巴瘤,定义为肺实质或支气管淋巴组织的克隆性异常增生,伴或不伴有肺门淋巴结肿大,在发病或确诊后3个月内无胸外淋巴瘤征象[8]。该患者全身淋巴结彩超未见异常淋巴结增大,骨髓穿刺未见恶性增殖淋巴细胞,随访3个月后未发现胸外淋巴瘤征象,病理免疫组织化学检测结果显示病理类型为DLBCL,诊断为肺原发DLBCL。
研究[9]显示:肺原发DLBCL是PPL的第二常见病理类型,单纯DLBCL的起源尚无法明确, 部分可由黏膜相关淋巴组织(MALT)淋巴瘤转化而来, 故其临床和影像学特征与MALT淋巴瘤较为相似。肺原发DLBCL多见于中老年人和免疫抑制者,男女比例无明显差异[10],患者呼吸系统症状多表现为咳嗽、呼吸困难和胸痛,偶有咯血, 全身症状包括发热、盗汗及体质量减轻等非特异性临床特征[11-12],少数患者无临床症状,仅体检时发现肺部结节或阴影[13],诊断主要依赖组织病理学和免疫组织化学检查。
有研究[14]显示:PPL患者CT检查表现为单发或多发结节、团块或实变影,有时可见空气支气管征、病变周围晕征和血管造影征。而肺原发性DLBCL病变多发于下叶外周,CT检查多表现为边缘清晰的孤立多发结节影和团块影,也可表现为斑片状或不规则实变,伴或不伴磨玻璃样影,另外间质受累,病变浸润胸膜出现胸腔积液者亦有报道[15-16]。纵隔淋巴结节增大及胸腔积液较低度恶性淋巴瘤更为常见[17], 多层螺旋CT检查可表现为区域坏死性空洞[18],该例患者以胸部多发磨玻璃结节影为主要表现。
镜下DLBCL由弥漫成片的、大的母细胞性淋巴样细胞组成, 可融合成群, 破坏正常的肺组织,50%患者可出现局部淋巴结受累[11],研究[11-12]显示:肺原发DLBCL患者的典型免疫组织化学表现为CD20和CD79a阳性及轻链限制, Ki67增殖指数呈典型性升高。DLBCL是PPL的第二常见病理类型(约占PPL的10%),较MALT淋巴瘤(占PPL的70%~90%)更具侵袭性且预后差。两者治疗方案相似,但由于DLBCL局部或远处转移复发率较高,即使病变局限者手术切除后仍需要联合放化疗,高度恶性的大B细胞淋巴瘤一般不推荐手术,以化疗为主[19]。Ki67对预测DLBCL具有十分重要的意义,增殖指数大于60%提示预后较差。有研究[20]表明:DLBCL患者中约有45%出现B淋巴细胞瘤2基因(B-cell lymphoma-2,Bcl-2)蛋白高表达,而高表达BCL-2或骨髓细胞瘤原癌基因(myelocytomatosis oncogene,MYC)均会导致患者预后不良。另有研究[21]显示:所有DLBCL患者中,并发c-MYC基因异常者约占10%,且该类患者肿瘤细胞较c-MYC基因突变阴性者具有更强的增殖活性,提示BCL-2或MYC和c-MYC基因突变是DLBCL患者预后评估的重要指标[22-23]。该患者经规律化疗,3个月后复查胸部CT检查可见双肺磨玻璃影消失,结合基因检测标记,提示患者预后较好。
综上所述,肺原发DLBCL临床少见,当临床症状较轻,影像学却出现单发或多发的结节、团块或实变影或伴有空气支气管征、病变周围晕征和血管造影征,痰涂片及痰脱落等细胞学检查多为阴性,前期抗炎治疗效果不佳,病情进展或反复时,应考虑该病的可能性。本文作者分析1例以肺部多发磨玻璃样结节为主要表现的肺原发DLBCL患者的诊治经过,以提高临床医生对该类疾病的认识,减少误诊及漏诊。
| [1] |
张金棒, 曹洁. 原发性肺弥漫大B细胞淋巴瘤的临床病理分析[J]. 医学综述, 2017, 23(19): 3781-3784. |
| [2] |
SALHAN D, VERMA P, NANING T W, et al. Primary pulmonary lymphoma presenting with superior vena cava syndrome in a young female[J]. Case Rep Pulmonol, 2017, 2017: 1937107. |
| [3] |
MATSUMOTO T, OTSUKA K, FUNAYAMA Y, et al. Primarypulmonary lymphoma mimicking a refractory lung abscess:a case report[J]. Oncol Lett, 2015, 9(4): 1575-1578. |
| [4] |
赵青春, 韦森, 李昕, 等. 原发性肺淋巴瘤1例[J]. 中国肺癌杂志, 2014, 17(10): 765-768. |
| [5] |
SHINODA K, TAKI H, TSUDA T, et al. Primary pulmonary lymphoma presenting with multiple lung nodules[J]. Am J Respir Crit Care Med, 2014, 190(9): e30-e31. |
| [6] |
ESCHE C, LOKSHIN A, SHURIN G V, et al. Tumor's other immune targets:dendritic cells[J]. Leukoc Biol, 1999, 66(2): 336-344. |
| [7] |
JURCZAK W, OCHREM B, GIZA A, et al. Role of rituximab in the first line therapy of high risk diffuse large B cell lymphoma:a retrospective analysis by polish lymphoma research group[J]. Pol Arch Med Wewn, 2015, 125(10): 741-748. |
| [8] |
TANG V K, VIJHANI P, CHERIAN S V, et al. Primary pulmonary Lympho proliferative neoplasms[J]. Lung India, 2018, 35(3): 220-230. |
| [9] |
张瑶, 徐凌. 原发性肺淋巴瘤的临床进展[J]. 国际呼吸杂志, 2019, 39(9): 699-705. |
| [10] |
BAI Y, LIANG W. CT and PET/CT findings of primary pulmonary diffuse large B-cell lymphoma:One case report and literature review[J]. Medicine (Baltimore), 2017, 96(47): e8876. |
| [11] |
PINA-OVIEDO S, WEISSFERDT A, KALHOR N, et al. Primary pulmonary lymphomas[J]. Adv Anat Pathol, 2015, 22(6): 355-375. |
| [12] |
TANG V K, VIJHANI P, CHERIAN S V, et al. Primary pulmonary lympho proliferative neoplasms[J]. Lung India, 2018, 35(3): 220-230. |
| [13] |
张锦, 黄幸, 陆珍凤, 等. 肺原发性非霍奇金淋巴瘤28例临床病理分析[J]. 临床与实验病理学杂志, 2015, 31(7): 784-788. |
| [14] |
马媛媛, 王燕, 宋琦, 等. 肺原发性淋巴瘤的CT影像学特点及文献复习[J]. 诊断学理论与实践, 2018, 17(5): 533-537. |
| [15] |
WROBEL T, DZIETCZENIA J, PROCHOREC-SOBIESZEK M, et al. Primary pulmonary diffuse large B-cell lymphoma[J]. Am J Hematol, 2012, 87(1): 107-108. |
| [16] |
TANRIVERDI E, ACAT M, OZGUL G, et al. Primary pulmonary lymphoma:four different and unusual radiologic and clinical manifestations[J]. Leuk Lymphoma, 2017, 58(5): 1231-1233. |
| [17] |
BLIGH M P, BORGAONKAR J N, BURRELL S C, et al. Spectrum of CT findings in thoracic extranodal non-Hodgkinlymphoma[J]. Radiographics, 2017, 37(2): 439-461. |
| [18] |
陈哲, 陈庆东, 周海生, 等. 肺原发性淋巴瘤的多层螺旋CT诊断[J]. 医学影像学杂志, 2014, 24(5): 741-744. |
| [19] |
BORIE R, WISLEZ M, ANTOINE M, et al. Lympho proliferative disorders of the lung[J]. Respiration, 2017, 94(2): 157-175. |
| [20] |
黄文亭, 吕宁, 郭蕾, 等. c-myc基因在弥漫性大B细胞淋巴瘤中的意义及其应用[J]. 中华病理学杂志, 2013, 42(9): 638-640. |
| [21] |
杨莉洁, 周伟. 弥漫大B细胞淋巴瘤组织中BCL-2、NF-κB、c-Myc蛋白表达及临床意义[J]. 中国医学前沿杂志(电子版), 2016, 8(11): 125-128. |
| [22] |
陈文婷, 姚红霞, 吴从明, 等. MYC、BCL-2和BCL-6检测在弥漫性大B细胞淋巴瘤患者预后判断中的价值[J]. 中国实验血液学杂志, 2019, 27(2): 452-457. |
| [23] |
刁建军, 刘倚含, 李冰, 等. 炎性指标在弥漫大B细胞淋巴瘤患者中的临床意义[J]. 同济大学学报(医学版), 2019, 40(3): 309-314. |
 2020, Vol. 46
2020, Vol. 46


