扩展功能
文章信息
- 林晓娥, 吴景华, 黎洁, 刘洋, 谌晓楠, 祝朝前, 李广平
- LIN Xiaoe, WU Jinghua, LI Jie, LIU Yang, SHEN Xiaonan, ZHU Chaoqian, LI Guangping
- 慢性HBV感染者外周血单个核细胞中miR-194-5p和MagT1表达水平检测及其意义
- Detection of expression levels of miR-194-5p and MagT1 in peripheral blood mononuclear cells of patients with chronic HBV infection and their significances
- 吉林大学学报(医学版), 2020, 46(03): 607-613
- Journal of Jilin University (Medicine Edition), 2020, 46(03): 607-613
- 10.13481/j.1671-587x.20200328
-
文章历史
- 收稿日期: 2019-07-12
2. 华北理工大学附属医院检验科, 河北 唐山 063000;
3. 河北省唐山市工人医院肝胆外科, 河北 唐山 063000
2. Department of Clinical Laboratory, Affiliated Hospital, North China University of Science and Technology, Tangshan 063000, China;
3. Department of Hepatobiliary Surgery, Tangshan Worker's Hospital, Tangshan 063000, China
镁离子(Mg2+)转运蛋白1(magnesium transporter protein 1,MagT1)是一种高度特异性Mg2+通道,对细胞中Mg2+稳态维持起重要的调控作用。Mg2+作为细胞内第二信使,参与能量代谢和蛋白质合成等600多种酶促反应,在免疫细胞免疫应答和免疫信号转导中发挥重要作用[1]。研究[2-3]显示:MagT1缺失或突变介导的Mg2+内流障碍引起的T淋巴细胞功能障碍可导致一种原发性免疫缺陷疾病即X连锁Mg2+通道缺陷联合免疫缺陷病(X-linked immunodeficiency with magnesium defect, Epstein-Barr virus infection, and neoplasia,XMEN)。DIAO等[4]研究显示:MagT1表达下调介导的Mg2+紊乱可导致HBV感染者体内CD8+ T淋巴细胞和NK细胞功能耗竭。前期研究[5]也证实:CD8+T淋巴细胞中MagT1表达下调所致的Mg2+内流障碍与慢性乙型肝炎病毒(hepatitis B virus, HBV)感染者CD8+T淋巴细胞功能耗竭有关联,提示MagT1是调节机体免疫反应的关键分子,其表达异常可能导致多种免疫疾病的发生发展。微小RNA(microRNA,miRNA)是一类长度为21~25 nt的非编码RNA,其主要通过与靶基因3′-非编码区(untranslated regions,UTR)结合,引起靶基因mRNA降解或抑制其翻译而发挥生物学功能。研究[6]显示:miR-194-5p在慢性乙型肝炎(chronic hepatitis B,CHB)患者血清中呈较高水平,并且在肝癌细胞胞外囊泡中高表达。NIELSEN等[7]研究显示:体外采用HBV持续感染可诱导肝母细胞癌HepG2细胞中miR-194-5p表达持续上调,并介导细胞抗凋亡能力增强,表明miR-194-5p可能在HBV相关肝脏疾病中高表达,并可能导致疾病进一步恶化。有关MagT1和miR-194-5p在慢性HBV感染者免疫细胞中的表达水平及其可能的靶向调控关系目前报道较少。本研究通过检测慢性HBV感染者外周血单个核细胞(peripheral blood mononuclear cells, PBMCs)中MagT1和miR-194-5p表达水平,探讨二者的相互作用机制及其对CHB发生发展的意义。
1 资料与方法 1.1 临床资料选取2016年6月—2018年10月在河北省唐山市工人医院肝胆外科门诊就诊的120例未经抗病毒治疗的HBV感染者作为研究对象,其中CHB患者(CHB组) 80例,HBV携带者(HBV携带组)40例,其中男性22例,女性18例,平均年龄(40.65±10.88)岁。HBV感染者纳入标准:诊断均符合中华医学会肝病学分会和中华医学会感染病学分会联合修订的《慢性乙型肝炎防治指南(2015年版)》中诊断标准[8],且患者无其他特殊病史;排除标准:兼有其他类型肝炎病毒感染者、有抗病毒治疗史者及有肝病史者。根据慢性肝炎病情分类标准[9]将CHB组患者分为轻中度CHB组和重度CHB组,每组各40例。轻中度CHB组中男性21例,女性19例,平均年龄(41.15±9.14)岁;重度CHB组中男性23例,女性17例,平均年龄(40.96±11.01)岁。同时选取健康体检者40人作为健康对照组,其中男性20人,女性20人,平均年龄(40.27±13.21)岁。本研究获得河北省唐山市工人医院伦理道德委员会批准,所有受试者均知情同意,并签署知情同意书。
1.2 细胞、质粒、主要试剂和仪器293T细胞购自中国典型培养物保藏中心细胞库。MagT1-3′UTR野生型和突变型质粒及miR-194-5p mimic及miR-194-5p NC质粒均由广州锐博生物科技有限公司提供。聚蔗糖-泛影葡胺(Ficoll-Hypaque)溶液购自广东省广州市美景生物科技有限公司,SYBR® Green PCR Kit购自日本TaKaRa公司,程序性死亡受体1(programmed death receptor 1, PD-1)和自然杀伤细胞受体2群D分子(natural killer cell receptor 2 group D molecule, NKG2D)、兔抗人MagT1多克隆抗体和兔抗人GAPDH单克隆抗体均购自美国Abcam公司,小鼠抗人CD3-APC抗体、小鼠抗人CD3-FITC抗体、小鼠抗人CD279 (PD-1)-PE抗体和小鼠抗人CD314 (NKG2D)-APC抗体均购自美国BD公司。Mag-Fura2-AM荧光探针购自美国Thermo Fisher Scientific公司,Dual-Luciferase®报告系统购自美国Promega公司,全自动生化分析仪购自深圳迈瑞生物医疗电子股份有限公司,C6流式细胞仪购自美国BD公司。
1.3 PBMCs分离采集患者和健康体检者的空腹外周血,加入肝素钠抗凝,采用Ficoll-Hypaque密度梯度离心法分离PBMCs,取中间灰白色层,PBS洗涤2次后留取PBMCs备用。
1.4 RT-PCR法检测各组研究对象PBMCs中miR-194-5p和MagT1 mRNA表达水平取各组PBMCs细胞,采用TRIzol法提取总RNA,定量后取2 μg逆转录合成cDNA。取2 μL逆转录产物作为模板,加入相应引物和10 μL SYBR® Green PCR Kit的试剂之一SYBR Green Master Mix进行扩增反应。miR-194-5pmRNA表达水平检测以U6作为内参,MagT1 mRNA表达水平检测以GAPDH作为内参。引物序列:miR-194-5p,Forward 5′-ACACTCCAGCTGGGTGTAACAGCAA- CTCC-3′,Reverse 5′-TGGTGTCGTGGAGTCG-3′;U6,Forward 5′-CTCGCTTCGGCAGCACA-3′,Reverse 5′-AACGCTTCACGAATTTGCGT-3′;MagT1,Forward5′-ACCTAGCCGGAGCAAAGTTTC-3′,Reverse 5′-CGTCGCAAACG- ATGAGCAG-3′;GAPDH,Reverse 5′-ACTAGGCGCTCACTGTTCTC-3′,Reverse 5′-ATCCGTTGACTCCGACCTTC-3′。PCR反应条件:94℃预变性60 s,94℃变性60 s,58℃退火60 s,72℃延伸60 s,共40个循环。采用2-ΔΔCT法计算各组研究对象PBMCs中miR-194-5p和MagT1 mRNA表达水平。
1.5 Western blotting法检测各组研究对象PBMCs中MagT1蛋白表达水平取各组PBMCs,加入适量RIPA全蛋白裂解液,置于冰上裂解30 min,4℃、12 000 r·min-1离心25 min,收集上清,检测蛋白浓度。取30 μg各组蛋白进行上样,行SDS-PAGE凝胶电泳分离蛋白,转膜,5%脱脂牛奶室温封闭1 h,加入MagT1抗体(1:1 000)和GAPDH抗体(1:1 000),4℃条件下孵育过夜。次日,PBS洗涤后加入HRP标记的二抗,室温孵育30 min,显影,采用Image-Pro Plus 6.0图像分析软件进行条带灰度分析,计算MagT1蛋白表达水平。MagT1蛋白表达水平=MagT1蛋白条带灰度值/内参GAPDH条带灰度值。
1.6 外周血和PBMCs中Mg2+水平检测取外周血,分离血清,采用全自动生化分析仪检测血清中Mg2+水平;取各组研究对象的PBMCs,采用HEPES缓冲液(不含Mg2+和Ca2+)重悬细胞并计算,以1.5×106mL-1的细胞密度加入3 μmol·L-1荧光探针Mag-Fura4-AM溶液,于37℃条件下避光孵育30 min,终止探针孵育,1500 r·min-1离心5 min,弃上清,加入500 mL HEPES缓冲液重悬细胞,上机检测。
1.7 流式细胞术检测各组研究对象PBMCs中CD8+T淋巴细胞表面分子PD-1和NKG2D表达水平取各组PBMCs,调整细胞浓度至1.5×105mL-1,取0.5 mL细胞悬液,依次加入CD3-APC抗体、CD3-FITC抗体、PD-1-PE抗体或NKG2D-APC抗体,混匀后避光孵育30 min,中止反应后1 500 r·min-1离心5 min,弃上清,500 mL PBS重悬细胞,采用流式细胞术检测,采用CD3+CD8+双阳性细胞群圈门,以CD3+CD8+PD-1+细胞群和CD3+CD8+NKG2D+细胞群百分比表示PD-1和NKG2D表达水平。
1.8 双荧光素酶报告基因实验检测293T细胞中相对荧光素酶活性利用Targetscan miRNA靶基因预测软件预测miR-194-5p在MagT1 mRNA上的结合位点,构建野生型(WT)和突变型(MUT)MagT1-3′UTR的报告基因质粒,分别与miR-194-5p mimic和miR-NC质粒转染至293T细胞中培养48 h, 作为miR-194-5p mimic组和miR-NC组。按照Dual-Luciferase®报告系统说明书操作,检测2组293T细胞中萤火虫荧光素酶和海肾荧光素酶的荧光强度,计算293T细胞荧光素酶活性。荧光素酶活性=萤火虫荧光素酶荧光强度/海肾荧光素酶荧光强度。
1.9 统计学分析采用SPSS 22.0统计软件进行统计学分析。各组研究对象PBMCs中miR-194-5pmRNA、MagT1 mRNA和蛋白表达水平,各组研究对象外周血和PBMCs中Mg2+水平,CD8+T细胞表面分子PD-1和NKG2D表达水平以及293T细胞中荧光素酶活性以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组研究对象PBMCs中miR-194-5p mRNA和MagT1 mRNA及蛋白表达水平与健康对照组比较,HBV携带组、轻中度CHB组和重度CHB组患者PBMCs中miR-194-5p mRNA表达水平明显升高(P < 0.05),MagT1 mRNA和蛋白表达水平则明显降低(P < 0.05);重度CHB组患者PBMCs中miR-194-5p mRNA表达水平明显高于HBV携带组和轻中度CHB组,而MagT1 mRNA和蛋白表达水平则明显低于HBV携带组和轻中度CHB组(P < 0.05)。见表 1和图 1。
| (n=40, x±s) | |||||||||||||||||||||||||||||
| Group | miR-194-5pmRNA | MagT1 mRNA | |||||||||||||||||||||||||||
| Healthy control | 1.00±0.00 | 1.00±0.00 | |||||||||||||||||||||||||||
| HBV carrier | 2.91±0.12* | 0.72±0.57* | |||||||||||||||||||||||||||
| Mild-moderate CHB | 5.68±0.41*△ | 0.48±0.39*△ | |||||||||||||||||||||||||||
| Severe CHB | 8.31±0.62*△# | 0.16±0.09*△# | |||||||||||||||||||||||||||
| * P < 0.05 compared with healthy control group; △ P < 0.05 compared with HBV carrier group; # P < 0.05 compared with mild-moderate CHB group. | |||||||||||||||||||||||||||||
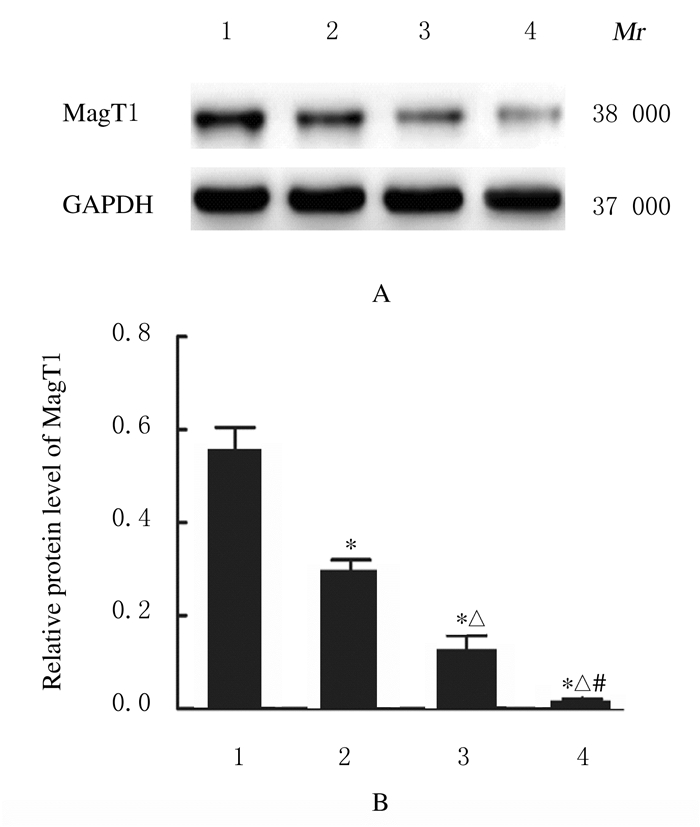
|
| A:Electrophoregram; Lane 1: Healthy control group; Lane 2: HBV carrier group; Lane 3: Mild-moderate CHB group; Lane 4: Severe CHB group.B:Histogram; 1:Healthy control group; 2:HBV carrier group; 3:Mild-moderate CHB group; 3:Severe CHB group. *P < 0.05 compared with healthy control group; △P < 0.05 compared with HBV carrier group; #P < 0.05 compared with mild-moderate CHB group. 图 1 各组研究对象PBMCs中MagT1蛋白表达情况 Fig. 1 Expressions of MagT1 protein in PBMCs of subjects in various groups |
|
|
各组研究对象外周血中Mg2+水平比较差异无统计学意义(P>0.05)。HBV携带组、轻中度CHB组和重度CHB组患者PBMCs中Mg2+水平均明显低于健康对照组(P < 0.05)。重度CHB组患者PBMCs中Mg2+水平明显低于HBV携带组和轻中度CHB组(P < 0.05)。见表 2。
| [n=40, x±s, cB/(μmol·L-1)] | |||||||||||||||||||||||||||||
| Group | Peripheral blood | PBMCs | |||||||||||||||||||||||||||
| Healthy control | 924.21±87.36 | 427.22±67.14 | |||||||||||||||||||||||||||
| HBV carrier | 907.55±96.24 | 351.78±53.33* | |||||||||||||||||||||||||||
| Mild-moderate CHB | 914.87±90.19 | 269.93±40.16*△ | |||||||||||||||||||||||||||
| Severe CHB | 899.04±84.37 | 107.78±27.29*△# | |||||||||||||||||||||||||||
| * P < 0.05 compared with healthy control group; △P < 0.05 compared with HBV carrier group; #P < 0.05 compared with mild-moderate CHB group. | |||||||||||||||||||||||||||||
HBV携带组、轻中度CHB组和重度CHB组患者PBMCs中CD8+T淋巴细胞表面分子PD-1表达水平均明显高于健康对照组(P < 0.05),而NKG2D表达水平均明显低于健康对照组(P < 0.05)。重度CHB组患者PBMCs中PD-1表达水平明显高于HBV携带组和轻中度CHB组(P < 0.05),NKG2D表达水平明显低于HBV携带组和轻中度CHB组(P < 0.05)。见表 3。
| (n=40, x±s, η/%) | |||||||||||||||||||||||||||||
| Group | PD-1 | NKG2D | |||||||||||||||||||||||||||
| Healthy control | 7.24±0.95 | 31.22±2.54 | |||||||||||||||||||||||||||
| HBV carrier | 11.17±1.07* | 24.38±1.38* | |||||||||||||||||||||||||||
| Mild-moderate CHB | 17.93±1.61*△ | 15.79±1.72*△ | |||||||||||||||||||||||||||
| Severe CHB | 24.65±2.18*△# | 8.11±0.87*△# | |||||||||||||||||||||||||||
| * P < 0.05 compared with healthy control group; △ P < 0.05 compared with HBV carrier group; # P < 0.05 compared with mild-moderate CHB group. | |||||||||||||||||||||||||||||
通过Targetscan生物信息学软件预测,结果显示:MagT1可能是miR-194-5p的靶基因。双荧光素酶报告基因实验检测结果显示:与野生型(WT)MagT1-3′UTR的报告基因质粒(MagT1-WT)结合后,与miR-NC组比较,miR-194-5p mimic组293T细胞中荧光素酶活性降低(P < 0.05),表明miR-194-5p过表达可明显降低野生型MagT1 3′-UTR报告基因的荧光素酶活性;与突变型(MUT)MagT1-3′UTR的报告基因质粒(MagT1-WT)结合后,与miR-NC组比较,miR-194-5p mimic组293T细胞中荧光素酶活性变化不明显,表明miR-194-5p过表达对突变型MagT1 3′-UTR报告基因的荧光素酶活性无明显影响(P>0.05)。见图 2。
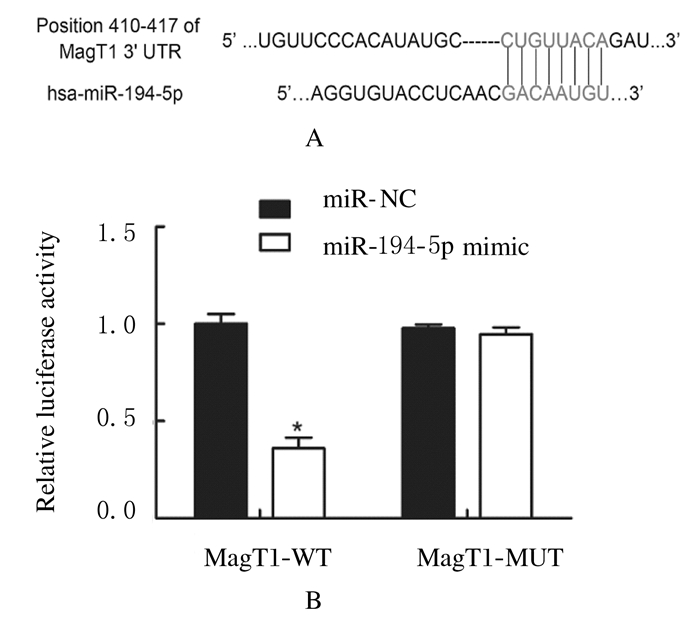
|
| A:Binding site of miR-194-5p to MagT1-3′UTR; B:Histogram of luciferase activity. *P < 0.05 compared with miR-NC group. 图 2 2组293T细胞中荧光素酶活性 Fig. 2 Activities of luciferase in 293T cells in two groups |
|
|
HBV是一种嗜肝DNA病毒,具有较强的复制能力和感染能力,HBV感染属于全球性公共卫生问题。截至2017年,我国HBV感染人数超过9 000万,居世界首位,其防控与治疗形势不容乐观。研究[10]显示:10%~30% CHB患者会发展成肝硬化,而这些肝硬化患者中又有5%~10%患者最终会转变成肝癌。因此深入研究HBV感染所致的机体免疫功能紊乱过程中某些异常表达的分子及其相互作用机制,将会对HBV相关肝病的防控及治疗起积极推动作用。
PBMCs是外周血中由多种免疫细胞组成的混合细胞群体,包括T淋巴细胞、B淋巴细胞和NK细胞等,在机体免疫反应中发挥至关重要的作用[11-12]。机体在感染HBV后会产生保护性免疫反应,能够及时有效地抑制HBV复制并清除HBV病毒颗粒[13]。在慢性HBV感染的过程中,机体中却普遍存在T淋巴细胞免疫功能缺陷的现象[14-15],进而导致肝硬化、肝功能衰竭和原发性肝癌等更为严重的肝脏疾病发生。研究[6]显示:HBeAg阳性CHB患者血清中miR-194-5p水平较高,miR-194-5p表达水平与HBV DNA和HBsAg水平呈正相关关系。NIELSEN等[7]报道显示:HBV感染能诱导HepG2细胞中miR-194-5p表达,增强细胞抗凋亡能力。本研究结果显示:在HBV感染患者即HBV携带者、轻中度CHB患者和重度CHB患者PBMCs中miR-194-5pmRNA表达水平较健康体检者逐渐升高,说明miR-194-5p mRNA在HBV感染过程中表达异常增加,可能会参与HBV感染所致的机体免疫功能紊乱过程的调控。本研究结果显示:在HBV携带者、轻中度CHB患者和重度CHB患者PBMCs中MagT1 mRNA及蛋白表达水平较健康体检者降低。研究[3-4]表明:MagT1缺失或下调能够导致包括HBV等多种病毒感染过程中T淋巴细胞免疫失活或功能耗竭,提示miR-194-5p有可能通过靶向MagT1参与HBV感染过程中T淋巴细胞功能紊乱的调控。本研究通过Targetscan生物信息学软件预测及双荧光素酶报告基因实验证实:MagT1是miR-194-5p的靶基因。
MagT1是一种对Mg2+有高度特异性的转运体,可调节细胞中自由Mg2+水平,Mg2+作为细胞内第二信使参与机体免疫功能的调节目前已被证实[1]。有研究[16]显示:MagT1基因缺失介导的细胞中Mg2+水平降低可导致慢性EBV感染过程中NK和CD8+ T淋巴细胞免疫毒性降低。本研究结果显示:慢性HBV感染者外周血中Mg2+水平与健康体检者比较差异无统计学意义,与邵红玲等[17]研究结果一致。但在HBV携带者、轻中度CHB患者和重度CHB患者PBMCs中Mg2+水平较健康体检者均降低,与MagT1表达趋势相吻合,说明MagT1表达下调的同时导致机体免疫细胞中Mg2+水平因内流障碍而明显减少,进而影响免疫细胞免疫活性。此外,CD8+ T淋巴细胞是机体内清除HBV的主要免疫细胞[18-19],然而其表面PD-1等免疫抑制分子表达增加以及NKG2D等免疫激活分子表达下调将导致其功能耗竭[20-22]。本研究结果显示:HBV携带者、轻中度CHB患者和重度CHB患者外周血CD8+ T淋巴细胞表面分子PD-1表达水平升高,NKG2D表达水平降低,说明在HBV慢性感染过程中出现了CD8+ T淋巴细胞功能耗竭。
综上所述,在CHB发展过程中miR-194-5p可能通过靶向下调MagT1表达介导Mg2+内流障碍,造成CD8+T淋巴细胞免疫活性降低,这可能是导致CHB形成的重要原因。
| [1] |
BRANDAO K, DEASON-TOWNE F, PERRAUD A L, et al. The role of Mg2+ in immune cells[J]. Immunol Res, 2013, 55(1-3): 261-269. |
| [2] |
LI F Y, CHAIGNE-DELALANDE B, SU H, et al. XMEN disease:a new primary immunodeficiency affecting Mg2+ regulation of immunity against Epstein-Barr virus[J]. Blood, 2014, 123(14): 2148-2152. |
| [3] |
LI F Y, LENARDO M J, CHAIGNE-DELALANDE B. Loss of MAGT1 abrogates the Mg2+ flux required for T cell signaling and leads to a novel human primary immunodeficiency[J]. Magnes Res, 2011, 24(3): S109-S114. |
| [4] |
DIAO B, HUANG XY, GUO S, et al. MAGT1-mediated disturbance of Mg2+ homeostasis lead to exhausted of HBV-infected NK and CD8+ T cells[J]. Sci Rep, 2017, 7(1): 13594. |
| [5] |
林晓娥, 吴景华, 王宁, 等. 慢性乙型肝炎病毒感染者Mg2+转运蛋白1表达水平对CD8+T细胞耗竭的影响[J]. 实用医学杂志, 2019, 35(13): 2070-2073. |
| [6] |
VAN DER REE M H, JANSEN L, KRUIZE Z, et al. Plasma microRNA levels are associated with hepatitis B antigen status and treatment response in chronic hepatitis B patients[J]. J Infect Dis, 2017, 215(9): 1421-1429. |
| [7] |
NIELSEN K O, JACOBSEN K S, MIRZA A H, et al. Hepatitis B virus upregulates host microRNAs that target apoptosis-regulatory genes in an in vitro cell model[J]. Exp Cell Res, 2018, 371(1): 92-103. |
| [8] |
中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2015年版)[J]. 中国肝脏病杂志(电子版), 2015, 7(3): 4-6. |
| [9] |
中华医学会传染病与寄生虫病学分会, 肝病学分会. 病毒性肝炎防治方案[J]. 中华内科杂志, 2001, 40(1): 62-68. |
| [10] |
SETO W K, LO Y R, PAWLOTSKY J M, et al. Chronic hepatitis B virus infection[J]. Lancet, 2018, 392(10161): 2313-2324. |
| [11] |
HECK S, BISHOP C J, ELLIS R J. Immunophenotyping of human peripheral blood mononuclear cells by mass cytometry[J]. Methods Mol Biol, 2019, 1979: 285-303. |
| [12] |
梅清, 李小鹏, 吴振平, 等. HBV感染人外周血单个核细胞时体外免疫效应的变化[J]. 实用医学杂志, 2018, 34(24): 4027-4031. |
| [13] |
史继静, 张纪元, 王福生. HBV感染的免疫发病机制及抗病毒治疗策略[J]. 中国病毒病杂志, 2017, 7(3): 161-166. |
| [14] |
WANG Y G, ZHENG D H, SHI M, et al. T cell dysfunction in chronic hepatitis B infection and liver cancer:evidence from transcriptome analysis[J]. J Med Genet, 2019, 56(1): 22-28. |
| [15] |
刘亚男, 余追, 姚兰, 等. Galectin-9/Tim-3信号通路在HBV感染中对机体固有免疫及适应性免疫调控的研究进展[J]. 中国免疫学杂志, 2018, 34(10): 1590-1595. |
| [16] |
CHAIGNE-DELALANDE B, LI F Y, O'CONNOR G M, et al. Mg2+ regulates cytotoxic functions of NK and CD8 T cells in chronic EBV infection through NKG2D[J]. Science, 2013, 341(6142): 186-191. |
| [17] |
邵红玲, 彭丽, 彭晓明. 慢性HBV感染者外周血CD8+T细胞中Mg2+水平及其临床意义[J]. 内科, 2017, 12(6): 731-734. |
| [18] |
刘畅, 王红艳. CD8+ T细胞活化与分化的分子机制[J]. 中国免疫学杂志, 2017, 33(4): 481-487. |
| [19] |
FERRARI C, BONI C, ROSSI M, et al. T cell regulation in HBV-related chronic liver disease[J]. J Hepatol, 2017, 66(5): 1096-1098. |
| [20] |
孙建军, 冯辉. CD8+T细胞耗竭及靶向CD8+T细胞免疫治疗的研究进展[J]. 免疫学杂志, 2016, 32(9): 816-820. |
| [21] |
李欢, 陈娟娟, 祝成亮, 等. 血清生长分化因子15和甲胎蛋白联合检测对HBV相关肝细胞癌的诊断价值[J]. 临床肝胆病杂志, 2020, 36(3): 569-572. |
| [22] |
翁奉武, 郭丽颖, 李秋伟, 等. 外周血淋巴细胞亚群在慢性HBV感染过程中表达的变化分析[J]. 临床肝胆病杂志, 2020, 36(1): 65-69. |
 2020, Vol. 46
2020, Vol. 46


