扩展功能
文章信息
- 郭小菲, 刘立红, 艾浩
- GUO Xiaofei, LIU Lihong, AI Hao
- 含缬酪肽蛋白在上皮性卵巢癌组织中的表达及其临床意义
- Expression of valosin-containing protein in epithelial ovarian cancer tissue and its clinical significance
- 吉林大学学报(医学版), 2020, 46(03): 600-606
- Journal of Jilin University (Medicine Edition), 2020, 46(03): 600-606
- 10.13481/j.1671-587x.20200327
-
文章历史
- 收稿日期: 2019-09-10
2. 锦州医科大学附属第一医院妇产科, 辽宁 锦州 121000
2. Department of Obstetrics and Gynecology, First Affiliated Hospital, Jinzhou Medical University, Jinzhou 121000, China
卵巢癌是我国女性生殖系统死亡率最高的恶性肿瘤。2015年我国卵巢癌死亡病例接近新发病例的一半。近年来随着分子生物学的迅速发展,人们对卵巢癌的发生发展有了新的认识,卵巢癌是一种多基因参与的疾病,其发生发展是一个多基因参与的过程。目前,虽然明确了与卵巢癌发生发展相关的蛋白及其表达产物,但只有一小部分应用于临床。因此需要更加深入地探讨卵巢癌的具体发病机制,寻找新的肿瘤标记物。
含缬酪肽蛋白(valosin-containing protein,VCP)即酵母中的Cdc48,最初是在对酿酒酵母进行基因筛选时发现的,因其相对分子质量为97 000,又被称为P97,属于参与多种细胞活性相关的三磷酸腺苷酶超家族中的一员,在多种重要的细胞活动中起分子伴侣的作用,可以与30多种不同功能的细胞蛋白相互作用,影响包括细胞核和高尔基体膜形态改变、线粒体质量控制、囊泡转运、转录调控、膜融合、细胞程序性死亡、泛素/蛋白酶依赖性蛋白降解和内质网相关性降解等生理过程[1]。VCP在多种肿瘤,如宫颈癌[2]、前列腺癌[3]和骨肉瘤[4]等组织中异常表达。目前关于VCP在卵巢癌组织中的表达情况及其与NF-κB信号通路关系的报道较少。本文作者从组织和细胞两个方面探讨VCP在卵巢癌组织中的表达情况及其在卵巢癌发生发展中的作用。CB-5083是一种VCP选择性、竞争性抑制剂,主要通过选择性结合VCP D2结构域上的ATP结合位点而发挥作用[5-6]。本研究根据ZHOU等[7]得出的CB-5083半数抑制浓度(median inhibitory concentration,IC50)为680 nmol·L-1作为CB-5083的终浓度进行实验。
1 资料与方法 1.1 研究对象收集2013年1月—2018年1月于锦州医科大学附属第一医院妇产科初诊并行手术治疗的94例卵巢上皮性癌(epithelial ovarian cancer, EOC)患者的临床资料。取94例患者手术切除的癌组织石蜡标本。所有卵巢癌患者术前均未行放疗、化疗和激素治疗,且患者未并发其他脏器肿瘤。所有标本的病理诊断均经术后石蜡切片证实,石蜡组织切片诊断结果均由同一名病理科专家复检。患者年龄为15~75岁,平均年龄为(54.90± 10.55)岁。年龄≤50岁者32例,>50岁者62例;手术病理分期使用2013年国际妇产科联盟(FIGO)重新修订的标准进行分期:早期(Ⅰ-Ⅱ期) 35例、晚期(Ⅲ-Ⅳ期)59例。病理类型:浆液性腺癌46例,黏液性腺癌14例,子宫内膜样腺癌20例,透明细胞性癌14例;组织学分级:低分化44例、中分化34例、高分化16例;术中发现有腹水者55例,无腹水者39例;淋巴结转移57例,无淋巴结转移37例;血清CA125>35 U·mL-1者58例,血清CA125≤35 U·mL-1者36例。同时收集同一时间段的交界性肿瘤(13例)、良性肿瘤(36例)和正常卵巢组织石蜡标本(8例),标本所属研究对象的年龄为15~62岁,平均年龄为(38.84±11.09)岁。
1.2 细胞、主要试剂和仪器卵巢癌SKOV-3细胞和卵巢上皮细胞HOSEpiC购自深圳市豪地华拓生物科技公司。抗VCP抗体、Cy3标记山羊抗兔IgG和BCA试剂盒购自广州碧云天公司,抗IκBα、抗p-IκBα和NF-κB抗体购自美国AbSci公司,FITC标记山羊抗兔IgG购自沈阳市万类生物科技公司,HRP标记的羊抗兔二抗购自武汉博士德生物工程公司,RPMI 1640培养基购自美国Hy Clone公司,CB-5083购自美国TargetMol公司。CO2培养箱和生物安全柜购自美国Thermo Fisher公司,倒置荧光显微镜购自日本Olympus公司,恒温水溶箱购自上海精宏公司,电泳仪和凝胶成像系统购自美国Bio-Rad公司。
1.3 免疫组织化学染色和评分标准采用免疫组织化学SP法,将石蜡切片烘烤、脱蜡、脱水、抗原修复,3%过氧化氢灭活内源性氧化酶30 min,pH 6.0柠檬酸盐缓冲液进行组织抗原修复20 min,10%正常山羊血清室温封闭1 h,加入抗VCP抗体工作液(1:150稀释)湿盒中4℃过夜。次日37℃复温1 h,滴加山羊抗兔IgG置于37℃孵育1 h。DAB染色剂染色1 min,三蒸水洗涤,苏木素复染,脱水、透明、封片,镜检评分。VCP免疫组织化学阳性染色为棕黄色颗粒,主要分布于细胞质,少量分布于细胞核。免疫组织化学评分标准:显微镜下每个研究病例随机观察5个400倍放大的视野,每次随机观察其中的100个细胞,着色细胞百分比 < 5%为0分,5%≤着色细胞百分比 < 25%为1分,25%≤着色细胞百分比<50%为2分,着色细胞百分比≥50%为3分;胞质基本不着色为0分,染成淡黄色为1分,染成棕黄色为2分,染成棕褐色为3分。将上述2项得分的乘积作为综合得分,将免疫组织化学染色结果得分≥4分作为阳性表达。计算VCP阳性表达率并比较不同临床病理特征EOC患者肿瘤组织中VCP阳性表达率。
1.4 细胞划痕实验检测2组细胞迁移率实验分成2组,经CB-5083处理的SKOV-3细胞作为处理组,未经CB-5083处理的SKOV-3细胞作为对照组。将SKOV-3细胞采用CB-5083处理24 h后接种于6孔细胞培养板中,待细胞贴壁后将对照组和处理组细胞培养基更换为无血清培养基并加入1 mg·L-1丝裂霉素C处理1 h,防止细胞增殖导致的假阳性结果。采用200 μL枪头垂直于板底划出人工划痕,分别于0、12和24 h在显微镜下观察划痕愈合情况并拍照。细胞迁移率=(0 h边缘距离-12 h或24 h边缘距离)/0 h边缘距离×100%。
1.5 平板克隆实验检测2组细胞克隆形成率实验分成2组,经CB-5083处理的SKOV-3细胞作为处理组,未经CB-5083处理的SKOV-3细胞作为对照组。将SKOV-3细胞用CB-5083处理24 h后以每孔1 000个细胞的密度接种于6孔细胞培养板中培养。每隔3 d换液1次,肉眼观察出现集落(约15d)后终止培养。PBS反复清洗3次,以4%多聚甲醛固定15 min,0.1%结晶紫染色。自然晾干后拍照,记录形成集落数量。细胞克隆形成率=细胞克隆数/接种细胞数×100%。
1.6 免疫荧光法检测SKOV-3细胞和HOSEpiC细胞中VCP蛋白表达以及处理组和对照组SKOV-3细胞中VCP表达细胞爬片,以4%多聚甲醛固定15 min;0.1% Triton X-100打孔15 min;山羊血清封闭液封闭30 min;加入VCP抗体(稀释比例1:100)放入湿盒内并转移至4℃过夜;滴加荧光二抗(以下操作注意避光);DAPI染核10 min;滴加抗荧光淬灭剂暗室内用荧光显微镜观察染色效果并拍照。染色结果判定标准:于带有摄影器材的倒置荧光显微镜下观察染色结果,FITC散发荧光为绿色,Cy3散发荧光为红色,在普通光下选择细胞分布均匀的部位观察,每张爬片随机选取10个高倍(放大200倍)视野,于荧光显微镜下观察并记录细胞荧光强度,并排除非特异性荧光,快速观察以免荧光淬灭。定性判断标准:(-)代表无荧光;(±)代表荧光极弱;(+)代表荧光不强但清楚可见;(╫)代表荧光较为明亮;(⧻~⧺⧺)代表荧光极为明亮。
1.7 Western blotting法检测SKOV-3细胞和HOSEpiC细胞中VCP、NF-κB/P65、IκBα及p-IκBα蛋白表达水平采用BCA法检测SKOV-3细胞中VCP、NF-κB/P65、IκBα及p-IκBα蛋白表达水平, 计算上样体积。电泳, 转膜, 封闭1 h, 一抗4℃孵育过夜, TBST洗膜3次, 二抗室温孵育1 h, TBST洗膜3次, ECL显影。凝胶成像仪获取图像, 实验均重复3次。
1.8 统计学分析采用SPSS 21.0统计软件进行统计学分析。2组细胞迁移率和克隆形成率及细胞中VCP、NF-κB/P65、IκBα及p-IκBα蛋白表达水平以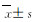
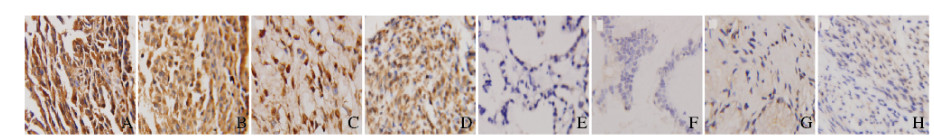
VCP蛋白在正常卵巢上皮、良性卵巢肿瘤、交界性卵巢肿瘤和EOC组织中均有表达,其主要表达于细胞质, 少量表达于细胞核(图 1,见封三)。4种组织中VCP阳性表达率逐渐升高,分别为25.0%(2/8)、41.7%(15/36)、61.5%(8/13)和73.4%(69/94),VCP阳性表达率组间比较差异有统计学意义(χ2=15.839, P<0.05)。将EOC分别与其他3种组织进行比较,采用Bonferroni法调整α水平,结果显示:EOC与交界性卵巢肿瘤和EOC与正常卵巢组织中VCP阳性表达率比较差异有统计学意义(P<0.01),EOC与交界性卵巢肿瘤组织中VCP阳性表达率比较差异无统计学意义(P>0.01)。
|
| A-D: Positive expression; E-H:Negative expression; A, E:Ovarian cancer tissue; B, F:Borderline ovarian tumor tissue; C, G:Benign ovarian tumor tissue; D, H:Normal ovarian tissue 图 1 4种卵巢组织中VCP表达情况(SP,×400) Fig. 1 Expressions of VCP in four kinds of ovarian tissues (SP, ×400) |
|
|
卵巢癌FIGO分期为晚期者(Ⅲ-Ⅳ期)、低分化者及淋巴结转移者肿瘤组织中VCP阳性表达率高于卵巢癌FIGO分期为早期者(Ⅰ-Ⅱ期)、中分化者、高分化者和无淋巴结转移者。VCP表达与患者的病理类型、年龄、是否有腹水和术前血清CA125水平无关联。不同临床病理特征EOC患者肿瘤组织中VCP表达见表 1。
| Pathological parameter | n | Positive expression rate of VCP [n(η/%)] | P | |
| + | - | |||
| Age(year) | ||||
| ≤50 >50 |
32 62 |
23(71.9) 46(74.2) |
9(28.1) 16(25.8) |
0.809 |
| Pathological type | ||||
| Serous Mucinous Endometrioid Clear cell | 46 14 20 14 | 33(71.7) 10(71.4) 14(70.0) 12(85.7) | 13(28.3) 4(28.6) 6(30.0) 2(14.3) | 0.753 |
| Histological differentiation | ||||
| Low | 44 | 37(84.1) | 7(15.9) | 0.027 |
| Middle | 34 | 24(70.6) | 10(29.4) | |
| High | 16 | 8(50.0) | 8(50.0) | |
| FIGO staging | ||||
| Early(Ⅰ-Ⅱ) Late(Ⅲ-Ⅳ) |
35 59 |
20(57.1) 49(83.1) |
15(42.9) 10(16.9) |
0.006 |
| Lymphatic metastasis | ||||
| + - |
57 37 |
46(80.7) 23(62.2) |
11(19.3) 14(37.8) |
0.047 |
| Ascites | ||||
| + - |
55 39 |
44(80.0) 25(64.1) |
11(20.0) 14(35.9) |
0.086 |
| CA125(U·mL-1) | ||||
| ≤35 | 36 | 23(63.9) | 13(36.1) | 0.100 |
| >35 | 58 | 46(79.3) | 12(20.7) | |
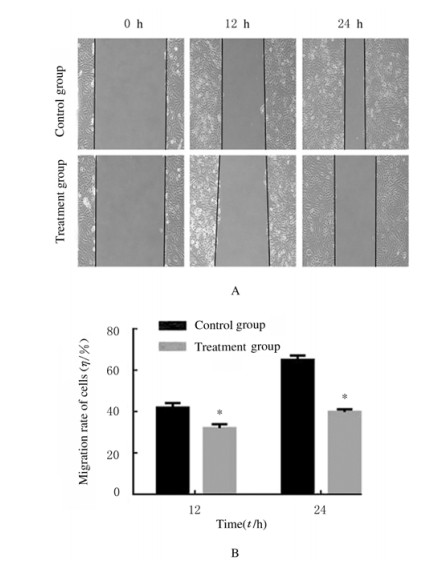
应用划痕实验分析SKOV-3细胞的迁移率,结果显示:处理组SKOV-3细胞迁移率明显低于对照组(P < 0.05),提示VCP促进SKOV-3细胞迁移。见图 2。
|
| A:Migration morphology; B:Histogram of migration rate(*P < 0.05 vs control group). 图 2 不同时间点2组SKOV-3细胞迁移情况 Fig. 2 Migration of SKOV-3cells in two groups at different time points |
|
|
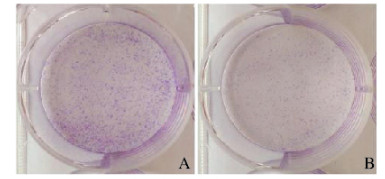
应用平板克隆实验分析SKOV-3细胞的增殖能力,结果显示:处理组SKOV-3细胞克隆形成率(52.70%±3.64%)明显低于对照组(68.80%±3.37%)(P < 0.05),提示VCP促进SKOV-3细胞增殖。见图 3(封三)。
|
| A:Control group; B:Treatment group 图 3 2组细胞克隆形态表现 Fig. 3 Cloning morphology of cells in two groups |
|
|
VCP主要分布于细胞质,少量分布于细胞核。在SKOV-3细胞中荧光极弱(±),在HOSEpiC细胞中荧光较为明亮(⧺),在SKOV-3细胞中VCP表达明显多于HOSEpiC细胞(图 4,见封三),Westen blotting法检测结果显示:HOSEpiC细胞中VCP表达水平为0.493±0.680,SKOV-3细胞中VCP表达水平为0.980±0.034,两者比较差异有统计学意义(P < 0.05)。见图 5。
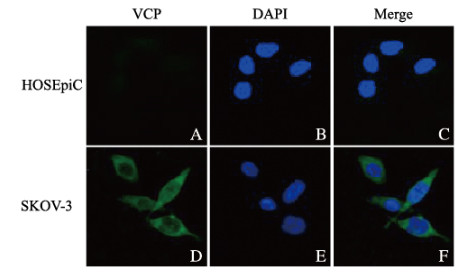
|
| 图 4 SKOV-3和HOSEpiC细胞中VCP表达(免疫荧光,×200) Fig. 4 Expressions of VCP in SKOV-3 and HOSEpiC cells(Immunofluorescence, ×200) |
|
|

|
| Lane 1:HOSEpiC cells; Lane 2:SKOV-3 cells. 图 5 Western blotting法检测SKOV-3和HOSEpiC细胞中VCP表达电泳图 Fig. 5 Electrophoregram of expression of VCP in SKOV-3 and HOSEpiC cells detected by Western blotting method |
|
|
对照组SKOV-3细胞中VCP荧光较为明亮(⧺),处理组SKOV-3细胞中VCP荧光清晰可见但较弱(+),处理组SKOV-3细胞中VCP荧光强度明显低于对照组。见图 6(封三)。
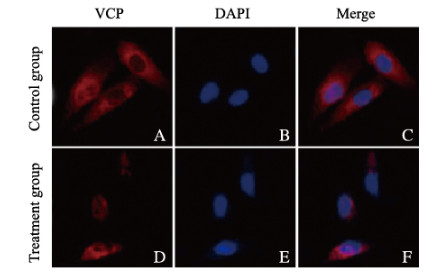
|
| 图 6 2组SKOV-3细胞中VCP表达(免疫荧光,×200) Fig. 6 Expressions of VCP in SKOV-3 cells in two groups(Immunofluorescence, ×200) |
|
|
Western blotting检测结果显示:处理24 h后,以GAPDH蛋白作为内参,与对照组比较,处理组SKOV-3细胞中VCP蛋白表达水平降低26.39%、NF-κB/P65蛋白表达水平降低56.60%,p-IκBα蛋白表达水平升高62.36%,处理组和对照组SKOV-3细胞中VCP、NF-κB/P65和IκB-α蛋白表达水平比较差异有统计学意义(P<0.05)。处理组和对照组SKOV-3细胞中p-IκBα蛋白表达水平比较差异无统计学意义(P>0.05)。见图 7。
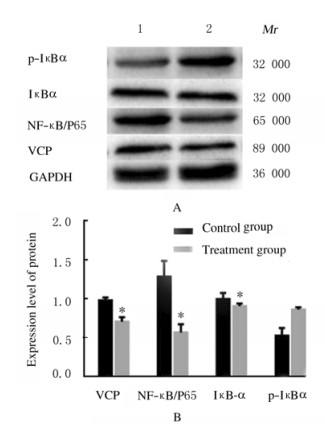
|
| A:Electrophoregram(Lane 1:Control group; Lane 2:Treatment group); B:Histogram(*P < 0.05 vs control group). 图 7 2组SKOV-3细胞中VCP、NF-κB/P65、IκB-α和p-IκBα蛋白表达情况 Fig. 7 Expressions of VCP, NF-κB/P65, IκBα, and p-IκBα proteins in SKOV-3 cells in two groups |
|
|
VCP属于参与多种细胞活动的ATP酶家族中的一员,其在泛素依赖性蛋白酶体降解途径中起关键作用[1]。ASAI等[8]研究发现:转染VCP基因的鼠骨肉瘤细胞系中,当肿瘤坏死因子α刺激时表现出持续活化的NF-κB,迅速降解p-IκBα,而降低细胞凋亡率,增加转移潜能。研究表明:VCP在许多肿瘤组织中呈过表达状态,包括前列腺癌[3]、骨肉瘤[4]和肝癌[9]。也有研究[10-11]表明:VCP表达可能是非小细胞肺癌患者总体生存率的独立预后因素。ZHU等[12]发现:VCP表达与眼眶原发性黏膜相关淋巴组织淋巴瘤(mucosa-associated lymphoid tissue lymphoma, MALT)相关, VCP高表达与肿瘤复发、肿瘤体积增大和生存期缩短呈显著相关关系。MEYER等[13]发现:经手术治疗的人乳头瘤病毒(human papillomavirus,HPV)阴性口咽鳞状细胞癌患者中,VCP表达可作为HPV阴性口咽鳞状细胞癌的预后标志物。LUO等[14]发现:在接受放疗的局部晚期食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)患者中, VCP可作为一项总体生存预后指标。VCP抑制剂与放射治疗相结合可作为有效治疗ESCC的方法。ZHU等[15]发现:VCP表达水平与眼眶B细胞淋巴瘤的分期、肿瘤分级和复发率有关。VCP表达水平越低,患者生存期越长。MOHAMMED等[2]发现:VCP的免疫组织化学结果对CIN2/CIN3+的诊断敏感度为93.0%、特异度为88.0%,可作为宫颈癌筛查的重要生物标志物。目前,VCP在EOC中的表达情况及其在卵巢癌发生发展过程中的作用尚不清楚。因此,研究VCP在EOC中的表达情况以及VCP如何调控SKOV-3细胞的迁移和增殖十分必要。
本研究采用免疫组织化学法检测94例EOC、13例交界性卵巢肿瘤、36例良性卵巢肿瘤和8例正常卵巢组织中VCP表达情况,结果显示:VCP在EOC组织中呈高表达,不同临床病理特征EOC患者肿瘤组织中VCP表达水平不同,VCP的表达与患者FIGO分期、肿瘤分化程度和淋巴结转移有关联。因此VCP可能是判断EOC患者严重程度的一个潜在指标。
为了研究VCP在EOC发生发展中的作用,本课题组采用VCP抑制剂CB-5083作用于SKOV-3细胞。CB5083是一种有效、选择性、可口服的VCP生物可利用抑制剂[6]。划痕实验和平板克隆形成实验表明:抑制VCP可抑制SKOV-3细胞的增殖和迁移。上述研究结果提示:VCP在EOC的肿瘤发生调控中起重要作用,与VALLE等[11]的研究结果一致。NF-κB是一种广泛分布于真核细胞中的转录因子,参与多种基因转录,在肿瘤抗凋亡过程中发挥至关重要的作用。NF-κB通过激活cyclinD1转录,调控细胞周期,促进细胞增殖;通过调节抗凋亡B细胞淋巴瘤XL基因(B-cell lymphomaXL,Bcl-XL)和B细胞淋巴瘤2基因(B-cell lymphoma-2,Bcl-2)等的转录,抑制细胞凋亡;通过调控细胞间黏附分子1(intercellular cell adhesion molecule-1, CAM-1)和基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9)等的表达,促进细胞浸润和转移。目前已经在肝癌[16]、宫颈癌[17]和乳腺癌[18]等多种恶性肿瘤中检测到异常活化的NF-κB。有研究[19]表明:VCP能促进Cullin戒指泛素连接酶/依赖蛋白酶体降解IκBα,进而激活NF-κB信号通路。目前研究者[4, 8]认为:VCP在大多数恶性肿瘤中是通过NF-κB通路发挥作用,但是关于其在EOC中作用机制研究较少,为了进一步探讨VCP在EOC发生过程中的作用机制,本研究应用VCP抑制剂CB-5083处理SKOV-3细胞,采用Western blotting技术分析VCP与EOC发生相关蛋白表达水平,结果显示:当抑制VCP时,NF-κB/P65表达水平降低,IκBα表达水平无明显变化,而p-IκBα表达水平升高,可见VCP是通过降解p-IκBα而激活NF-κB通路参与卵巢癌的发生发展,本研究结果同刘钧等[20]和ASAIT等[8]的研究结果一致。
综上所述,VCP在EOC组织和细胞系中呈高表达,可促进EOC的迁移和增殖;抑制VCP表达后可以通过下调NF-κB信号通路来抑制SKOV-3细胞的迁移和增殖,其可能成为卵巢癌治疗的靶点。
| [1] |
NGUYEN Q T, CHOI J, YANG J K, et al. Ufd1 phosphorylation at serine 229 negatively regulates endoplasmic reticulum-associated degradation by inhibiting the interaction of Ufd1 with VCP[J]. Biochem J, 2019, 476(18): 2561-2577. DOI:10.1042/BCJ20190254 |
| [2] |
MOHAMMED S I, REN W, FLOWERS L, et al. Point-of-care test for cervical cancer in LMICs[J]. Oncotarget, 2016, 7(14): 18787-18797. DOI:10.18632/oncotarget.7709 |
| [3] |
TSUJIMOTO Y, TOMITA Y, HOSHIDA Y, et al. Elevated Expression of valosin-containing protein (p97) is associated with poor prognosis of prostate cancer[J]. Clin Cancer Res, 2004, 10(9): 3007-3012. DOI:10.1158/1078-0432.CCR-03-0191 |
| [4] |
LONG X H, ZHANG Z H, LIU Z L, et al. Inhibiting valosin-containing protein suppresses osteosarcoma cell metastasis via AKT/nuclear factor of kappa B signaling pathway in vitro[J]. Indian J of Pathol Microbiol, 2013, 56(3): 190-195. DOI:10.4103/0377-4929.120358 |
| [5] |
BRANDMAN O, HEGDE R S. Ribosome-associated protein quality control[J]. Nat Struct Mol Biol, 2016, 23(1): 7-15. |
| [6] |
ANDERSON D J, LEMOIGNE R, DIAKOVIC S, et al. Targeting the AAA ATPase p97 as an approach to treat cancer through disruption of protein homeostasis[J]. Cancer Cell, 2015, 28(5): 653-665. DOI:10.1016/j.ccell.2015.10.002 |
| [7] |
ZHOU H J, WANG J H, YAO B, et al. Discovery of a first-in-class, potent, selective, and orally bioavailable inhibitor of the p97 AAA ATPase (CB-5083)[J]. J Med Chem, 2015, 58(24): 9480-9497. DOI:10.1021/acs.jmedchem.5b01346 |
| [8] |
ASAI T, TOMITA Y, NAKATSUKA S, et al. VCP (p97) regulates NFκB signaling pathway, which is important for metastasis of osteosarcoma cell line[J]. Jpn J Cancer Res, 2002, 93(3): 296-304. DOI:10.1111/j.1349-7006.2002.tb02172.x |
| [9] |
YU L, YAN H, QING M S, et al. VCP/P97, down-regulated by microRNA- 129-5p, could regulate the progression of hepatocellular carcinoma[J]. PLoS One, 2012, 7(4): 35800-35808. DOI:10.1371/journal.pone.0035800 |
| [10] |
QIU Y, MORII E, TOMITA Y, et al. Prognostic significance of pre B cell leukemia transcription factor 2(PBX2) expression in non-small cell lung carcinoma[J]. Cancer Sci, 2009, 100(7): 1198-1209. DOI:10.1111/j.1349-7006.2009.01156.x |
| [11] |
VALLE C W, MIN T, BODAS M, et al. Critical role of VCP/P97 in the pathogenesis and progression of non-small cell lung carcinoma[J]. PLoS One, 2011, 6(12): e29073. DOI:10.1371/journal.pone.0029073 |
| [12] |
ZHU W W, KANG L, GAO Y P, et al. Expression level of valosin containing protein is associated with prognosis of primary orbital MALT lymphoma[J]. Asian Pac J Cancer Prev, 2013, 14(11): 6439-6443. DOI:10.7314/APJCP.2013.14.11.6439 |
| [13] |
MEYER M F, SEUTHE I M C, DREBBER U, et al. Valosin-containing protein (VCP/P97)expression correlates with prognosis of HPV-negative oropharyngeal squamous cell carcinoma (OSCC)[J]. PLoS One, 2014, 9(12): e114170. DOI:10.1371/journal.pone.0114170 |
| [14] |
LUO H, SONG H, MAO R, et al. Targeting valosin containing protein enhances the efficacy of radiation therapy in esophageal squamous cell carcinoma[J]. Cancer Sci, 2019, 110(11): 3464-3475. DOI:10.1111/cas.14184 |
| [15] |
ZHU W, LI D, XIAO L. Upregulation of valosin-containing protein (VCP) is associated with poor prognosis and promotes tumor progression of orbital B-cell lymphoma[J]. Onco Targets Ther, 2019, 12: 243-253. |
| [16] |
LI W, TAN D F, ZENELI M J, et al. Constitutive activation of nuclear factor-kappa B (NF-κB) signaling pathway in fibrolamellar hepatocellular carcinoma[J]. Int J Clin Exp Pathol, 2010, 3(3): 238-243. |
| [17] |
XIA L, XUE X Z. Immunohistochemical study of NF-κB/P65, c-IAP2 and caspase-3 expression in cervical cancer[J]. Oncol Lett, 2012, 3(4): 839-844. |
| [18] |
MENG L L, WANG J L, XU S P, et al. Low serum gastrin associated with ER+ breast cancer development via inactivation of CCKBR/ERK/P65 signaling[J]. BMC Cancer, 2018, 18(1): 824-837. DOI:10.1186/s12885-018-4717-7 |
| [19] |
KATRIN S, ALEXANDER P, MICHAEL N. p97/VCP promotes Cullin- RING- ubiquitin-ligase/proteasome-dependent degradation of IκBα and the preceding liberation of RelA from ubiquitinated IκBα[J]. J Cell Mol Med, 2016, 20(1): 58-70. |
| [20] |
刘钧, 李天虚, 焦伯延. VCP通过促进Huh7肝癌细胞P-IκB的降解激活NF-κB[J]. 中国卫生检验杂志, 2015, 25(6): 863-865. |
 2020, Vol. 46
2020, Vol. 46


