扩展功能
文章信息
- 翟云, 王雅菲, 托娅
- ZHAI Yun, WANG Yafei, TUO Ya
- 乳双歧杆菌M8对免疫抑制模型大鼠免疫功能的影响
- Effect of Bifidobacterium lactis M8 on immune function of immunosuppressive model rats
- 吉林大学学报(医学版), 2020, 46(03): 582-588
- Journal of Jilin University (Medicine Edition), 2020, 46(03): 582-588
- 10.13481/j.1671-587x.20200325
-
文章历史
- 收稿日期: 2019-06-13
益生菌是指当机体摄入足够剂量时能够对自身产生有益作用的活的微生物[1],如乳杆菌、双歧杆菌和乳酸菌等有益于肠道健康的细菌。益生菌对机体的有益作用主要是通过刺激宿主的免疫系统,增强机体对刺激的免疫应答反应实现的[2]。目前国内外研究的大多数益生菌来自乳杆菌属和双歧杆菌属,其是肠道内正常微生区系中的重要成员并与宿主终身相伴。乳双歧杆菌M8能耐受消化道中温度和酸碱度的变化,最终以活菌状态进入人体肠道。目前尚缺乏关于该菌的研究报告,本研究通过对免疫抑制大鼠模型灌服乳双歧杆菌M8探讨其对宿主特异性免疫和非特异性免疫应答的调控作用。
1 材料与方法 1.1 实验菌种本研究选取的乳双歧杆菌M8菌株为内蒙古农业大学乳品生物技术与工程教育部重点实验室于2017年分离自健康产妇母乳的1株新型乳双歧杆菌。将乳双歧杆菌M8菌粉按用量分装保存于-20℃冰箱备用,使用时将不同剂量菌粉混悬于2 mL 0.9%的无菌NaCl2溶液中,配制成体积一定的新鲜菌悬液灌胃。
1.2 实验动物、主要试剂和仪器SPF清洁级Wistar大鼠50只,雌雄各半,体质量(180±20) g,购自内蒙古大学实验动物研究中心,动物使用许可证号:SCXK(蒙)2016-0001。注射用环磷酰胺干粉(江苏盛迪医药有限公司),10%水合氯醛(北京酷来博科技有限公司),溶血素(美国BD公司),大鼠荧光单抗CD3-FITC、CD4-APC-Cy7、CD8-PerCP、CD161-PE和CD45RA-APC(美国Biolegent公司),0.4%台盼蓝染色液和大鼠淋巴细胞分离液(天津市灏洋生物制品科技有限责任公司),白细胞计数液(北京索莱宝科技有限公司),大鼠免疫球蛋白G(immunoglobulin G,IgG,编号CK-EN30626)、免疫球蛋白A(immunoglobulin A,IgA,编号CK-EN30624)、干扰素γ(interferon-gamma,INF-γ,编号CK-EN30173)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α,编号CK-EN31063)、白细胞介素2(interleukin-2,IL-2,编号CK-EN30208)和白细胞介素6(interleukin-6,IL-6,编号CK-EN30219)购自泉州市睿信生物科技有限公司,RPMI-1640(美国Gibco公司),优级胎牛血清(北京政博伟业生物科技有限公司),CCK-8试剂(日本同仁化学研究所),刀豆蛋白A(concanavalin A, ConA,25mg/支)(北京酷来博科技有限公司)。Multiskan GO全波长酶标仪和恒温培养箱(美国Thermo Scientific公司),超净工作台(江苏AIRTECH空气技术有限公司),全自动高压灭菌锅(北京世贸远东科学仪器有限公司),电子秤[赛多利斯科学仪器(北京)有限公司],数码显微镜(DFC450C,德国徕卡公司),流式细胞分析仪(FACSCanto Ⅱ,美国BD公司),大鼠灌胃器、一次性注射器和无菌负压采血管(山东奥赛特医疗器械有限公司),改良血细胞计数板(上海市求精生化试剂仪器有限公司)。
1.3 实验动物分组和饲喂方式实验动物适应性饲喂乳双歧杆菌M8(0.01×108 cfu·d-1)6 d,自由饮水、进食。将50只SPF清洁级大鼠随机分为空白对照组、模型对照组、低剂量乳双歧杆菌M8组、中剂量乳双歧杆菌M8组和高剂量乳双歧杆菌M8组,每组10只,低剂量乳双歧杆菌M8组每只大鼠给予0.01g乳双歧杆菌M8(1×108cfu·d-1),中剂量乳双歧杆菌M8组每只大鼠给予0.10 g乳双歧杆菌M8(1×109cfu·d-1),高剂量乳双歧杆菌M8组大鼠每只给予1.00 g乳双歧杆菌M8(1×1010cfu·d-1),分别采用2 mL无菌生理盐水充分混悬菌液,空白对照组和模型对照组大鼠灌服等体积无菌生理盐水,连续灌服15 d,期间自由饮食。
1.4 实验动物模型制备除空白对照组外,其余4组大鼠每日肌注40 mg·kg-1环磷酰胺(cyclophosphamide,CTX)连续3 d,建立免疫功能低下模型。环磷酰胺注射3 d后大鼠出现皮毛蓬乱、光泽暗淡、发黄、少活动、精神淡漠和体质量减轻等体征,外周血白细胞计数降低,说明CTX造成大鼠免疫功能受到明显抑制, 可确认成功建立免疫抑制大鼠模型[3]。
1.5 各组大鼠全血淋巴细胞亚群百分比检测各组大鼠取100 μL新鲜EDTA-K2抗凝全血加入上机管底部,分别加入大鼠CD3-FITC、CD4-APC-Cy7、CD8-PerCP、CD161-PE和CD45RA-APC荧光单抗各1 μL,震荡混匀,室温下避光孵育20 min,加入10×稀释的溶血素1 mL,震荡混匀,室温避光放置20 min,1 500 r·min-1离心5 min,小心弃去上清,采用2 mL无菌生理盐水洗涤细胞2次,采用500 μL无菌生理盐水重新悬浮细胞,采用流式细胞术检测各组大鼠全血淋巴细胞亚群百分比。
1.6 CCK-8法检测各组大鼠T淋巴细胞转化增殖活性首先取肝素抗凝血2 mL按体积比为1:1的比例与样本稀释液混匀。取1支15 mL无菌离心管,先加入4 mL淋巴细胞分离液,采用移液器吸取稀释后的血液样本缓慢加于分离液液面上,2 200 r·min-1离心20 min。小心吸取第二层乳白色细胞层放入另一支新的15 mL无菌离心管中,向离心管中加入10 mL细胞清洗液,混匀细胞,1 700 r·min-1离心10 min。弃去上清,加入5 mL清洗液重悬所得细胞,1 700 r·min-1离心10 min。弃去上清,再加入5 mL细胞清洗液重新悬浮所得细胞,1 700 r·min-1离心10 min,弃上清后加入2 mL的10%RPMI-1640重悬细胞,0.4%台盼蓝染色,计数活细胞>95%,调整细胞浓度为1×107 mL-1。
淋巴细胞增殖反应:在96孔培养板上设置空白对照组、阴性对照组和实验组,每组设6个复孔。空白对照组加入200 μL的10%RPMI-1640液,阴性对照组加入100 μL的10% RPMI-1640和100 μL细胞悬液,实验组加入100 μLConA(浓度为10 mg·L-1)和100 μL细胞悬液。置于5% CO2培养箱37℃培养48 h,每孔加入10 μL CCK-8试剂,继续培养2 h,显色后置于酶标仪450 nm波长处检测吸光度(A)值,计算淋巴细胞转化增殖活性。淋巴细胞转化增殖活性=实验组A值-空白调零组A值。
1.7 ELISA法检测各组大鼠血清IgA、IgG、IL-2、IL-6、IFN-γ和TNF-α水平末次灌胃之后第2天,采用10%水合氯醛按0.3 mL·100 g-1腹腔注射麻醉大鼠,经心脏采血置于促凝管,3 500 r·min-1离心10 min,取血清分装于离心管中,-80℃低温冰箱中保存待测。分别采用大鼠IgA、IgG、IL-2、IL-6、IFN-γ和TNF-α试剂盒检测,具体操作步骤按说明书完成。ELISA法操作步骤:①从4℃冰箱取出试剂盒室温放置20 min,取出所需的板条,设标准品孔和样本孔;②建立标准曲线:设标准孔6孔,每孔中按不同浓度从小到大依次加入各浓度的标准品50 μL;③加样:样本孔依次加入10 μL样本和40 μL样本稀释液;④分别向标准品孔、样本孔加辣根过氧化物酶(HRP)标记的检测抗体100 μL,用封板膜封住反应孔,轻微震荡混匀;⑤37℃恒温水浴锅避光温育60 min;⑥洗板:甩去液体,吸水纸上反复拍干,每孔加满稀释20倍的洗涤液,静置1 min后再拍干,如此反复洗板5次;⑦每孔分别加入底物A和B各50 μL,37℃避光孵育15 min;⑧每孔加入终止液50 μL;⑨15 min内,在酶标仪450 nm波长处测定各孔A值。结果判定:①最终A值=加样孔A值-空白孔A值;②以标准品按各浓度所对应的A值绘制各试剂的标准曲线;③输入待测样本孔A值,在该标准曲线图上计算出相应浓度, 再乘以稀释倍数,作为各组大鼠血清IgA、IgG、IL-2、IL-6、IFN-γ和TNF-α水平。
1.8 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组大鼠全血淋巴细胞亚群百分比、T淋巴细胞转化增殖活性、血清IgA、IgG、IL-2、IL-6、IFN-γ和TNF-α水平均以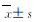
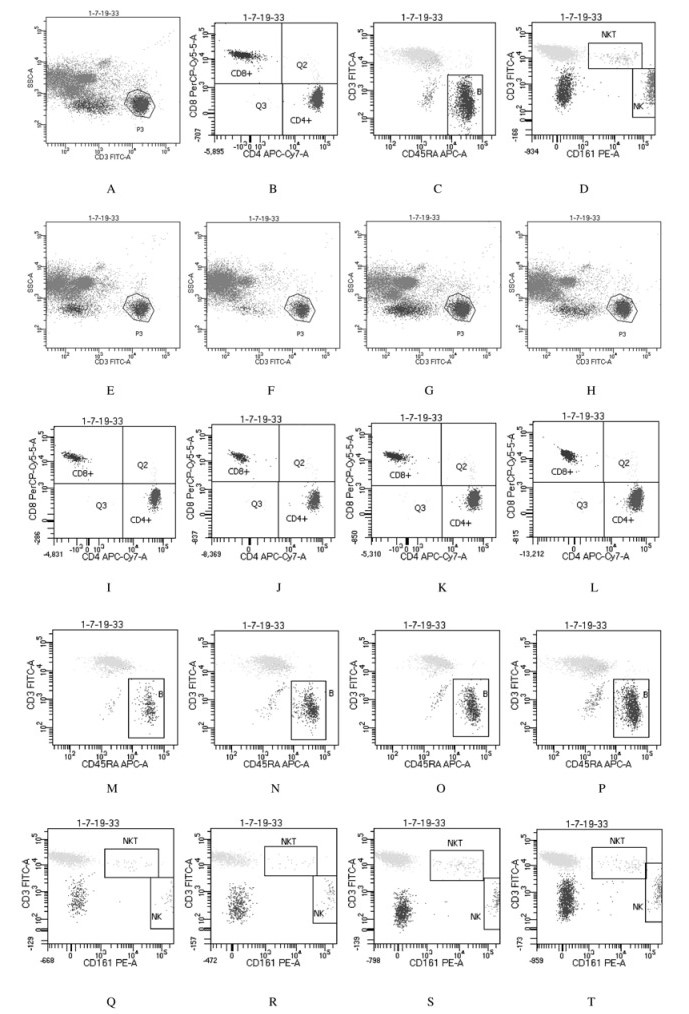
与空白对照组比较,模型对照组大鼠全血CD3+T淋巴细胞、CD4+T淋巴细胞、CD8+T淋巴细胞、B淋巴细胞和NK细胞百分比明显降低(P < 0.05)。与模型对照组比较,高剂量乳双歧杆菌M8组大鼠全血CD3+T淋巴细胞、CD4+T淋巴细胞和CD8+T淋巴细胞百分比明显升高(P < 0.05或P < 0.01),低和中剂量乳双歧杆菌M8组大鼠全血CD3+T淋巴细胞、CD4+T淋巴细胞及CD8+T淋巴细胞百分比有所升高,但组间比较差异无统计学意义(P>0.05)。与模型对照组比较,高剂量乳双歧杆菌M8组大鼠全血B淋巴细胞百分比明显升高(P < 0.01),中剂量乳双歧杆菌M8组大鼠全血B淋巴细胞百分比明显升高(P < 0.05),低剂量乳双歧杆菌M8组大鼠全血B淋巴细胞百分比有所升高,但差异无统计学意义(P>0.05)。与模型对照组比较,高剂量乳双歧杆菌M8组大鼠全血NK细胞百分比明显升高(P < 0.01),低和中剂量乳双歧杆菌M8组大鼠全血NK细胞百分比有所升高,但差异无统计学意义(P>0.05)。见表 1和图 1。
(n=10, 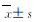 | |||||||||||||||||||||||||||||
| Group | CD3+T lymphocytes | CD4+T lymphocytes | CD8+T lymphocytes | B lymphocytes | NK cells | ||||||||||||||||||||||||
| Blank control | 60.69±4.38 | 48.15±3.81 | 11.03±1.31 | 30.37±5.39 | 10.28±2.8 | ||||||||||||||||||||||||
| Model control | 52.82±5.31* | 40.20±5.22* | 9.41±1.18* | 22.35±3.10* | 5.15±0.87* | ||||||||||||||||||||||||
| Bifidobacterium lactis M8 | |||||||||||||||||||||||||||||
| Low dose | 57.97±4.59 | 42.22±2.68 | 9.73±1.49 | 25.63±6.68 | 5.92±1.56 | ||||||||||||||||||||||||
| Middle dose | 58.85±8.49 | 44.55±4.74 | 10.23±2.29 | 29.35±5.03△ | 6.12±1.71 | ||||||||||||||||||||||||
| High dose | 61.27±4.51△ | 48.28±2.88△△ | 11.45±1.79△ | 31.02±3.72△△ | 7.27±1.36△△ | ||||||||||||||||||||||||
| * P < 0.05 compared with blank control group;△ P < 0.05, △△ P < 0.01 compared with model control group. | |||||||||||||||||||||||||||||
|
| A:CD3+T lymphocytes; B:CD4+T lymphocytes and CD8+T lymphocytes; C:B lymphocytes; D:NK cells; E-H: CD3+T lymphocytes; I-L:CD4+T lymphocytes and CD8+T lymphocytes; M-P:B lymphocytes; Q-T:NK cells; A-D:Blank control group; E, I, M, Q:Model control group; F, J, N, R:Low dose of Bifidobacterium lactis M8 group; G, K, O, S:Middle dose of Bifidobacterium lactis M8 group; H, L, P, T:High dose of Bifidobacterium lactis M8 group. 图 1 流式细胞术检测各组大鼠全血淋巴细胞亚群百分比 Fig. 1 Percentages of lymphocyte subsets in whole blood of rats in various groups detected by flow cytometry |
|
|
与空白对照组比较,模型对照组大鼠淋巴细胞转化增殖活性明显降低(P < 0.01)。与模型对照组比较,中和高剂量乳双歧杆菌M8组大鼠T淋巴细胞转化增殖活性均明显升高(P < 0.01)。见表 2。
(n=10, 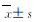 | |||||||||||||||||||||||||||||
| Group | Proliferation activity | ||||||||||||||||||||||||||||
| Bland control | 0.44±0.03 | ||||||||||||||||||||||||||||
| Model control | 0.21±0.03* | ||||||||||||||||||||||||||||
| Bifidobacterium lactis M8 | |||||||||||||||||||||||||||||
| Low dose | 0.30±0.09 | ||||||||||||||||||||||||||||
| Middle dose | 0.31±0.05△ | ||||||||||||||||||||||||||||
| High dose | 0.42±0.06△ | ||||||||||||||||||||||||||||
| * P < 0.01 compared with blank control group;△ P < 0.01 compared with model control group. | |||||||||||||||||||||||||||||
与空白对照组比较,模型对照组大鼠IgA和IgG水平明显降低(P < 0.01)。与模型对照组比较,中和高剂量乳双歧杆菌M8组大鼠血清IgA及IgG水平均明显升高(P < 0.01);低剂量乳双歧杆菌M8组大鼠血清IgA、IgG水平虽然也有所升高,但差异无统计学意义(P>0.05)。与空白对照组比较,模型对照组大鼠血清细胞因子IL-2、IL-6、TNF-α和IFN-γ水平降低(P < 0.01)。与模型对照组比较,中和高剂量乳双歧杆菌M8组大鼠血清IL-2、IL-6、TNF-α和IFN-γ水平明显升高(P < 0.05或P < 0.01),低剂量乳双歧杆菌M8组大鼠血清IL-2和IFN-γ水平升高(P < 0.05)。见表 3。
(n=10, 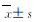 | |||||||||||||||||||||||||||||
| Group | IgA [ρB/(mg·L-1)] | IgG [ρB/(g·L-1)] | IL-2 [ρB/(ng·L-1)] | IL-6 [ρB/(ng·L-1)] | TNF-α [ρB/(ng·L-1)] | IFN-γ [ρB/(ng·L-1)] | |||||||||||||||||||||||
| Blank control | 174±17 | 9.06±1.30 | 1 236±161 | 66.49±6.75 | 212.85±16.00 | 902.74±36.26 | |||||||||||||||||||||||
| Model control | 42±5* | 4.92±0.91* | 765±122* | 39.51±5.33* | 134.31±7.92* | 468.45±46.97* | |||||||||||||||||||||||
| Bifidobacterium lactis M8 | |||||||||||||||||||||||||||||
| Low dose | 75±21△ | 5.95±0.69 | 934±122△ | 45.30±4.69 | 141.10±7.99 | 560.71±65.49△ | |||||||||||||||||||||||
| Middle dose | 126±16△△ | 7.05±0.76△△ | 1 029±108△△ | 49.37±5.99△ | 172.87±9.41△△ | 755.83±41.09△△ | |||||||||||||||||||||||
| High dose | 142±25△△ | 8.22±1.18△△ | 1 166±128△△ | 52.68±5.10△△ | 182.80±11.41△△ | 818.45±64.17△△ | |||||||||||||||||||||||
| * P < 0.01 compared with blank control group;△ P < 0.05, △△ P < 0.01 compared with model control group. | |||||||||||||||||||||||||||||
本实验中益生菌通过灌胃的方式进入大鼠肠道,适应性灌胃6 d使乳双歧杆菌M8适应大鼠肠道微环境,以便在分组灌胃时乳双歧杆菌M8能定植于大鼠肠道内从而发挥其作用。
人体免疫功能是由免疫分子、免疫细胞和免疫器官发挥作用的,机体的细胞免疫主要由T淋巴细胞介导, 而体液免疫由B淋巴细胞介导,非特异性免疫则由NK细胞、单核细胞和巨噬细胞介导。T淋巴细胞作为免疫效应细胞, 在细胞免疫反应中发挥主导作用, CD3+分子是T淋巴细胞表面标志物, 进一步依据T淋巴细胞表面表达的抗原决定簇不同可分为CD4+T淋巴细胞和CD8+T淋巴细胞2个亚群[4],CD4+T淋巴细胞通过分泌细胞因子协助体液免疫和细胞免疫, 可识别外源性抗原肽,活化后分泌的效应细胞主要为Th细胞,Th细胞可分泌不同的细胞因子,促进B淋巴细胞、T淋巴细胞和其他免疫细胞增殖分化,协同免疫细胞间相互作用而发挥细胞免疫、体液免疫及固有免疫应答作用。CD8+T淋巴细胞具有特异性杀伤功效, 可识别内源性抗原肽,活化后分化成为细胞毒性T淋巴细胞,具有细胞毒作用,可杀伤靶细胞[5-6]。B淋巴细胞来源于骨髓多能造血干细胞, 成熟的B淋巴细胞进一步分化为浆细胞从而分泌免疫球蛋白,部分活化的B细胞分化成记忆B淋巴细胞, 在再次免疫应答中发挥重要作用[7],或通过主要组织相容性复合体(major histocompatibility complex,MHC)递呈外源性分子到T淋巴细胞而促进免疫应答反应[8]。NK细胞具有机体免疫监视的重要功能,可以在第一时间发挥免疫应答作用, 处于机体细胞免疫的第一道防线[9]。本实验结果显示:高剂量乳双歧杆菌M8组大鼠全血CD3+T淋巴细胞、CD4+T淋巴细胞、CD8+T淋巴细胞及NK细胞百分比升高。中和高剂量乳双歧杆菌M8组大鼠全血B淋巴细胞百分比升高,提示乳双歧杆菌M8可能通过提高细胞免疫、体液免疫和固有免疫应答作用进而增强机体的免疫调节能力。
T淋巴细胞转化增殖实验是基于淋巴细胞对有丝分裂原的反应性,体外检测淋巴细胞增殖反应性的实验,淋巴细胞转化增殖能力的强弱,在一定程度上可以反映淋巴细胞对外来抗原的刺激反应能力的高低,T淋巴细胞只有向成熟转化,才能发挥免疫效应,ConA可刺激大鼠T淋巴细胞的转化增殖,因此淋巴细胞转化增殖能力可以反映细胞免疫功能[10]。本研究结果显示:乳双歧杆菌M8可以增强免疫抑制模型大鼠的T淋巴细胞转化增殖能力,提高宿主的细胞免疫应答能力。
免疫球蛋白是由B淋巴细胞分泌的具备抗体活性的蛋白分子,在机体内具有补体活化、抗病毒和细胞吞噬等作用, 通常作为监控机体免疫系统功能的重要指标[11-12]。IL-2是T淋巴细胞受抗原刺激后产生的具有免疫调节作用的细胞因子, 可以增强NK细胞活性,促进T和B淋巴细胞的分化增殖, 刺激T和B淋巴细胞分泌多种淋巴因子,诱导产生IFN等[13]。IL-6具有广泛的生物活性,在机体的免疫调节、炎症反应和造血调控等过程中发挥不可替代的作用[14]。IL-6属于Th2型细胞因子,主要是由活化的T细胞和其他免疫细胞分泌[15],可促进B淋巴细胞增殖并分化为浆细胞,进一步分泌特异性免疫球蛋白参与体液免疫[16-17]。因此,可以通过检测宿主血清IL-6水平变化监测机体的免疫功能情况。TNF-α具有多种生物学效应,其通过与受体结合活化相关蛋白,激活多条信号通路,合成新的蛋白质,进而发挥作用[18],即调节机体的免疫功能,且有抗肿瘤功效,并参与炎症病变的过程[19]。TNF-α介导细胞免疫反应,主要通过刺激T淋巴细胞增殖和活化并增强T淋巴细胞的细胞毒活性,发挥免疫作用,在体液免疫反应中可诱导B淋巴细胞产生抗体和细胞因子[20-22]。IFN-γ是Th1细胞具有代表性的细胞因子,能增强吞噬细胞介导的抗感染机制,并且可以促进细胞免疫,在机体细胞免疫中发挥重要作用[23]。本研究结果显示:模型对照组大鼠免疫球蛋白和细胞因子表达均受到抑制,使B淋巴细胞及Th1细胞、Th2细胞产生的IgA、IgG、IL-2和IL-6等细胞因子减少,免疫应答效应减弱。给予乳双歧杆菌M8后,大鼠血清IgA、IgG、IL-2、IL-6、IFN-γ和TNF-α水平升高,说明M8可以通过促进B淋巴细胞、T淋巴细胞分泌免疫球蛋白及Th1细胞、Th2细胞因子从而提高免疫抑制模型大鼠的体液免疫及细胞免疫功能。
综上所述,乳双歧杆菌M8可以提高免疫抑制模型大鼠的淋巴细胞百分比、T淋巴细胞转化增殖能力和提高血清IgA、IgG、IL-2、IL-6、IFN-γ及TNF-α水平,从而改善细胞免疫、体液免疫及固有免疫应答调控,提高模型大鼠的免疫功能。
| [1] |
翟云, 托娅. 益生菌的免疫调节作用及其相关应用研究进展[J]. 中国微生态学杂志, 2018, 30(2): 235-239. |
| [2] |
马晨, 张和平. 益生菌、肠道菌群与人体健康[J]. 科技导报, 2017, 35(21): 14-25. |
| [3] |
董鹏霞, 托娅. 免疫抑制大鼠MRSA定植模型的构建[J]. 检验医学与临床, 2015, 12(7): 880-882. |
| [4] |
LI G, CAO Y, RUN Y, et al. Inhibition of CD8+T cells and elimination of myeloid cells by CD4+Foxp3-T regulatory type 1 cells in acute respiratory distress syndrome[J]. Clin Exp Pharmacol Physiol, 2016, 43(12): 1191-1198. |
| [5] |
雷子颖, 王俞, 罗嘉莉, 等. 胃癌患者外周血T淋巴细胞亚群和NK细胞分析[J]. 消化肿瘤杂志(电子版), 2018, 10(4): 196-199. |
| [6] |
张喜娜.扶正颗粒对免疫低下模型大鼠动脉血淋巴细胞亚群影响的研究[D].杭州: 浙江中医药大学, 2014.
|
| [7] |
张金凤, 夏妍, 张淑云. 抗原提呈细胞的研究进展[J]. 国际检验医学杂志, 2017, 38(19): 2735-2738. |
| [8] |
NUTT S L, KEE B L. The transcriptional regulation of B cell lineage commitment[J]. Immunity, 2007, 26(6): 715-725. |
| [9] |
朱永琴, 任昱, 陈雅琴, 等. 扶正颗粒对免疫低下模型大鼠血淋巴细胞亚群的影响[J]. 浙江中医药大学学报, 2014, 38(10): 1203-1206. |
| [10] |
赵弋清, 罗霞, 陈东辉, 等. 不同剂量环磷酰胺诱导正常小鼠免疫抑制的对比研究[J]. 免疫学杂志, 2005, 21(S): 122-124. |
| [11] |
周彩华, 王献升, 莫伟彬, 等. 益生菌对运动大鼠免疫球蛋白、IL-6、TNF-α含量及HSP70表达的影响[J]. 现代预防医学, 2018, 45(10): 1835-1838. |
| [12] |
刘春红, 王维, 王静, 等. 紫草多糖抑制LPS活化PBMC表达炎症相关因子的基因转录[J]. 中国免疫学杂志, 2011, 27(4): 320-324. |
| [13] |
朱志中, 颜培宇, 唐强. 针刺结合康复训练对免疫抑制大鼠脾脏指数及血清IL-2的影响[J]. 中医药学报, 2010, 38(3): 91-94. |
| [14] |
刘徽, 朱波, 林治华. IL-6信号通路与肿瘤[J]. 细胞与分子免疫学杂志, 2011, 27(3): 353-355. |
| [15] |
陶根金, 向全丹, 余强, 等. 发酵虫草菌对免疫抑制小鼠的免疫调节和抗氧化作用[J]. 南昌大学学报(理科版), 2016, 40(2): 156-160. |
| [16] |
瞿俊勇, 田梦, 贺建华, 等. 白花蛇舌草多糖对免疫抑制小鼠的免疫调节作用研究[J]. 中药材, 2015, 38(9): 1942-1945. |
| [17] |
OHTANI T, NAKAMUEA T, TODA K, et al. Cyclophosphamide enhances TNF alpha-induced apoptotic cell death in murine vascular endothelial cell[J]. FEBS Lett, 2006, 580(6): 1597-1600. |
| [18] |
王文珊, 傅冷西, 叶君健. TNF-α信号传导通路的研究进展[J]. 福建医科大学学报, 2005, 39(S1): 27-31. |
| [19] |
蒋超超, 陈永峰, 黄爱萍. IL-6对再生障碍性贫血骨髓造血的影响[J]. 台州学院学报, 2012, 34(6): 48-52. |
| [20] |
姚甜甜.针灸对CTX小鼠血清IL-6、TNF-α和脾脏组织ACP、LDH含量影响的研究[D].郑州: 河南中医药大学, 2018.
|
| [21] |
EBERT L M, MEUTER S, MOSER B. Homing and function of human skin gammadelta T cells and NK cells:relevance for tumor surveillance[J]. J Immunol, 2006, 176(7): 4331-4336. |
| [22] |
路玫, 王延超, 于冬冬, 等. 针灸对CTX化疗荷瘤小鼠脾脏组织中IL-12和TNF-α含量的影响[J]. 中国针灸, 2015, 35(11): 1145-1148. |
| [23] |
李思敏, 杨静. 高糖环境对小鼠细胞免疫功能的影响[J]. 中西医结合心脑血管病杂志, 2013, 11(8): 973-974. |
 2020, Vol. 46
2020, Vol. 46


