扩展功能
文章信息
- 毕勇志, 马芬, 时俊霞, 宋琳琳, 李林泽
- BI Yongzhi, MA Fen, SHI Junxia, SONG Linlin, LI Linze
- 大黄素对大鼠局灶性脑缺血的保护作用及其机制
- Protective effect of emodin on focal cerebral ischemia in rats and its mechanism
- 吉林大学学报(医学版), 2020, 46(03): 569-574
- Journal of Jilin University (Medicine Edition), 2020, 46(03): 569-574
- 10.13481/j.1671-587x.20200323
-
文章历史
- 收稿日期: 2019-06-05
2. 河南大学第一附属医院检验科, 河南 开封 475000
2. Department of Laboratory, First Affiliated Hospital, Henan University, Kaifeng 475000, China
急性缺血性脑卒中是由于脑动脉闭塞引起缺血和缺氧导致的脑组织坏死软化的疾病,具有高发病率、高致残率和高致死率的特点[1]。急性缺血性脑卒中的发病机制至今尚未完全明确,有研究[2]表明:其发生通常伴随着神经元炎症反应。核转录因子κB(nuclear transcription factor-κB, NF-κB)通路是介导炎症反应的主要通路,研究[3-4]显示:NF-κB p65可以直接诱导各种炎症因子的表达。
大黄素是中药大黄的主要有效成分,可通过血脑屏障,短期内给予大鼠大剂量服用无明显毒性[5]。药理研究[6-7]表明:大黄素具有抗炎作用和神经保护作用。大黄素可与葡萄糖结合为芦荟大黄素-8-0-葡萄糖苷,降低活性氧生成和NF-κB活性,抑制炎性因子的分泌[8]。目前关于大黄素对大鼠脑缺血的保护作用尚未明确,本研究采用大脑中动脉阻断法(middle cerebral artery occlusion, MCAO)建立局灶性脑缺血大鼠模型,探讨大黄素对局灶性脑缺血的保护作用及其对NF-κB信号通路的影响,为研究大黄素对大鼠局灶性脑缺血的保护作用及其机制提供实验依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器60只SPF级SD大鼠,雌性,6月龄,体质量为(220±20)g,购自河南大学医学院实验动物中心,动物使用许可证号:SCXK(豫)2016-0006。实验前适应性饲养1周,实验室温度为(22±3)℃,湿度为(55±5)%。大黄素购自南京泽朗医药科技有限公司(纯度>98%,批号:20180301)。白细胞介素6(interleukin-6, IL-6)、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)和白细胞介素1β(interleukin-1β, IL-1β) ELISA试剂盒购自美国R & D公司,兔抗人NF-κB购自上海捷瑞生物工程有限公司,甘油醛-3-磷酸脱氢酶(GAPDH)基因兔多克隆抗体购自生工生物工程(上海)股份有限公司。MicroTec旋转式切片机(德国甘特工具和机械制造有限公司),AMR-100酶标分析仪(成都昱强科技有限公司),电泳仪(美国Bio-Rad公司)。
1.2 实验动物分组将60只SD大鼠随机分为假手术组,模型组,阳性对照组,低、中和高剂量大黄素组,每组10只。假手术组和模型组大鼠分别给予生理盐水;阳性对照组大鼠给予地塞米松[9](5 mg·kg-1);低、中和高剂量大黄素组大鼠给药剂量按照人与动物体表面积等效剂量计算,按照中国药典规定成人日用量乘以6.3倍,分别灌胃给予10、20和40 mg·kg-1大黄素。各组大鼠造模前3 d开始给药,每天灌胃1次,连续给药3 d后建立MCAO动物模型。
1.3 MCAO动物模型的建立[10]大鼠腹腔注射10%水合氯醛麻醉,剂量为350 mg·kg-1,酒精消毒后,沿颈部中线偏左侧剖开皮肤,钝性分离肌肉,结扎颈外动脉远端处,结扎近心端,结扎颈总动脉远心端,用动脉夹将颈内动脉夹闭,颈外动脉远端结扎处剪断1个“V”型小口,将3.0 mm尼龙丝线插入动脉,沿小口彻底剪断颈外动脉。将颈外动脉残端沿着颈内动脉拉直,缓慢推进丝线,感到阻力时停止,离颈总动脉分叉2 cm处结扎备线。阻塞动脉90 min,缓慢轻柔拉出丝线,再灌注48 h。假手术组大鼠仅进行动脉分离,但不插入丝线。待大鼠苏醒后评估神经功能缺损,大鼠不能伸展右侧前肢、行走时向右转圈或行走时向右侧倾倒视为模型制备成功[11]。
1.4 各组大鼠行为学评分各组大鼠于造模后24 h提尾悬空离地面约40 cm,观察两前肢状态;将大鼠置于水平地面,轻按双肩,观察两侧抵抗力;将大鼠置于地面,观察其行走情况。按照BEDERSON等[12]的方法评分:行为完全正常,0分;提尾悬空时,大鼠手术对侧前肢表现腕肘屈曲、肩内旋、肘外展、紧贴胸壁,计1分;大鼠置于地面,推手术侧肩向对侧移动时阻力降低,计2分;将大鼠放置在地面上,围绕手术对侧转圈计3分;无法自主活动,计4分。分数越高说明大鼠神经行为损伤越严重。
1.5 TTC染色检测各组大鼠脑梗死体积大鼠颈总动脉取血后,断头取脑,沿冠状切成5片,厚度为2 mm,将脑组织切片置于2%TTC染液中37℃避光处理30 min,染色后,玫瑰红色为正常组织,白色为缺血组织。采用计算机Image-Pro Plus软件测量脑梗死面积和切片厚度,计算脑梗死体积,脑梗死体积=梗死区面积/切片厚度,所有切片脑梗死体积之和为脑梗死总体积,计算脑梗死体积百分比。脑梗死体积百分比=脑梗死总体积/大鼠脑组织总体积。
1.6 ELISA法检测各组大鼠缺血侧海马组织中IL-6、IL-1β和TNF-α水平取各组大鼠脑组织,生理盐水冲洗,滤纸吸干,分离缺血侧海马组织,置于玻璃匀浆器,加适量生理盐水配成脑组织匀浆,4 000 r·min-1离心10 min,取上清液,检测各组大鼠缺血侧海马组织中IL-6、IL-1β和TNF-α水平,所有步骤严格按照试剂盒使用说明书操作。
1.7 Western blotting法检测各组大鼠缺血侧海马组织中NF-κB p65和核转录因子κB抑制蛋白α(nuclear transcription factor-κB inhibitor-α, IκBα)表达水平采用RIPA裂解液对各组大鼠缺血侧海马组织进行裂解,12 000 r·min-1提取总蛋白,BCA法测定蛋白浓度,绘制标准曲线计算上样量,取30 μg蛋白样品经12% SDS-PAGE电泳分离,转印,5%脱脂奶粉稀释的NF-κB p65和IκBα抗体置于4℃封闭过夜,5%脱脂奶粉稀释的辣根过氧化物酶(HRP)偶联的二抗(1:3 000)室温孵育2 h,ECL显色,凝胶成像分析系统扫描,以GAPDH作为内参,计算各组大鼠缺血侧海马组织中NF-κB p65和IκBα蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH条带灰度值。
1.8 统计学分析采用SPSS 19.0统计软件进行统计学分析。各组大鼠行为学评分,脑梗死体积百分比,缺血侧海马组织中IL-6、IL-1β和TNF-α水平及NF-κB p65和IκBα蛋白表达水平均呈正态分布,以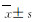
假手术组大鼠未发现神经功能缺损症状,其余各组大鼠均出现神经功能缺损表现,但程度不同。与模型组比较,阳性对照组,中和高剂量大黄素组大鼠行为学评分明显降低(P < 0.05)。与低剂量大黄素组比较,阳性对照组和中及高剂量大黄素组大鼠行为学评分明显降低(P < 0.05)。中和高剂量大黄素组大鼠行为学评分与阳性对照组比较差异无统计学意义(P>0.05)。见表 1。
(n=10, 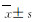 | |||||||||||||||||||||||||||||
| Group | Behavioral score | ||||||||||||||||||||||||||||
| Sham operation | 0 | ||||||||||||||||||||||||||||
| Model | 2.90±0.74 | ||||||||||||||||||||||||||||
| Positive control | 1.60±0.70*△ | ||||||||||||||||||||||||||||
| Emodin | |||||||||||||||||||||||||||||
| Low dose | 2.70±0.67 | ||||||||||||||||||||||||||||
| Medium dose | 1.90±0.74*△ | ||||||||||||||||||||||||||||
| High dose | 1.80±0.79*△ | ||||||||||||||||||||||||||||
| * P < 0.05 vs model group;△ P < 0.05 vs low dose of emodin group. | |||||||||||||||||||||||||||||
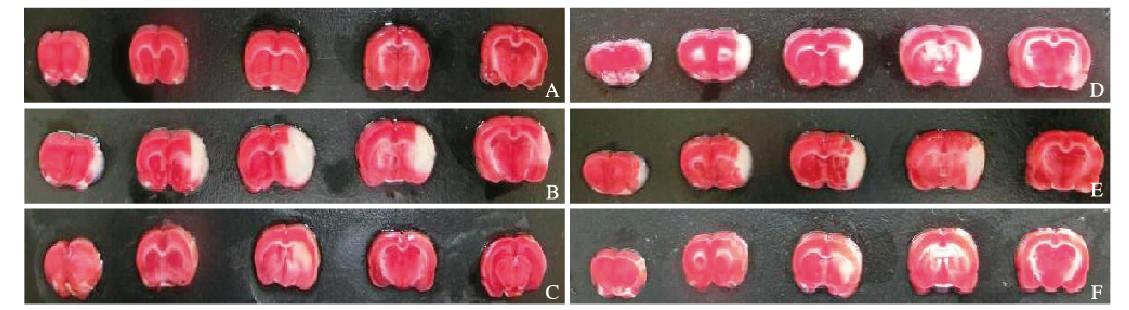
假手术组大鼠脑组织无梗死,其余各组大鼠脑组织均出现不同程度坏死。与模型组比较,阳性对照组和低、中及高剂量大黄素组大鼠脑梗死体积百分比均明显降低(P < 0.05)。与低剂量大黄素组比较,阳性对照组,中和高剂量大黄素组大鼠脑梗死体积百分比明显降低(P < 0.05)。中和高剂量大黄素组大鼠脑梗死体积百分比与阳性对照组比较差异无统计学意义(P>0.05)。见表 2和图 1(插页八)。
(n=10, 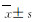 | |||||||||||||||||||||||||||||
| Group | Percentage of cerebral infarction volume | ||||||||||||||||||||||||||||
| Sham operation | 0 | ||||||||||||||||||||||||||||
| Model | 23.40±1.94 | ||||||||||||||||||||||||||||
| Positive control | 11.56±1.39*△ | ||||||||||||||||||||||||||||
| Emodin | |||||||||||||||||||||||||||||
| Low dose | 15.45±1.38* | ||||||||||||||||||||||||||||
| Medium dose | 13.03±1.44*△ | ||||||||||||||||||||||||||||
| High dose | 11.82±1.99*△ | ||||||||||||||||||||||||||||
| * P < 0.05 vs model group;△ P < 0.05 vs low dose of emodin group. | |||||||||||||||||||||||||||||
|
| A:Sham operation group;B:Model group;C:Positive control group;D-F:Low, medium, and high doses of emodin groups 图 1 TTC染色检测观察大鼠脑组织形态表现 Fig. 1 Morphology of brain tissue of rats in various groups observed by TTC staining |
|
|
与假手术组比较,模型组大鼠缺血侧海马组织中IL-6、IL-1β和TNF-α水平明显升高(P < 0.05)。与模型组比较,阳性对照组和低、中及高大黄素剂量组大鼠缺血侧海马组织中IL-6、IL-1β和TNF-α水平明显降低(P < 0.05)。与低剂量大黄素组比较,阳性对照组和中及高剂量大黄素组大鼠缺血侧海马组织中IL-6、IL-1β和TNF-α水平明显降低(P < 0.05)。中和高剂量大黄素组大鼠缺血侧海马组织IL-6、IL-1β和TNF-α水平与阳性对照组比较差异无统计学意义(P>0.05)。见表 3。
[n=10, 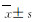 | |||||||||||||||||||||||||||||
| Group | IL-6 | IL-1β | TNF-α | ||||||||||||||||||||||||||
| Sham operation | 1.045±0.245 | 1.562±0.354 | 0.458±0.084 | ||||||||||||||||||||||||||
| Model | 2.872.±0.354* | 2.645±0.403* | 1.256±0.256* | ||||||||||||||||||||||||||
| Positive control | 1.135±0.175△# | 1.306±0.312△# | 0.521±0.102△# | ||||||||||||||||||||||||||
| Emodin | |||||||||||||||||||||||||||||
| Low dose | 1.548±0.206△ | 1.635±0.250△ | 0.727±0.093△# | ||||||||||||||||||||||||||
| Medium dose | 1.280±0.213△# | 1.458±0.231△# | 0.593±0.071△# | ||||||||||||||||||||||||||
| High dose | 1.254±0.134△# | 1.425±0.176△# | 0.584±0.086△# | ||||||||||||||||||||||||||
| * P < 0.05 vs sham operation group;△ P < 0.05 vs model group;# P < 0.05 vs low dose of emodin group. | |||||||||||||||||||||||||||||
与假手术组比较,模型组大鼠缺血侧海马组织中NF-κB p65蛋白表达水平明显升高(P < 0.05),IκBα蛋白表达水平明显降低(P < 0.05)。与模型组比较,阳性对照组和低、中及高剂量大黄素组大鼠缺血侧海马组织中NF-κB p65蛋白表达水平明显降低(P < 0.05),IκBα蛋白表达水平明显升高(P < 0.05)。与阳性对照组比较,低、中和高剂量大黄素组大鼠缺血侧海马组织中NF-κB p65蛋白表达水平明显升高(P < 0.05),IκBα蛋白表达水平明显降低(P < 0.05)。与低剂量大黄素组比较,中和高剂量大黄素组大鼠缺血侧海马组织中NF-κB p65蛋白表达水平明显降低(P < 0.05),IκBα蛋白表达水平明显升高(P < 0.05)。见表 4和图 2。
(n=10, 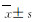 | |||||||||||||||||||||||||||||
| Group | NF-κB p65 | IκBα protein | |||||||||||||||||||||||||||
| Sham operation | 0.753±0.032 | 0.653±0.021 | |||||||||||||||||||||||||||
| Model | 1.310±0.025* | 0.165±0.023* | |||||||||||||||||||||||||||
| Positive control | 0.944±0.024△ | 0.473±0.031△ | |||||||||||||||||||||||||||
| Emodin | |||||||||||||||||||||||||||||
| Low dose | 1.215±0.027△# | 0.307±0.033△# | |||||||||||||||||||||||||||
| Medium dose | 1.136±0.020△#○ | 0.394±0.040△#○ | |||||||||||||||||||||||||||
| High dose | 1.082±0.025△#○ | 0.420±0.035△#○ | |||||||||||||||||||||||||||
| * P < 0.05 vs sham operation group;△ P < 0.05 vs model group;# P < 0.05 vs positive control group; ○ P < 0.05 vs low dose of emodin group. | |||||||||||||||||||||||||||||
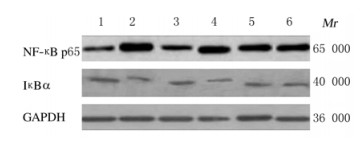
|
| Lane 1: Sham operation group;Lane 2:Model group;Lane 3:Positive control group;Lane 4-6:Low, medium, and high doses of emodin groups. 图 2 Western blotting法检测各组大鼠缺血侧海马组织中NF-κBp65和IκBα蛋白表达电泳图 Fig. 2 Electrophoregram of expressions of NF-κB p65 and IκBα proteins in hippocampus tissue at ischemic side of rats in various groups detected by Western blotting method |
|
|
急性缺血性脑卒中的病理生理过程复杂,其发生机制包括自由基损伤、兴奋性氨基酸产生、钙超载和炎症反应等一系列过程[13]。其中促炎性因子主要由激活的小胶质细胞和星型胶质细胞分泌,可加剧神经元损伤[14]。因此抑制炎症反应是治疗脑缺血的重要策略。本研究采用MCAO法制备局灶性脑缺血大鼠模型,观察大黄素对模型大鼠脑缺血的保护作用,探讨其神经保护作用的可能机制。
IL-1β是由神经元、胶质细胞和内皮细胞合成及分泌的细胞因子,主要分布于脑组织,协同其他细胞因子促进活化B细胞和T细胞,还能通过诱导其他炎性介质产生加强内皮细胞与白细胞黏附[15]。TNF-α是一种具有广泛生物学活性的细胞因子,作用于中枢神经系统时,能够调节神经-内分泌功能、介质释放和抗原递呈等过程。除此之外,IL-1β和TNF-α还可以通过激活细胞分泌细胞炎性因子,如诱导IL-6的合成。IL-6由单核细胞、成纤维细胞、T细胞、内皮细胞和巨噬细胞产生,参与机体炎症反应和免疫反应过程,是急性缺血期脑损伤程度的重要标志之一[16]。IL-1β、TNF-α和IL-6对急性缺血性脑卒中的发生起重要作用[17]。本研究结果显示:与假手术组比较,模型组大鼠神经功能评分和脑梗死体积百分比均明显增加,缺血侧海马组织中IL-6、IL-1β和TNF-α水平明显升高,给予低、中和高剂量大黄素和地塞米松干预均能减轻脑梗死体积,降低大鼠脑组织中IL-6、IL-1β和TNF-α水平,提示脑缺血引起海马组织损伤会引起炎性因子水平升高,与王喜丰等[18]研究结果一致,同时说明给予不同剂量大黄素能够通过抑制炎性因子的分泌,对局灶性脑缺血起保护作用。
NF-κB是炎症反应中的关键性核转录因子,可诱导多种细胞炎性因子的表达,造成组织损伤。NF-κB以p65异二聚体形式与其抑制性蛋白IκBα结合,表现为非活化状态。NF-κB能够促进IL-1β和TNF-α炎性细胞因子表达,同时,IL-1β和TNF-α进一步活化NF-κB蛋白,促进炎症反应的发生[19]。本研究结果显示:与假手术组比较,模型组大鼠缺血侧海马组织中NF-κB p65蛋白表达水平明显升高,IκBα蛋白表达水平降低;给予不同剂量大黄素干预后,局灶性脑缺血模型大鼠海马组织中NF-κB p65蛋白表达水平均明显降低,IκBα蛋白表达水平升高,提示低、中和高剂量大黄素均能够抑制NF-κB活性,可能通过抑制NF-κB信号通路调控IL-6、IL-1β和TNF-α介导的炎症反应,减少神经行为损伤症状,减少脑梗死面积[20-21]。
综上所述,大黄素可通过抑制NF-κB信号通路,降低海马组织中炎性细胞因子水平,减轻脑组织炎症反应,对局灶性脑缺血有神经保护作用,为大黄素应用于脑缺血的治疗提供了依据。
| [1] |
MEURER W J, BARTH B E, GADDIS G, et al. Rapid systematic review:intra-arterial thrombectomy "clot retrieval" for selected patients with acute ischemic stroke[J]. J Emerg Med, 2017, 52(2): 255-261. DOI:10.1016/j.jemermed.2016.10.004 |
| [2] |
ANTONINO T, CARLO M, ANTONIO P. Inflammation and inflammatory cell recruitment in acute cerebrovascular diseases[J]. Cur Immunol Rev, 2015, 11(1): 24-32. DOI:10.2174/157339551101150417101550 |
| [3] |
ZHANG F, YAN C, WEI C J, et al. Vinpocetine inhibits NF-κB-dependent inflammation in acute ischemic stroke patients[J]. Transl Stroke Res, 2018, 9(2): 174-184. DOI:10.1007/s12975-017-0549-z |
| [4] |
王刚, 王海燕, 梁宏, 等. LPS对大鼠骨髓MSCNF-κBp65及抗炎性细胞因子mRNA表达的影响[J]. 青海医学院学报, 2013, 34(3): 182-185. |
| [5] |
JAHNKE G D, PRICE C J, MARR M C, et al. Developmental toxicity evaluation of emodin in rats and mice[J]. Birth Defects Res B Dev Reprod Toxicol, 2004, 71(2): 89-101. DOI:10.1002/bdrb.20002 |
| [6] |
高红刚, 周菊华. 大黄素抗炎作用及相关机制研究进展[J]. 济宁医学院学报, 2016, 39(5): 348-352. DOI:10.3969/j.issn.1000-9760.2016.05.013 |
| [7] |
PARK S Y, CHOI Y W, PARK G. Nrf2-mediated neuroprotection against oxygen-glucose deprivation/reperfusion injury by emodin via AMPK-dependent inhibition of GSK-3[J]. J Pharm Pharmacol, 2018, 70(4): 525-535. DOI:10.1111/jphp.12885 |
| [8] |
WANG CY, ZHANG D L, MA H M, et al. Neuroprotective effects of emodin-8-O-β-d -glucoside in vivo and in vitro[J]. Eur J Pharmacol, 2007, 577(1-3): 58-63. DOI:10.1016/j.ejphar.2007.08.033 |
| [9] |
王果, 韩书珍, 陈翔. 芹菜素对急性大鼠脑缺血再灌注后脑组织NCAM表达的影响[J]. 中华中医药学刊, 2015, 33(10): 2440-2442. |
| [10] |
LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91. |
| [11] |
杨腾腾, 石秋艳, 孙原, 等. 瑞替加滨对缺血性脑卒中模型大鼠的保护作用及机制研究[J]. 中国临床研究, 2017, 30(7): 903-907. |
| [12] |
BEDERSON J B, PITTS L H, TSUJI M, et al. Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J]. Stroke, 1986, 17(3): 472-476. |
| [13] |
LYDEN P, WAHLGREN N G. Mechanisms of action of neuroprotectants in stroke[J]. J Stroke Cerebrovasc Dis, 2000, 9(6Pt2): 9-14. |
| [14] |
隋念含, 蒙国懿, 杨金凤, 等. 甲基苯丙胺中毒大鼠纹状体TNF-α、IL-1β及星形胶质细胞与小胶质细胞的变化[J]. 中国药物依赖性杂志, 2018, 27(2): 99-103. |
| [15] |
AMANTEA D, CERTO M, RUSSO R, et al. Early reperfusion injury is associated to MMP2 and IL-1β elevation in cortical neurons of rats subjected to middle cerebral artery occlusion[J]. Neuroscience, 2014, 277: 755-763. DOI:10.1016/j.neuroscience.2014.07.064 |
| [16] |
宋晓洁, 冯伟平, 韩雪娇, 等. 血清IL-6及S-100B水平对颅脑损伤严重程度和预后评估的临床意义[J]. 现代生物医学进展, 2016, 16(20): 3883-3886. |
| [17] |
LEMARCHANT S, DUNGHANA H, POMESHCHIK Y, et al. Anti-inflammatory effects of ADAMTS-4 in a mouse model of ischemic stroke[J]. Glia, 2016, 64(9): 1492-1507. DOI:10.1002/glia.23017 |
| [18] |
王喜丰, 汪敏, 李刚, 等. 中性鞘磷脂酶-2(Neutral sphingomyelin-2 N-SMase2)对大鼠脑缺血再灌注损伤中IL-6、IL-1β、TNF-α炎性因子的影响[J]. 中风与神经疾病杂志, 2018, 35(4): 310-313. |
| [19] |
ORTIS F, MIANI M, COLLI M L, et al. Differential usage of NF-κB activating signals by IL-1β and TNF-α in pancreatic beta cells[J]. FEBS Lett, 2012, 586(7): 984-989. DOI:10.1016/j.febslet.2012.02.021 |
| [20] |
张朝弘, 刘丹彦. 雷公藤红素后处理对大鼠局灶性脑缺血再灌注损伤后脑组织NF-κB及TNF-α、IL-1β的影响[J]. 重庆医科大学学报, 2015, 40(1): 37-41. |
| [21] |
李祥, 王毅, 于湘友. 关注神经重症患者迟发性脑缺血的治疗[J]. 中国实用内科杂志, 2019, 39(12): 1040-1044. |
 2020, Vol. 46
2020, Vol. 46


