扩展功能
文章信息
- 高瑞敏, 康玲玲
- GAO Ruimin, KANG Lingling
- 三七总皂苷对慢性心力衰竭大鼠心功能的改善作用及其机制
- Improvement effect of panax notoginseng saponins on cardiac function in rats with chronic heart failure and its mechanism
- 吉林大学学报(医学版), 2020, 46(03): 563-568
- Journal of Jilin University (Medicine Edition), 2020, 46(03): 563-568
- 10.13481/j.1671-587x.20200322
-
文章历史
- 收稿日期: 2019-08-14
慢性心力衰竭(chronic heart failure, CHF)是各种心血管疾病的终末阶段,是一种复杂性、系统性的临床综合征,具有容易复发和预后差的特点[1]。目前,临床上对CHF的治疗主要采用血管紧张素Ⅱ受体拮抗剂、血管紧张素转化酶抑制剂、醛固酮拮抗剂和β-受体阻滞剂等,但不能从根本上解决其发病率高和死亡率高的状况[2-3]。近年来,中药在防治CHF方面展现出安全、高效和不良反应少的优势。三七总皂苷是中药三七的主要成分之一,具有改善心肌缺血再灌注损伤、增加血液循环和改善血流供应的作用[4-5]。丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)信号通路主要包括细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)、c-Jun氨基末端激酶(c-Jun NH2-terminal protein kinase, JNK)和p38激酶3个亚族,对心肌保护发挥重要作用[6]。目前国内关于三七总皂苷应用于CHF治疗效果的研究[7-8]表明:三七总皂苷能有效改善CHF患者心功能,降低细胞凋亡相关因子水平,但对其作用机制研究甚少。本研究旨在观察三七总皂苷对CHF模型大鼠心脏功能的影响,探讨其作用机制,为临床治疗CHF提供新思路。
1 材料与方法 1.1 动物、主要试剂和仪器SPD级SD大鼠75只,体质量(220±20) g,购自河北省以岭医药研究院有限公司,动物使用许可证号:SYXK(冀)2015-0064。自由饮水摄食,环境温度(22±3)℃,相对湿度(50±5) %,12 h/12 h昼夜周期照明。卡托普利片购自中美上海施贵宝制药有限公司(国药准字H31022986),TUNEL细胞凋亡检测试剂盒购自美国罗氏公司,二奎啉甲酸(BCA)法蛋白定量试剂盒购自北京泰格美科技有限公司,ERK、p-ERK、JNK、p-JNK、p38和p-p38抗体购自美国Cell Signaling Technology公司,肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素6(interleukin 6,IL-6)ELISA试剂盒购自武汉博士德生物工程有限公司。色多普勒超声诊断仪(型号Vivid i,美国GE公司),光学显微镜(型号Eclipse 50i,日本Nikon公司),电泳仪(型号GP200,托摩根生物科技有限公司),酶标仪(型号Multiskan FC,美国赛默飞世尔公司)。
1.2 模型制备和分组[9]大鼠于造模前采用多普勒超声检查心脏,取心功能正常大鼠腹腔注射10%水合氯醛(0.3 mL·100 g-1)麻醉,于左上腹切开上皮,暴露腹并结扎腹主动脉,使腹主动脉管腔形成50%环形缩窄,缝合切口,术后每天肌肉注射40万U青霉素,连续3 d。造模4周后,进行心脏彩超检测,以左室射血分数(left ventricular ejection fraction, LVEF) < 45%视为CHF大鼠模型制备成功。排除死亡大鼠后,共60只大鼠造模成功,将60只造模成功大鼠随机分为模型组、阳性对照组、低、中和高剂量三七总皂苷组,每组12只。另取12只大鼠作为假手术组。阳性对照组大鼠灌胃给予卡托普利(100 mg·kg-1)[10];低、中和高剂量三七总皂苷组大鼠分别灌胃给予三七总皂苷(10、30和60 mg·kg-1)[11]; 假手术组和模型组大鼠分别灌胃给予等量生理盐水,连续给药8周,假手术组大鼠开腹后不结扎腹主动脉。观察各组大鼠一般情况。
1.3 彩色多普勒超声仪检测各组大鼠心脏功能指标末次给药后,麻醉大鼠,仰卧固定于鼠板,采用彩色多普勒超声仪检测各组大鼠左室舒张末期内径(left ventricular end-diastolic diameter, LVEDD)、左室收缩末期内径(left ventricular end-systolic diameter, LVESD)、左室后壁舒张期厚度(left ventricular posterior wall diastolic thickness, LVPWD)和LVEF,连续检测3个心脏周期求得平均值。随后行右颈总动脉插管,将导管从右颈总动脉插入,逆向进入左心室,末端连接血压换能器,测定心输出量(cardiacoutput, CO)、左室舒张压(left ventricular diastolic pressure, LVEDP)、左室收缩压(left ventricular systolic pressuer, LVSP)、左心室压力最大上升速率(maximal rate of increase of left ventricular pressure, +dp/dt max)/左心室压力最大下降速率(maximal rate of decrease of left ventricular pressure, -dp/dt max),连续检测3次取平均值。
1.4 HE染色观察各组大鼠心肌组织病理形态表现取出固定心肌组织,常规制备石蜡切片(5 μm),经烘烤、二甲苯脱蜡和梯度乙醇脱水后,HE染色,树脂封片后,置于光学显微镜下观察心肌组织病理形态表现。
1.5 TUNEL法检测各组大鼠心肌细胞凋亡率将切片常规脱蜡水化,3%过氧化氢封闭10 min,加入蛋白酶37℃孵育20 min,山羊血清封闭20 min,加入50 μL TUNEL反应液,37℃孵育60 min,磷酸盐缓冲液(PBS)清洗3次。加入5%辣根过氧化酶47℃孵育30 min,PBS清洗3次,二氨基联苯按(DAB)显色,苏木素复染,封片,显微镜下观察,随机取5个视野记录阳性细胞数和总细胞数,计算细胞凋亡率,细胞凋亡率=阳性细胞数/总细胞数×100%。
1.6 Western blotting法检测各组大鼠心肌组织中ERK、p-ERK、JNK、p-JNK、p38和p-p38蛋白表达水平取各组大鼠心肌组织,加入600 μL RIPA裂解液,12 000 r·min-1、4 ℃离心10 min,提取组织总蛋白,10% SDS-PAGE分离等量蛋白后进行转膜反应,5%脱脂奶粉封闭,添加抗ERK、p-ERK、JNK、p-JNK、p38、p-p38和β-actin抗体(1:500),4 ℃过夜孵育,加入二抗(1:5 000),室温摇床孵育1 h,采用ECL发光显影后置于凝胶成像仪内观察各蛋白表达,采用Image J软件对各蛋白条带进行量化分析。以β-actin作为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin条带灰度值。
1.7 酶联免疫吸附法检测各组大鼠血清TNF-α和IL-6水平取大鼠腹主动脉血,室温下放置15 min后,2 500 r·min-1离心10 min,分离血清,按照试剂盒说明书采用酶联免疫吸附法检测各组大鼠血清TNF-α和IL-6水平。
1.8 统计学分析采用SPSS 22.0统计软件进行统计学分析。大鼠LVEDD、LVESD、LVPWD、LVEF、CO、LVEDP、LVSP、+dp/dt max和-dp/dt max,各组大鼠心肌细胞凋亡率,各组大鼠心肌组织中ERK、p-ERK、JNK、p-JNK、p38和p-p38蛋白表达水平,血清TNF-α和IL-6水平均符合正态分布,以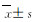
造模结束后,模型组大鼠死亡2只,死亡原因为CHF发作,假手术组、阳性对照组和低、中及高剂量三七总皂苷组大鼠未出现死亡。
2.2 各组大鼠心脏功能指标与假手术组比较,模型组大鼠LVEDD、LVESD、LVPWD、LVEDP和-dp/dt max明显升高(P < 0.05),LVEF、CO、LVSP和+dp/dt max明显降低(P < 0.05);与模型组比较,阳性对照组和低、中及高剂量三七总皂苷组大鼠LVEDD、LVESD、LVPWD、LVEDP和-dp/dt max明显降低(P < 0.05),LVEF、CO、LVSP和+dp/dt max明显升高(P < 0.05)。见表 1。
(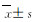 | |||||||||||||||||||||||||||||
| Group | n | LVEDD(l/mm) | LVESD(l/mm) | LVPWD(l/mm) | LVEF(η/%) | CO(mL·min-1) | |||||||||||||||||||||||
| Sham opreation | 12 | 5.04±0.36 | 3.02±0.26 | 1.13±0.12 | 64.23±6.17 | 66.25±7.78 | |||||||||||||||||||||||
| Model | 10 | 7.10±0.43* | 4.01±0.31* | 1.86±0.17* | 44.27±4.19* | 48.21±4.92* | |||||||||||||||||||||||
| Positive control | 12 | 5.20±0.31△ | 3.09±0.29△ | 1.22±0.14△ | 60.17±5.80△ | 62.41±5.50△ | |||||||||||||||||||||||
| Panax notoginseng saponins | |||||||||||||||||||||||||||||
| Low dose | 12 | 6.50±0.51△ | 3.62±0.23△ | 1.53±0.12△ | 49.82±5.01△ | 53.97±5.78△ | |||||||||||||||||||||||
| Medium dose | 12 | 5.98±0.62△ | 3.43±0.20△ | 1.49±0.14△ | 51.60±4.86△ | 56.20±4.82△ | |||||||||||||||||||||||
| High dose | 12 | 5.53±0.42△ | 3.24±0.28△ | 1.35±0.11△ | 55.34±5.24△ | 58.33±5.31△ | |||||||||||||||||||||||
| Group | n | LVEDP(P/mmHg) | LVSP(P/mmHg) | +dp/dt max (mmHg·s-1) | -dp/dt max (mmHg·s-1) | ||||||||||||||||||||||||
| Sham opreation | 12 | 2.21±0.20 | 162.81±5.84 | 10.92±0.77 | -16.93±0.62 | ||||||||||||||||||||||||
| Model | 10 | 7.10±0.24* | 143.31±6.86* | 6.49±0.69* | -8.84±0.67* | ||||||||||||||||||||||||
| Positive control | 12 | 3.98±0.32△ | 159.74±7.20△ | 9.82±0.58△ | -13.53±0.51△ | ||||||||||||||||||||||||
| Panax notoginseng saponins | |||||||||||||||||||||||||||||
| Low dose | 12 | 5.87±0.44△ | 151.20±5.31△ | 7.92±0.75△ | -10.67±0.55△△ | ||||||||||||||||||||||||
| Medium dose | 12 | 5.22±0.41△ | 152.21±7.20△ | 8.38±0.90△ | -11.14±0.59△ | ||||||||||||||||||||||||
| High dose | 12 | 4.06±0.39△ | 155.42±6.28△ | 9.01±0.65△ | -13.31±0.60△ | ||||||||||||||||||||||||
| * P < 0.05 compared with sham operation group; △ P < 0.05 compared with model group. | |||||||||||||||||||||||||||||
假手术组大鼠心肌组织结构清晰,肌纤维排列整齐,细胞核大小一致。模型组大鼠心肌组织结构模糊,心肌细胞肥大,肌纤维排列紊乱,出现肌丝溶解、断裂,细胞核出现核碎裂、核溶解,可见大量炎性细胞浸润。与模型组比较,阳性对照组和低、中及高剂量三七总皂苷组大鼠心肌组织结构较完整,心肌细胞肥大减轻,心肌纤维排列较疏松,肌丝部分断裂,可见部分炎性细胞浸润。见图 1(插页七)。
|
| A: Sham operation group; B: Model group; C: Positive control group; D-F:Low, medium, and high doses of panax notoginseng saponins groups 图 1 各组大鼠心肌组织形态表现(HE, ×200) Fig. 1 Morphology of myocardium tissue of rats in various groups (HE, ×200) |
|
|
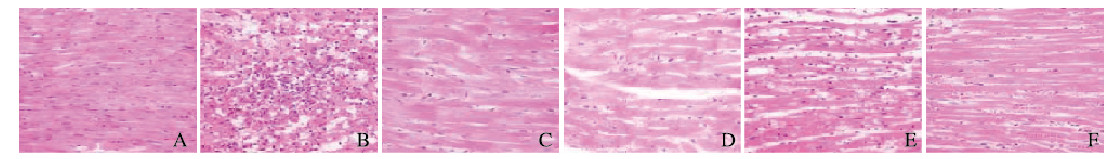
假手术组未见阳性心肌细胞,模型组可见大量阳性心肌细胞。与假手术组比较,模型组大鼠心肌细胞凋亡率明显升高(P < 0.05);与模型组比较,阳性对照组和低、中及高剂量三七总皂苷组大鼠心肌细胞凋亡率明显降低(P < 0.05)。见图 2(插页八)。
|
| A: Sham operation group; B: Model group; C: Positive control group; D-F:Low, medium, and high doses of panax notoginseng saponins groups. 图 2 各组大鼠心肌细胞凋亡形态表现(TUNRL, ×200) Fig. 2 Apoptotic morphology of myocardial cells of rats in various groups (TUNRL, ×200) |
|
|
与假手术组比较,模型组大鼠心肌组织中p-ERK、p-JNK和p-p38蛋白表达水平明显升高(P < 0.05);与模型组比较,阳性对照组和低、中及高剂量组大鼠胃癌组织中p-ERK、p-JNK和p-p38蛋白表达水平明显降低(P < 0.05)。各组大鼠胃癌组织中ERK、JNK和p-38蛋白表达水平比较无明显差异。见表 2和图 3。
(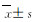 | |||||||||||||||||||||||||||||
| Group | n | p-ERK | p-JNK | p-p38 | |||||||||||||||||||||||||
| Sham operation | 12 | 0.39±0.11 | 0.45±0.05 | 0.61±0.05 | |||||||||||||||||||||||||
| Model | 10 | 1.61±0.23* | 1.45±0.25* | 1.78±0.21* | |||||||||||||||||||||||||
| Positive control | 12 | 0.98±0.19△ | 0.84±0.13△ | 0.85±0.09△ | |||||||||||||||||||||||||
| Panax notoginseng saponins | |||||||||||||||||||||||||||||
| Low dose | 12 | 1.33±0.25△ | 1.24±0.15△ | 1.32±0.11△ | |||||||||||||||||||||||||
| Medium dose | 12 | 1.25±0.17△ | 1.20±0.17△ | 1.05±0.08△ | |||||||||||||||||||||||||
| High dose | 12 | 1.08±0.20△ | 1.01±0.16△ | 0.76±0.10△ | |||||||||||||||||||||||||
| * P < 0.05 compared with sham operation group; △ P < 0.05 compared with model group. | |||||||||||||||||||||||||||||
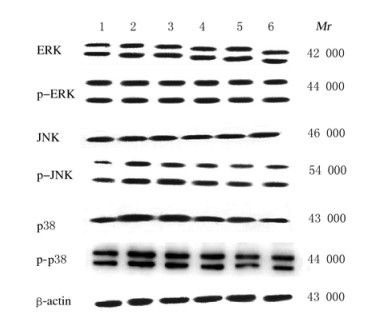
|
| Lane1:Sham operation group;Lane 2: Model group; Lane 3-5: Low, medium and high doses of panax notoginseng saponins groups;Lane 6: Positive control group. 图 3 各组大鼠心肌组织中ERK、p-ERK、JNK、p-JNK、p38、p-p38蛋白表达电泳图 Fig. 3 Electrophoregram of expressions of ERK, p-ERK, JNK, p-JNK, p38, and p-p38 proteins in myocardium tissue of rats in various groups |
|
|
与假手术组比较,模型组大鼠血清TNF-α和IL-6水平明显升高(P < 0.05);与模型组比较,阳性对照组、低、中及高剂三七总皂苷量组大鼠血清TNF-α和IL-6水平明显降低(P < 0.05)。见表 3。
[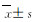 | |||||||||||||||||||||||||||||
| Group | n | TNF-α | IL-6 | ||||||||||||||||||||||||||
| Sham operation | 12 | 80.45±7.65 | 38.24±3.61 | ||||||||||||||||||||||||||
| Model | 10 | 135.48±11.85* | 60.50±5.89* | ||||||||||||||||||||||||||
| Positive control | 12 | 98.36±10.85# | 45.52±3.81△ | ||||||||||||||||||||||||||
| Panax notoginseng saponins | |||||||||||||||||||||||||||||
| Low dose | 12 | 126.21±11.10△ | 52.33±4.62△ | ||||||||||||||||||||||||||
| Medium dose | 12 | 117.82±10.66△ | 51.04±5.47△ | ||||||||||||||||||||||||||
| High dose | 12 | 105.65±11.51△ | 48.99±4.05△ | ||||||||||||||||||||||||||
| * P < 0.05 compared with sham operation group; △ P < 0.05 compared with model group. | |||||||||||||||||||||||||||||
引起CHF发生的基本机制是心肌重塑,而心肌细胞凋亡是CHF从代偿走向失代偿的转折点。研究[12]表明:MAPKs信号通路激活是心肌细胞肥大和由收缩型向合成型演变的最后通路,参与心肌重构的过程。此外,参与心肌重塑的因素还有TNF-α、IL-1β和IL-6等细胞炎性因子[13]。MAPKs是细胞中的一类丝氨酸/苏氨酸蛋白激酶,存在于大多数细胞内,其作用是将细胞外刺激信号转导至细胞及其核内,从而引起细胞增殖、分化、转化和凋亡等反应[14]。MAPKs是心肌细胞增殖、分化、凋亡、坏死、细胞骨架重组和间质纤维化等多条通路的汇聚点[15]。ERK1/2、JNK和p38为MAPKs信号转导通路中最重要的3条亚通路。其中ERKl/2信号通路是经典MAPKs信号转导途径,参与细胞的生长、发育、增殖和分化等多种病理生理过程,是多种促增殖信号转导途径的共同通路。发生CHF时,在压力负荷增加的情况下,心脏牵张刺激、生长因子等与特异G蛋白偶联受体结合,激活蛋白激酶C,启动Ras-Raf-MEK-ERK途径,激活ERK1/2及其介导的信号通路,参与CHF的发展[16]。JNK信号传导通路参与介导心功能不全期代偿性心肌肥厚,在心力衰竭期具有抗心肌细胞调亡作用[17]。p38途径被认为是与细胞增殖、分化或凋亡调控密切相关的细胞信号转导途径,是细胞外信号引起细胞增殖、分化等核反应的共同途径或汇聚点。研究[18]显示:p38信号转导通路被激活可能导致细胞在发生肥大过程后出现凋亡,在心力衰竭期具有促进心肌细胞凋亡作用。本研究结果显示:与假手术组比较,模型组大鼠心肌细胞肥大、坏死,心肌纤维排列不规则,可见大量炎性细胞浸润,出现大量心肌细胞凋亡,表现为细胞质致密化、收缩变小,细胞片段化形成细胞凋亡体,心肌组织中p-ERK、p-JNK和p-p38蛋白表达水平明显增加;与模型组比较,阳性对照组和低、中及高剂量三七总皂苷组大鼠心肌细胞凋亡数明显减少,心肌细胞凋亡率明显降低,心肌组织中p-ERK、p-JNK和p-p38蛋白表达水平明显降低,以高剂量三七总皂苷组效果更明显,上述结果说明磷酸化是ERK、JNK和p38在心肌细胞内的蛋白后修饰方式,p-ERK、p-JNK及p-p38是参与相关生物学活动的重要形式,三七总皂苷可对ERK、JNK和p38的磷酸化产生抑制作用。
TNF-α是由激活的单核-巨噬细胞分泌的细胞因子,在机体免疫反应和炎症反应中作为重要递质,抑制心肌收缩力,导致左心室功能降低,产生急性水肿,血清TNF-α水平可作为判断心功能级别的一个重要指标[19]。TNF-α可促进IL-6表达,这些细胞因子通过增强组织细胞对TNF-α的敏感性,使TNF-α的负性肌力作用进一步加强[20]。IL-6作为一种多功能的细胞因子,主要有免疫调节、刺激造血和应激反应等作用[21]。钱留军[22]的研究表明:CHF患者血清中IL-6水平随病情加重而升高。本研究结果表明:三七总皂苷对CHF大鼠血清炎性细胞因子TNF-α和血清IL-6具有明显的抑制作用,以高剂量三七总皂苷的抑制效果最为显著。
综上所述,三七总皂苷可能通过下调CHF模型大鼠心肌组织中ERK、JNK和p38蛋白磷酸化,抑制血清炎性因子分泌,发挥抑制心肌细胞凋亡的作用。
| [1] |
KERLEY CP. Nutritional interventions in heart failure:challenges and opportunities[J]. Curr Heart Fail Rep, 2018, 15(3): 131-140. |
| [2] |
VÍTOVEC J, ŠPINAR J, ŠPINAROVÁJ. Heart failure and inhibition of rennin-angiotensin-aldosterone system[J]. Coret Vasa, 2018, 60(3): 263-273. DOI:10.1016/j.crvasa.2018.02.003 |
| [3] |
徐玲玲. β受体阻滞剂治疗心力衰竭的临床效果观察[J]. 临床合理用药杂志, 2018, 11(35): 36-37. |
| [4] |
LIU X W, LU M K, ZHONG H T, et al. Panax notoginseng saponins attenuate myocardial ischemia-reperfusion injury through the HIF-1α/BNIP3 pathway of autophagy[J]. J Cardiovasc Pharmacol, 2019, 73(2): 92-99. DOI:10.1097/FJC.0000000000000640 |
| [5] |
张毅, 戴胜云, 徐冰, 等. 三七总皂苷抗心肌缺血再灌注损伤的药理研究进展[J]. 江苏中医药, 2017, 49(1): 82-85. |
| [6] |
ZHOU Q L, TENG F, ZHANG Y S, et al. FPR1 gene silencing suppresses cardiomyocyte apoptosis and ventricular remodeling in rats with ischemia/reperfusion injury through the inhibition of MAPK signaling pathway[J]. Exp Cell Res, 2018, 370(2): 506-518. DOI:10.1016/j.yexcr.2018.07.016 |
| [7] |
华新宇, 王晓兰, 康美清, 等. 三七总皂苷对慢性心力衰竭患者心功能及血浆细胞凋亡相关因子的影响[J]. 中国中医急症, 2014, 23(12): 2368-2370. DOI:10.3969/j.issn.1004-745X.2014.12.095 |
| [8] |
杨建敏, 王宁夫, 徐坚, 等. 三七总皂苷注射液辅助治疗舒张性心力衰竭临床观察[J]. 浙江中西医结合杂志, 2015, 25(1): 32-34. DOI:10.3969/j.issn.1005-4561.2015.01.013 |
| [9] |
王博群, 何燕, 黄慧娟, 等. 腹主动脉缩窄术不同结扎位置致慢性心力衰竭大鼠模型比较[J]. 广西医科大学学报, 2019, 36(2): 174-178. |
| [10] |
信业久, 丁铭宣, 金钐, 等. 卡托普利对心肌损伤大鼠半乳糖凝集素-3表达的影响[J]. 北华大学学报(自然科学版), 2019, 20(2): 192-195. |
| [11] |
张登青, 袁琴, 袁成福, 等. 三七总皂苷对衰老大鼠肝脏内质网应激介导炎症反应的影响[J]. 中国实验方剂学杂志, 2017, 23(19): 140-144. |
| [12] |
CHANG W, WU Q Q XIAO Y, et al. Acacetin protects against cardiac remodeling after myocardial infarction by mediating MAPK and PI3K/Akt signal pathway[J]. J Pharmacol Sci, 2017, 135(4): 156-163. |
| [13] |
施慧, 许闪, 王靓, 等. 苓桂术甘汤调节心室重构模型大鼠心肌组织NF-κB信号通路的分子机制研究[J]. 中药材, 2017, 40(3): 680-683. |
| [14] |
张云, 旦菊花, 孙鑫, 等. MAPKs信号通路在动脉粥样硬化发生发展中的调控作用[J]. 现代生物医学进展, 2017, 17(5): 178-180. |
| [15] |
刘建和, 赵吉锐, 雷娄芳, 等. 柴胡三参胶囊对p38MAPK通路介导BMSCs向心肌细胞分化的干预研究[J]. 中国中医急症, 2018, 27(7): 1163-1166. DOI:10.3969/j.issn.1004-745X.2018.07.010 |
| [16] |
薛一涛, 焦华琛, 刘秀娟, 等. 心衰与Raf-MEK-ERK通路的关系及中医药研究进展[J]. 中国中医急症, 2014, 23(12): 2250-2253. DOI:10.3969/j.issn.1004-745X.2014.12.039 |
| [17] |
TRENTI A, GRUMATI P, CUSINATO F, et al. Cardiac glycoside ouabain induces autophagic cell death in non-small cell lung cancer cells via a JNK-dependent decrease of Bcl-2[J]. Biochem Pharmacol, 2014, 89(2): 197-209. DOI:10.1016/j.bcp.2014.02.021 |
| [18] |
卢永浩, 吴昊, 张恒谦. Aβ25~35通过激活p38MAPK信号通路促进大鼠心肌细胞凋亡[J]. 重庆医学, 2015, 44(34): 4771-4773. DOI:10.3969/j.issn.1671-8348.2015.34.007 |
| [19] |
王大强, 王革新, 张庆远, 等. 血清TNF-α与IL-6和BNP指标在检测心力衰竭合并感染患者中的应用价值分析[J]. 中华医院感染学杂志, 2018, 28(21): 28-30. |
| [20] |
SHINJO T, IWASHITA M, YAMASHITA A, et al. IL-17A synergistically enhances TNFα-induced IL-6 and CCL20 production in 3T3-L1 adipocytes[J]. Biochem Biophys Res Commun, 2016, 477(2): 241-246. DOI:10.1016/j.bbrc.2016.06.049 |
| [21] |
NOTLEY C A, BROWN M A, MCGOVERN J L, et al. Engulfment of activated apoptotic cells abolishes TGF-β-mediated immunoregulation via the induction of IL-6[J]. J Immunol, 2015, 194(4): 1621-1627. |
| [22] |
钱留军. 血清TNF-α、MMP-9、IL-6水平检测在老年慢性心力衰竭患者病情评估中的应用价值[J]. 河南医学研究, 2017, 26(14): 2648-2649. DOI:10.3969/j.issn.1004-437X.2017.14.108 |
 2020, Vol. 46
2020, Vol. 46


