扩展功能
文章信息
- 焦光美, 单海雷, 张晓璇, 赵亮, 窦志杰, 康玲伶, 马征, 孙艳军, 杨宁
- JIAO Guangmei, SHAN Hailei, ZHANG Xiaoxuan, ZHAO Liang, DOU Zhijie, KANG Lingling, MA Zheng, SUN Yanjun, YANG Ning
- 舒血宁注射液对急性脑梗死大鼠脑组织的保护作用及其机制
- Protective effect of Shuxuening Injection on brain tissue of rats with acute cerebral infarction and its mechanism
- 吉林大学学报(医学版), 2020, 46(03): 557-562
- Journal of Jilin University (Medicine Edition), 2020, 46(03): 557-562
- 10.13481/j.1671-587x.20200321
-
文章历史
- 收稿日期: 2019-09-17
急性脑梗死又称为缺血性卒中,主要由于脑血管闭塞导致脑组织血液供应不足引起缺氧,导致局限性脑组织缺血性损伤,具有极高的致残率和致死率,临床上常表现为脑功能减退,并且出现眩晕、头痛、偏瘫和意识障碍等症状[1-3]。急性脑梗死由瘀血阻塞经络引起,在中医学上归类于中风,一般采用祛风通络法治疗。舒血宁注射液为银杏叶提取物,其有效成分主要为黄酮苷类、银杏内酯和白果内酯,具有扩张血管及改善微循环的功效[4]。药理学研究[5-6]表明:舒血宁注射液具有改善慢性脑供血不足、降低血液黏稠度、抑制血清炎症因子表达和改善神经功能的作用。生长分化因子15(growth differentiation factor-15,GDF-15)和C反应蛋白(C-reactive protein,CRP)是心脑血管疾病重要的血清标记物,能够调控细胞反应,对心脑血管疾病的诊断有重要临床意义[7]。GDF-15和CRP在机体内有明显的组织特异性,一般情况下在脑组织中只有微量表达[8]。心肌或脑等缺血损伤能够诱导脑组织中GDF-15和CRP表达[9]。目前国内外有关舒血宁注射液对急性脑梗死的保护作用已有相关报道,但未见其对脑组织中GDF-15和CRP表达水平影响的研究报道。本研究通过观察舒血宁注射液对急性脑梗死大鼠脑组织中GDF-15和CRP表达水平的影响,初步探讨舒血宁注射液对急性脑梗死大鼠神经功能的保护作用及其机制。
1 材料与方法 1.1 实验动物和主要试剂50只健康SD大鼠,雄性,体质量200~250 g,8周龄,由承德医学院提供,动物使用许可证号:SCXK(冀)2017-001,自由摄食和饮水,实验前适应性饲养1周。舒血宁注射液(规格:每支2 mL,河北神威药业有限公司,国药准字Z13020796),尼莫地平(规格:每片20 mg,济川药业集团有限公司,国药准字H20000682),GDF-15和CRP抗体(美国Santa Cruz公司),二抗(北京中杉金桥生物科技有限公司),2, 3, 5-氯化三苯四唑(TTC)染液(南京建成生物工程研究所),肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)、白细胞介素1β(interleukin- 1β,IL-1β)(武汉博士德生物工程有限公司)。电子天平(YP600型,上海精密仪器仪表有限公司),全自动石蜡切片机(RM2235型,德国Leica公司),超低温冰箱(MDF-382E型,日本三洋公司),光学显微镜和Image-Pro Plus 6.0图像分析软件(日本尼康公司),Motic B5显微摄像系统(麦克奥迪实业集团有限公司)。
1.2 动物分组和大鼠脑梗死模型制备将50只大鼠随机分为对照组、假手术组、模型组、尼莫地平组和舒血宁注射液组,每组10只。采用文献[10]的方法建立大鼠急性脑梗死模型。大鼠术前禁食12 h,采用10%水合氯醛溶液(0.32 mL·kg-1)腹腔麻醉,于颈正中切口,钝性分离大鼠皮下组织,暴露右侧胸锁乳突肌,分离颈总动脉、颈外动脉和颈内动脉,分别采用线栓法结扎颈总动脉及颈外动脉近心端。在颈总动脉远心端剪1个小切口,将尼龙线从切口缓慢导入,松开颈内动脉夹,于颈内动脉16~17 mm处遇到阻力,长度约2 cm,用缝合线固定栓塞线,缝合皮肤,伤口外用青霉素软膏。大鼠苏醒后提尾时左前肢内收屈曲、右眼Horner征、爬行时向左侧划圈、爬行时向左侧倾倒为造模成功。假手术组大鼠分离颈总动脉、颈外动脉和颈内动脉后,只结扎颈外动脉;对照组大鼠不进行手术处理;舒血宁注射液组大鼠造模成功后腹腔注射舒血宁注射液(剂量为0.4 mL·kg-1,按成人日用量4 mL并采用人与动物体表面积法换算)[11], 每日1次,连续给药7 d;尼莫地平组大鼠造模后腹腔注射2.0 mg·kg-1尼莫地平。对照组、模型组和假手术组大鼠腹腔注射等体积生理盐水。
1.3 各组大鼠神经功能缺损评分采用文献[11]中的5分法对各组大鼠神经功能进行评分。正常计0分,大鼠左侧前肢无法伸展计1分,大鼠左侧前肢屈曲计2分,大鼠稍有向左侧绕圈者计3分,大鼠向左侧绕圈严重者计4分,大鼠行走向左侧倾倒者计5分,分数越高表明大鼠神经功能缺损越严重。
1.4 各组大鼠脑组织含水量和相对脑梗死面积检测采用文献[12]的方法,各组大鼠10%水合氯醛麻醉后,迅速取脑组织,置于生理盐水中清洗后,用滤纸吸干脑组织,立即分别称质量,该质量为W1,然后将脑切片按组分别置于干燥的玻璃皿上,于100℃烘箱中烘干,室温放凉后称质量,计为W2,根据2次称质量结果计算脑组织含水量。脑组织含水量=(W1-W2)/W1×100%。将脑组织切成2 mm厚冠状切片,以2% TTC于37℃水浴中染色5~10 min后,采用4%多聚甲醛缓冲液固定,红色为正常脑组织,白色为梗死脑组织。采用显微摄像系统检测各组大鼠相对脑梗死面积。相对脑梗死面积=[对侧脑半球面积-(缺血脑半球面积-梗死面积)/对侧脑半球面积]×100%。
1.5 HE染色观察各组大鼠脑组织病理形态表现取每组大鼠脑皮层置于4℃生理盐水冲洗,切成2 mm厚冠状切片,以2% TTC于37℃水浴中染色5~10 min后,置于4%多聚甲醛溶液中固定过夜,进行常规石蜡包埋,切片,片厚约4 μm,采用苏木素-伊红(HE)染色,光学显微镜下观察各组大鼠脑组织病理形态表现。
1.6 免疫组织化学法检测各组大鼠脑组织中GDF-15和CRP表达水平取各组大鼠脑组织切片,置于4%多聚甲醛中固定24 h,石蜡包埋,连续切片,厚度为4 μm,常规脱蜡脱水,3%H2O2孵育15 min,PBS溶液冲洗,置于枸橼酸盐缓冲液高温高压修复5 min,冷却至室温,加入一抗,4℃过夜,PBS冲洗,加入二抗,37℃下孵育30 min,PBS冲洗,DAB显色5 min,苏木素复染1 min,常规脱水透明,中性树胶封片。置于光学显微镜下观察,阳性细胞呈棕褐色。采用Image-Pro Plus 6.0图像分析软件对数据进行分析,以数字图像上计数单位细胞中GDF-15和CRP阳性细胞数表示GDF-15和CRP表达水平。
1.7 ELISA法检测各组大鼠脑组织中TNF-α、IL-6和IL-1β水平将脑组织切片制成匀浆后,置于96孔板中,分别加入100 μL标准品、样品稀释液和待测样品,于37℃下放置60 min,洗涤,加入TNF-α、IL-6和IL-1β抗体100 μL,37℃放置60 min,洗涤,加入HRP标记的亲和素100 μL,于37℃放置30 min,洗涤,加入100 μL底物工作液(TMB),37℃避光放置15 min,加入100 μL终止液。于酶标仪450 nm波长处检测吸光度(A)值,A值越高表明TNF-α、IL-6和IL-1β水平越高,根据标准曲线检测各组大鼠脑组织中TNF-α、IL-6和IL-1β水平,单位为ng·L-1。
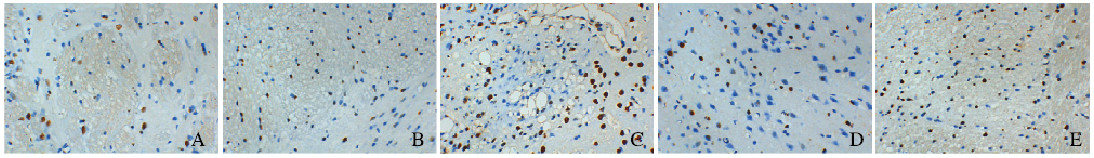
1.8 统计学分析采用SPSS 19.0统计软件进行统计学分析。各组大鼠神经功能缺损评分、脑组织含水量、相对脑梗死面积、脑组织中CRP和GDF-15表达水平及TNF-α、IL-6、IL-1β水平均符合正态分布,以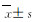
对照组和假手术组大鼠未发现神经功能缺损症状,计0分。与模型组比较,给药第3和7天时尼莫地平组和舒血宁注射液组大鼠神经功能缺损评分明显降低(P<0.05)。见表 1。
(n=10, 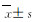 | |||||||||||||||||||||||||||||
| Group | Score of neurological impairment | ||||||||||||||||||||||||||||
| (t/d)1 | 3 | 7 | |||||||||||||||||||||||||||
| Control | 0 | 0 | 0 | ||||||||||||||||||||||||||
| Sham operation | 0 | 0 | 0 | ||||||||||||||||||||||||||
| Model | 4.6±0.3 | 4.3±0.1 | 3.1±0.2 | ||||||||||||||||||||||||||
| Nimodipine | 4.3±0.4 | 3.3±0.2* | 2.0±0.4* | ||||||||||||||||||||||||||
| Shuxuening Injection | 4.3±0.3 | 3.5±0.1* | 2.3±0.4* | ||||||||||||||||||||||||||
| * P<0.05 compared with model group. | |||||||||||||||||||||||||||||
与对照组和假手术组比较,模型组大鼠脑组织含水量明显升高(P<0.05);与模型组比较,尼莫地平和舒血宁注射液组大鼠脑组织含水量明显降低(P<0.05)。对照组和假手术组大鼠无脑梗死,因此相对脑梗死面积计为0;与模型组比较,尼莫地平和舒血宁注射液组大鼠脑相对梗死面积明显减小(P<0.05)。见表 2。
(n=10, 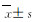 | |||||||||||||||||||||||||||||
| Group | Water content in brain tissue | Relative cerebral infarction area | |||||||||||||||||||||||||||
| Control | 68.73±5.26 | 0 | |||||||||||||||||||||||||||
| Sham operation | 70.02±4.13 | 0 | |||||||||||||||||||||||||||
| Model | 83.64±6.37*△ | 38.98±4.52 | |||||||||||||||||||||||||||
| Nimodipine | 72.46±8.93# | 17.53±4.66# | |||||||||||||||||||||||||||
| Shuxuening Injection | 75.25±4.18# | 20.13±3.04# | |||||||||||||||||||||||||||
| * P<0.05 compared with control group; △ P<0.05 compared with sham operation group; # P<0.05 compared with model group. | |||||||||||||||||||||||||||||
对照组和假手术组大鼠大脑皮层结构完整,皮层神经元排列整齐有序,层次清晰。与假手术组比较,模型组大鼠神经细胞胞浆和胞核皱缩,轻度肿胀,神经细胞与毛细管周围间隙较大,间质疏松。与模型组比较,舒血宁注射液组大鼠脑皮质神经细胞和神经胶质细胞肿胀程度及间质疏松程度均减轻,病理形态表现与尼莫地平组相近。见图 1(插页七)。
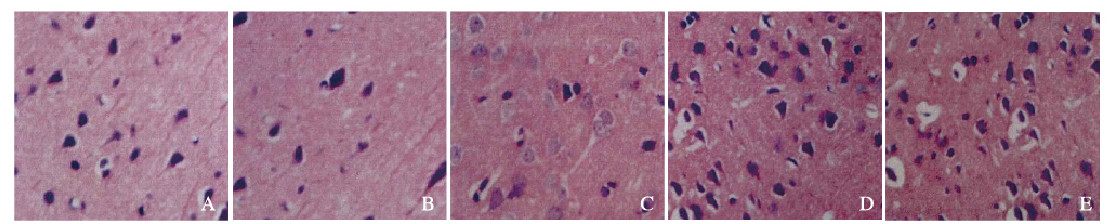
|
| A:Control group; B: Sham operation group; C: Model group; D: Nimodipine group; E: Shuxuening Injection group 图 1 各组大鼠脑组织病理形态表现(×100) Fig. 1 Pathomorphology of brain tissue of rats in various groups |
|
|
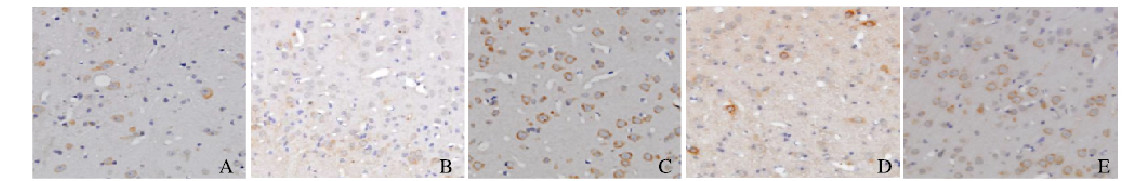
对照组和假手术组大鼠脑组织中有少量GDF-15和CRP阳性表达。与对照组和假手术组比较,模型组大鼠脑组织中GDF-15和CRP表达水平明显升高(P<0.05)。与模型组比较,尼莫地平组和舒血宁注射液组大鼠脑组织中GDF-15表达水平明显升高(P<0.05),CRP表达水平明显降低(P<0.05)。见表 4、图 2(插页七)和图 3(插页七)。
(n=10, 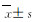 | |||||||||||||||||||||||||||||
| Group | GDF-15 | CRP | |||||||||||||||||||||||||||
| Control | 7.35±2.61 | 6.41±2.11 | |||||||||||||||||||||||||||
| Sham operation | 8.02±2.14 | 6.67±2.78 | |||||||||||||||||||||||||||
| Model | 24.65±2.04*△ | 19.67±2.54*△ | |||||||||||||||||||||||||||
| Nimodipine | 28.41±3.59△# | 12.61±2.04# | |||||||||||||||||||||||||||
| Shuxuening Injection | 33.45±4.99△# | 13.56±3.45# | |||||||||||||||||||||||||||
| * P<0.05 compared with control group; △ P<0.05 compared with sham operation group; # P<0.05 compared with model group. | |||||||||||||||||||||||||||||
|
| A:Control group; B: Sham operation group; C: Model group; D: Nimodipine group; E: Shuxuening injection group 图 2 各组大鼠脑组织中GDF-15表达(×400) Fig. 2 Expressions of GDF-15 in brain tissue of rats in various groups |
|
|
|
| A:Control group; B: Sham operation group; C: Model group; D: Nimodipine group; E: Shuxuening injection group. 图 3 各组大鼠脑组织中CRP表达(×400) Fig. 3 Expressions of CRP in brain tissue of rats in various groups |
|
|
与对照组和假手术组比较,模型组大鼠脑组织中TNF-α、IL-6及IL-1β水平明显升高(P < 0.05);与模型组比较,尼莫地平组和舒血宁注射液组大鼠脑组织中TNF-α、IL-6及IL-1β水平明显降低(P < 0.05)。见表 5。
[n=10, 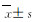 | |||||||||||||||||||||||||||||
| Group | IL-6 | IL-1β | TNF-α | ||||||||||||||||||||||||||
| Control | 124.80±11.56 | 108.84±9.52 | 34.61±4.02 | ||||||||||||||||||||||||||
| Sham operation | 134.35±15.36 | 112.46±10.46 | 35.16±5.09 | ||||||||||||||||||||||||||
| Model | 223.85±22.52*△ | 204.80±21.65*△ | 62.31±5.47*△ | ||||||||||||||||||||||||||
| Nimodipine | 143.82±17.43# | 115.34±12.50# | 37.40±4.89# | ||||||||||||||||||||||||||
| Shuxuening Injection | 167.47±20.62# | 121.46±13.75# | 38.21±3.32# | ||||||||||||||||||||||||||
| * P<0.05 compared with control group; △ P<0.05 compared with sham operation group; # P<0.05 compared with model group. | |||||||||||||||||||||||||||||
急性脑梗死是常见的脑血管疾病,具有高发病率、高致残率和高致死率等特点,给患者健康和生活质量带来了极大威胁,且增加了患者家庭经济负担和社会负担,该病近年来呈现年轻化趋势。目前临床上对急性脑梗死的治疗主要采用抗凝、溶栓、降纤和抗血小板等方法,但目前尚无确切有效的治疗方法[13-14]。舒血宁注射液中的银杏内酯和白果内酯具有扩张血管及改善微循环的功效,因而该药具有通络散瘀、扩张血管及降低血黏度的功效,对急性脑梗死有显著疗效[15-17]。研究[6, 18-19]表明:舒血宁注射液能改善患者脑部血供、降低血黏度和血浆纤维蛋白原水平、抗血小板聚集、抗炎症损伤、抗氧化应激、调节脑血管血液动力学参数和神经功能相关因子平衡。
GDF-15作为神经元中的神经营养因子,其水平动态变化可反映脑血管病的发生发展,反映脑损伤的严重程度,对脑血管疾病具有指导意义[20]。CRP参与脑组织炎症反应的调节,在急性脑梗死发病过程中起重要作用[21]。IL-6和IL-1β在机体免疫应答、骨髓造血和炎症反应中发挥重要作用,脑缺血后脑组织中IL-6和IL-1β表达水平升高,且在缺血再灌注后期仍维持在较高水平[22-23]。TNF-α主要作用是提高机体免疫和促进组织愈合,是具有多效性作用的促炎性细胞因子,可促进脑缺血损伤区黏附分子的表达和炎性细胞的浸润[24-25]。本研究结果显示:大鼠造模后出现明显的神经功能障碍,舒血宁注射液组大鼠神经功能评分较模型组明显降低,脑组织含水量明显降低,相对脑梗死面积明显减小,说明舒血宁注射液能够明显改善神经功能缺损,对脑梗死引起的神经损伤有明显的保护作用,与相关报道[12]一致。与模型组比较,舒血宁注射液组大鼠脑组织中CRP表达水平降低,TNF-α、IL-6和IL-1β水平降低,GDF-15表达水平明显升高,说明舒血宁注射液能够通过上调GDF-15表达和抑制CRP表达从而减轻脑组织炎性反应程度。
综上所述,舒血宁注射液能通过上调脑组织中GDF-15表达、抑制CRP表达和降低细胞炎性因子水平改善急性脑梗死大鼠神经功能,减少脑梗死面积,对急性脑梗死大鼠神经功能起保护作用。
| [1] |
王硕, 何俗非, 翟静波, 等. 丹红注射液药理作用及临床应用研究进展[J]. 中国中医药信息杂志, 2014, 21(3): 128-131. |
| [2] |
牛国忠.急性脑梗死血管内治疗新进展[C]//浙江省科学技术协会.2015年浙江省神经病学学术年会论文汇编.杭州: 浙江省科学技术协会, 2015: 15-17.
|
| [3] |
朱云波, 李佳佳, 马征, 等. 阿替普酶对急性脑梗死大鼠血管内皮细胞中Claudin-1和Claudin-5蛋白表达的影响[J]. 吉林大学学报(医学版), 2017, 43(6): 1137-1141. |
| [4] |
LI T H, ZHANG Y Y, TIAN J W, et al. Ginkgo biloba pretreatment attenuates myocardial ischemia-reperfusion injury via mitoBKCa[J]. Am J Chin Med, 2019, 47(5): 1057-1073. |
| [5] |
张建平, 石军, 孔延夺. 银杏提取物舒血宁注射液治疗慢性脑供血不足患者的临床疗效[J]. 临床医学研究与实践, 2017, 14(30): 119-120. |
| [6] |
JIE L I, MIN X U. Effect of adjuvant Shuxuening injection therapy on the inflammatory response mediated by TLRs in patients with acute exacerbation of COPD[J]. J Hainan Med Univ, 2017, 23(4): 44-47. |
| [7] |
AGO T, SADOSHIMA J. GDF15, a cardioprotective TGF-β superfamily protein[J]. Circ Res, 2006, 98(3): 294-297. |
| [8] |
WOLLERT K C, KEMPF T, PETER T, et al. Prognostic value of growth-differentiation factor-15 in patients with non-ST-elevation acute coronary syndrome[J]. Circulation, 2007, 115(8): 962-971. |
| [9] |
刘文, 张欢, 钱琳. 丹红注射液对大鼠脑缺血再灌注后GDF-15表达的影响研究[J]. 中南药学, 2014, 12(9): 876-879. |
| [10] |
LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91. |
| [11] |
姜丹, 李彬, 马军, 等. 舒血宁注射液对脑缺血再灌注大鼠缺血半暗带水通道蛋白1和水通道蛋白9表达的影响[J]. 中风与神经疾病杂志, 2010, 27(11): 1018-1021. |
| [12] |
贾真, 李晓艳. 舒血宁注射液对大鼠心肌缺血再灌注损伤的保护作用研究[J]. 国医论坛, 2010, 25(2): 41-42. |
| [13] |
中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组. 中国急性缺血性脑卒中诊治指南2010[J]. 中国临床医生, 2011, 39(3): 67-73. |
| [14] |
任超, 刘小芳, 解丰帆. 急性脑梗死治疗进展[J]. 中华医学实践杂志, 2008, 7(8): 680-682. |
| [15] |
廖金明, 余梦黎, 秦莎莎, 等. 羟基红花黄色素A、芍药苷单用及联合对脑缺血再灌注损伤大鼠脑组织NF-κB及炎症因子的影响[J]. 中药药理与临床, 2018, 34(3): 51-55. |
| [16] |
唐永鑫, 李慧琴. 白果内酯对脑缺血损伤保护作用的研究进展[J]. 药物评价研究, 2018, 41(7): 1203-1209. |
| [17] |
HUA J, YIN N, YANG B, et al. Ginkgolide B and bilobalide ameliorate neural cell apoptosis in α-synuclein aggregates[J]. Biomed Pharmacother, 2017, 96: 792-797. |
| [18] |
沈亚雯, 赵燕燕, 王文安. 长春西汀与舒血宁对脑缺血性疾病的血流动力学影响[J]. 实用临床医药杂志, 2014, 18(23): 8-10. |
| [19] |
代岩, 金博, 许学宗. 舒血宁注射液联合孟鲁司特钠对AECOPD患者肺功能及血清4-HNE、bFGF、VCAM-1、TGF-β1水平变化的影响[J]. 陕西中医, 2018, 39(8): 1037-1039. |
| [20] |
田国忠, 魏罡, 李梅秀, 等. 葛瑞林对心肌梗死致心力衰竭大鼠保护作用及生长分化因子-15的影响[J]. 解剖学报, 2013, 44(2): 274-278. |
| [21] |
唐淑俊, 梅凤君. 炎性细胞因子和C-反应蛋白在急性脑梗死中的变化及相关性研究[J]. 河北医科大学学报, 2010, 31(11): 1347-1350. |
| [22] |
DONG X, LIU W J, YANG P K. Joint detection of serum Cys-C, IL-6 and VEGF levels in patients with hypertensive acute cerebral infarction[J]. Int J Clin Exp Med, 2007, 17(9): 600-607. |
| [23] |
LORENZO P. Involvement of IL-1beta in acute stress-induced worsening of cerebral ischaemia in rats[J]. Eur Neuropsychopharmacol, 2007, 17(9): 600-607. |
| [24] |
滕海英, 曹丽霞, 赵丽娟. TNF-α hs-CRP LDL-c与老年急性脑梗死的相关性研究[J]. 中国实用神经疾病杂志, 2016(24): 61-63. |
| [25] |
姚杰鹏, 刘昕, 李志安, 等. 同型半胱氨酸对急性高血压性脑梗死颈动脉斑块稳定性及D-二聚体影响临床研究[J]. 中国实用内科杂志, 2019, 39(1): 93-94. |
 2020, Vol. 46
2020, Vol. 46


