扩展功能
文章信息
- 卜一, 张硕, 钱旭东, 王红梅, 窦志杰
- BU Yi, ZHANG Shuo, QIAN Xudong, WANG Hongmei, DOU Zhijie
- 急性脑梗死小鼠脑组织中Galectin-3和MMP-9的表达及尼莫地平的干预作用
- Expressions of Galectin-3 and MMP-9 in brain tissue of mice with acute cerebral infarction and intervention effect of nimodipine
- 吉林大学学报(医学版), 2020, 46(03): 551-556
- Journal of Jilin University (Medicine Edition), 2020, 46(03): 551-556
- 10.13481/j.1671-587x.20200320
-
文章历史
- 收稿日期: 2019-07-09
急性脑梗死发病机制复杂,炎症反应在脑血管疾病和动脉粥样硬化中发挥重要作用,促炎因子和抗炎因子之间平衡失调与动脉粥样硬化的发生发展关系密切[1]。半乳糖凝集素3(Galectin-3)是一种调节细胞生长、抗细胞凋亡、介导细胞粘附和参与炎症反应的半乳糖凝集素,在心脑血管疾病中发挥重要作用[2]。基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)为基质金属蛋白酶家族的一员,具有促炎作用,在心脑血管疾病的发生发展中也发挥重要作用[3]。研究[4-5]显示:脑梗死患者血清Galectin-3和MMP-9水平升高,HISAMATSU等[6]发现:在短暂性脑缺血后,海马CA1区和CA2区均有Galectin-3表达,表明Galectin-3和MMP-9可能参与脑缺血的发生发展过程。尼莫地平为公认的脑保护剂,具有抑制炎症反应和氧化应激的作用,在脑梗死的治疗中疗效明显[7-8],但其对脑组织中Galectin-3和MMP-9水平的影响尚不清楚。本文作者对急性脑梗死小鼠脑组织中Galectin-3和MMP-9水平及尼莫地平对其的干预作用进行研究,探讨尼莫地平保护脑梗死小鼠脑组织的可能机制。
1 材料与方法 1.1 实验动物、主要试剂和仪器清洁级、雄性CD-1成年小鼠210只,10~12周龄,体质量28~30 g,购自北京医疗器械检验所,动物使用许可证号:SYXK(京)2015-0005。尼莫地平注射液(上海信谊金珠药业有限公司,批号:H20000942),水合氯醛、多聚甲醛、伊红和苏木素(天津化学试剂有限公司),TRIzol和逆转录酶(美国Amresco公司),兔抗鼠Galectin-3单克隆抗体和兔抗鼠MMP-9单克隆抗体(美国Abcam公司)等。RT-PCR仪(美国Bio-Rad公司),全自动石蜡切片机(型号Leica RM2235,德国Leica公司),超低温冰箱(型号MDF-382E,日本三洋公司),光学显微镜(日本尼康公司)。
1.2 动物分组和处理将210只小鼠随机分为对照组、模型组和尼莫地平组,每组70只。尼莫地平组小鼠于术前30min腹腔注射尼莫地平(0.4 mg·kg-1)[9],对照组和模型组小鼠腹腔注射等量生理盐水。模型组和尼莫地平组小鼠建立急性脑梗死模型,采用线栓法制作大脑中动脉梗死模型[10]:将小鼠经水合氯醛麻醉,仰卧固定到手术台上,将颈部皮肤去毛、酒精消毒,取纵行切口(长约1.5 cm),分离颈部肌肉、筋膜和腺体组织,包括右侧颈三角,剥离右侧颈总动脉、颈外动脉和颈内动脉,在颈总动脉近心端穿线,距离颈总动脉分叉4 mm处穿线并结扎,间断颈外动脉远心端分支,沿颈内动脉向颅底方向分离2 mm,用微动脉夹夹闭颈内动脉;在颈外动脉残端剪约0.2 mm切口,将线栓插入颈外动脉,移除微动脉夹,扭转线栓插入到颈内动脉颅内段,线栓插入9.5 mm,感到轻微阻力时表明线栓堵住大脑中动脉开口,此时结扎颈内动脉,剪断线栓,缝合皮肤,术后用庆大霉素消毒切口皮肤。对照组小鼠不插入线栓,其他步骤同模型组小鼠。建模成功标准:倒悬时小鼠左上肢向胸腔屈曲,左侧肢体疼痛回缩消失或迟钝,行走时小鼠身体向左转圈或倾倒,右侧出现Horner’ s症。排除标准:小鼠在观察时间内死亡,出现蛛网膜下腔出血,无缺血病理改变。对照建模成功标准和排除标准,对照组、模型组和尼莫地平组分别有69、63和66只小鼠符合实验要求。建模后24 h,每组取60只小鼠进行Longar评分[11]和改良神经功能缺损评分(modified neurological sevenity score, mNSS)[12],神经功能评分结束后,每组取15只小鼠行TTC染色观察脑梗死情况,另取15只小鼠用于脑含水量测量,再取15只小鼠用于HE染色和免疫组织化学染色检测,剩余15只小鼠用于RT-PCR检测。
1.3 Longar评分和mNSS评价各组小鼠神经功能建模后24 h,采用Longar评分和mNSS评价各组小鼠神经功能:Longar评分总分为5分,0分为无神经功能损伤、行动正常,1分为提尾时前肢内收、无法完全伸展,2分为行走时向左转圈,3分为行走时向左倾倒,4分为不能行走或昏迷,5分为死亡;mNSS总分为18分,评分项目包括平衡木、感觉、运动、反射测试,反射消失或不能完成项目,分值越高神经损伤越严重。
1.4 TTC染色检测各组小鼠脑梗死体积每组取15只小鼠,麻醉后断头处死,取出脑组织,等距切除5片冠状切片,将脑冠状切片进入TTC溶液中,孵育15 min,弃去TTC溶液,置于多聚甲醛中固定24 h,弃去多聚甲醛,采用数码相机拍照,并导入Image J verl.37c NIH软件分析图像,其中苍白色区为脑梗死区,红色区为正常脑组织区,计算脑梗死体积百分比。脑梗死体积百分比=脑组织梗死部分体积/脑组织总体积×100%。
1.5 各组小鼠脑组织脑含水量测定将每组15只小鼠断头处死,取脑组织,立即称质量,即湿质量,然后放入烤箱中烘干,称取烘干后质量,即干质量,计算脑组织含水量。脑组织含水量=脑组织湿质量-脑组织干质量)/脑组织湿质量×100%。
1.6 HE染色观察各组小鼠脑组织形态表现每组取15只小鼠,以水合氯醛麻醉后仰卧位固定,剪开小鼠胸部,暴露心脏,经左心室灌注预冷的生理盐水,至流出液体清亮时用多聚甲醛固定,至小鼠尾巴和四肢僵直,然后迅速断头,取出脑组织,于多聚甲醛中固定24 h,石蜡包埋。将脑组织制作为5 μm厚石蜡切片,经脱蜡至水,进入苏木素染液中染色10 min,蒸馏水冲洗,置入1%盐酸乙醇中30 s,蒸馏水冲洗,伊红染液中染色2 min,蒸馏水冲洗,二甲苯透明,中性树胶封片,显微镜下观察各组小鼠脑组织病理形态表现。
1.7 RT-PCR法检测各组小鼠脑组织中Galectin-3和MMP-9 mRNA表达水平每组取15只小鼠,断头处死,取100 mg梗死侧皮层脑组织,研磨成粉末状,加入TRIzol提取总RNA,逆转录为cDNA,进行PCR反应,反应条件为95 ℃、30 s,95 ℃、5 s、58 ℃、30 s,共42个循环。各组小鼠脑组织中Galectin-3和MMP-9 mRNA表达水平采用2-ΔΔCT法计算。
1.8 免疫组织化学染色检测各组小鼠脑组织中Galectin-3和MMP-9蛋白表达水平将脑组织石蜡切片经脱蜡水化,置入过氧化氢-甲醇溶液中封闭30 min,阻断内源性过氧化物酶活性,PBS冲洗,加入煮沸枸橼酸盐缓冲液修复抗原30 min,加入BSA封闭液封闭30 min,加入一抗兔抗鼠Galectin-3单克隆抗体和兔抗鼠MMP-9单克隆抗体(1:100)过夜孵育,加入生物素化二抗孵育30 min,滴加SABC孵育30 min,DAB显色,蒸馏水冲洗,然后复染、脱水、透明、封片。阴性对照以PBS代替一抗。染色结果判断标准:细胞质或细胞核中出现棕黄色颗粒为阳性细胞,在400倍视野下,采用Image-Pro Plus 6.0分析图像,计算每个高倍视野下Galectin-3和MMP-9的积分光密度(IOD)值,以IOD值代表Galectin-3和MMP-9蛋白表达水平。
1.9 统计学分析采用SPSS 20.0统计软件进行统计学分析。各组小鼠Longar评分和mNSS、脑梗死体积百分比、脑组织含水量、脑组织中Galectin-3和MMP-9 mRNA及蛋白表达水平均符合正态分布,以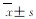
与对照组比较,模型组小鼠Longar评分和mNSS升高(P < 0.05);与模型组比较,尼莫地平组小鼠Longar评分和mNSS降低(P < 0.05)。见表 1。
(n=60, 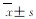 | |||||||||||||||||||||||||||||
| Group | Longar score | mNSS | |||||||||||||||||||||||||||
| Control | 0.58±0.16 | 1.32±0.24 | |||||||||||||||||||||||||||
| Model | 3.37±0.31* | 9.73±1.21* | |||||||||||||||||||||||||||
| Nimodipine | 1.86±0.28*△ | 5.76±1.18*△ | |||||||||||||||||||||||||||
| F | 1 754.513 | 1 093.332 | |||||||||||||||||||||||||||
| P | < 0.001 | < 0.001 | |||||||||||||||||||||||||||
| * P < 0.05 compared with control group; △ P < 0.05 compared with model group. | |||||||||||||||||||||||||||||
对照组小鼠无脑梗死;与对照组比较,模型组小鼠脑梗死体积百分比和脑组织含水量明显升高(P < 0.05);与模型组比较,尼莫地平组小鼠脑梗死体积百分比和脑组织含水量明显降低(P < 0.05)。见表 2和图 1(插页六)。
(n=15, 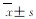 | |||||||||||||||||||||||||||||
| Group | Cerebral infarction volume | Water content in brain tissue | |||||||||||||||||||||||||||
| Control | 0 | 71.19±2.15 | |||||||||||||||||||||||||||
| Model | 45.26±5.67 | 82.07±2.25* | |||||||||||||||||||||||||||
| Nimodipine | 22.18±6.12△ | 76.28±2.07*△ | |||||||||||||||||||||||||||
| t/F | 10.714 | 95.459 | |||||||||||||||||||||||||||
| P | < 0.001 | < 0.001 | |||||||||||||||||||||||||||
| * P < 0.05 compared with control group; △ P < 0.05 compared with model group. | |||||||||||||||||||||||||||||
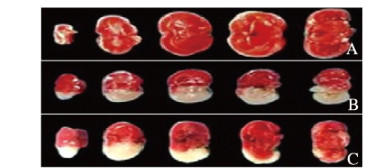
|
| A: Control group; B: Model group; C: Nimodipine group 图 1 TTC染色观察各组小鼠脑组织形态表现 Fig. 1 Morphology of brain tissue of mice in various groups observed by TTC staining |
|
|
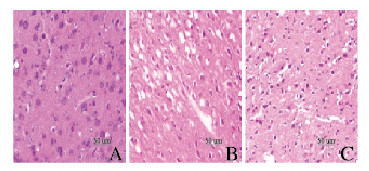
对照组小鼠脑细胞形态和结构正常,未见坏死灶和水肿;模型组小鼠脑细胞出现水肿,部分神经细胞形态皱缩,细胞核深染且固缩,脑皮质出现片状坏死,见炎细胞浸润;尼莫地平组小鼠脑细胞水肿和坏死较轻。见图 2(插页七)。
|
| A: Control group; B: Model group; C: Nimodipine group 图 2 各组小鼠脑组织形态表现(HE,×400) Fig. 2 Morphology of brain tissue of mice in various groups(HE, ×400) |
|
|
与对照组比较,模型组小鼠脑组织中Galectin-3和MMP-9 mRNA表达水平升高(P < 0.05);与模型组比较,尼莫地平组小鼠脑组织中Galectin-3和MMP-9 mRNA表达水平降低(P < 0.05)。见表 3。
(n=15,  | |||||||||||||||||||||||||||||
| Group | Galectin-3 mRNA | MMP-9 mRNA | |||||||||||||||||||||||||||
| Control | 1.00±0.05 | 1.00±0.04 | |||||||||||||||||||||||||||
| Model | 2.67±0.21* | 3.12±0.27* | |||||||||||||||||||||||||||
| Nimodipine | 1.73±0.24*△ | 1.94±0.23*△ | |||||||||||||||||||||||||||
| F | 302.692 | 398.571 | |||||||||||||||||||||||||||
| P | < 0.001 | < 0.001 | |||||||||||||||||||||||||||
| * P < 0.05 compared with control group; △ P < 0.05 compared with model group. | |||||||||||||||||||||||||||||
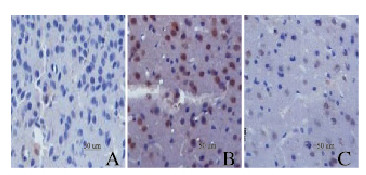
小鼠脑组织中Galectin-3和MMP-9阳性染色呈棕黄色,主要位于细胞质中。与对照组比较,模型组小鼠脑组织中Galectin-3和MMP-9蛋白表达水平升高(P < 0.05);与模型组比较,尼莫地平组小鼠脑组织中Galectin-3和MMP-9蛋白表达水平降低(P < 0.05)。见表 4、图 3(插页七)和图 4(插页七)。
(n=15, 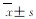 | |||||||||||||||||||||||||||||
| Group | Galectin-3 protein | MMP-9 protein | |||||||||||||||||||||||||||
| Control | 361.27±72.16 | 345.86±78.15 | |||||||||||||||||||||||||||
| Model | 8 257.29±462.17* | 8 716.29±471.28* | |||||||||||||||||||||||||||
| Nimodipine | 4 329.42±442.31*△ | 4 619.27±425.19*△ | |||||||||||||||||||||||||||
| F | 1 692.406 | 1 927.482 | |||||||||||||||||||||||||||
| P | < 0.01 | < 0.01 | |||||||||||||||||||||||||||
| * P < 0.05 compared with control group; △ P < 0.05 compared with model group. | |||||||||||||||||||||||||||||
|
| A: Control group; B: Model group; C: Nimodipine group 图 3 各组小鼠脑组织中Galectin-3表达(免疫组织化学,×400) Fig. 3 Expressions of Galectin-3 in brain tissue of mice in various groups(Immunohistochemistry, ×400) |
|
|
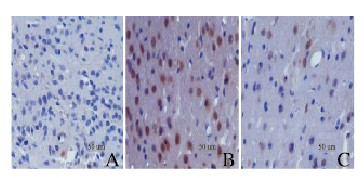
|
| A: Control group; B: Model group; C: Nimodipine group 图 4 各组小鼠脑组织中MMP-9表达(免疫组织化学,×400) Fig. 4 Expressions of MMP-9 in brain tissue of mice in various groups(Immunohistochemistry, ×400) |
|
|
脑梗死为常见的脑血管疾病之一,其致残率和致死率比较高,严重影响患者的生活质量。脑梗死发病机制复杂,探讨脑梗死的发病机制对其诊治具有重要价值,但由于脑梗死患者的脑组织取材不便,因此多通过建立脑梗死动物模型对脑梗死进行研究。线栓法是建立鼠急性脑梗死模型的常用方法,本研究采用线栓法建立小鼠脑梗死模型,发现建模后小鼠Longar评分和mNSS升高,脑梗死体积和脑组织含水量升高,HE染色显示小鼠脑组织出现脑梗死的病理学特征,表明本研究中小鼠急性脑梗死模型建立成功。
Galectin-3主要定位于细胞质和细胞核中,其分泌到细胞外可与细胞表面受体核糖蛋白相互作用发挥生物学功能[13]。研究[14]显示:Galectin-3在缺血性脑损伤中发挥重要作用,当脑组织受到损伤时,神经元等细胞受到破坏,释放出Galectin-3,Galectin-3通过通透性升高的血脑屏障进入血液中,导致血清Galectin-3水平升高。脑梗死时神经缺损程度越高、脑梗死体积越大、脑组织损伤越严重,则释放出的Galectin-3越多,血清Galectin-3水平越高,因此血清Galectin-3水平可反映脑梗死的严重程度。MMP-9是降解细胞外基质的主要蛋白水解酶之一,在动脉粥样硬化形成早期发挥重要作用,与动脉粥样硬化关系密切[15];MMP-9在动脉粥样硬化炎症反应中发挥重要作用,在动脉粥样硬化斑块内炎症细胞的聚集中亦发挥主要作用[16-17]。本文作者通过建立动物模型,观察脑梗死小鼠脑组织中Galectin-3和MMP-9表达情况发现:脑梗死小鼠脑组织中Galectin-3和MMP-9mRNA和蛋白表达水平升高,表明Galectin-3和MMP-9参与脑梗死的脑损伤过程。MMP-9可裂解Galectin-3,组成Galectin-3末端片段发挥作用;Galectin-3参与炎症反应过程,Galectin-3为一种强大的促炎因子,可促进单核细胞向巨噬细胞分化,并在血管内膜损害部位聚集[18],从而激发白细胞介素6(IL-6)和MMP-9等炎性因子的表达,促进脑梗死组织炎症反应,导致脑组织损伤,引起神经功能障碍[19-20],因此考虑Galectin-3和MMP-9可能通过促进炎症反应参与脑梗死的脑损伤过程。
尼莫地平是一种钙离子拮抗剂,可通过钙内流减少神经细胞凋亡,通过改善红细胞变形能力、降低血脑屏障通透性、改善血流变等增加脑组织供氧和供血,从而保护神经细胞;同时尼莫地平也具有抑制炎症反应的作用,可抑制C反应蛋白、白细胞介素8(IL-8)和肿瘤坏死因子α(TNF-α)等炎症因子表达抑制机体炎症反应[21-22]。本文作者对急性脑梗死大鼠给予尼莫地平发现:尼莫地平可降低小鼠Longar评分和mNSS,缩小脑梗死体积,降低脑组织含水量,降低脑组织中Galectin-3和MMP-9 mRNA及蛋白表达水平,表明尼莫地平对急性脑梗死小鼠的损伤脑组织具有保护作用,其机制可能与尼莫地平下调Galectin-3和MMP-9水平抑制炎症反应有关。尼莫地平可能通过下调Galectin-3抑制单核细胞向巨噬细胞分化,并抑制其在血管内膜损害部位聚集,从而抑制Galectin-3对MMP-9等炎性因子的诱导作用,降低MMP-9等炎症因子水平,从而抑制脑梗死组织炎症反应,发挥对损伤脑组织的保护作用。
| [1] |
THACKERAY J T, HUPE H C, WANG Y, et al. Myocardial inflammation predicts remodeling and neuroinflammation after myocardial infarction[J]. J Am Coll Cardiol, 2018, 71(3): 263-275. DOI:10.1016/j.jacc.2017.11.024 |
| [2] |
TSAI H F, WU C S, CHEN Y L, et al. Galectin-3 suppresses mucosal inflammation and reduces disease severity in experimental colitis[J]. J Mol Med (Berl), 2016, 94(5): 545-556. DOI:10.1007/s00109-015-1368-x |
| [3] |
LI Y, LIU H, XU L. Expression of MMP-9 in different degrees of chronic hepatitis B and its correlation with inflammation[J]. Exp Ther Med, 2018, 16(5): 4136-4140. |
| [4] |
NISHIKAWA H, NAKATSUKA Y, SHIBA M, et al. increased plasma galectin-3 preceding the development of delayed cerebral infarction and eventual poor outcome in non-severe aneurysmal subarachnoid hemorrhage[J]. Transl Stroke Res, 2018, 9(2): 110-119. DOI:10.1007/s12975-017-0564-0 |
| [5] |
FANNING J P, SEE HOE L E, PASSMORE M R, et al. neuron-specific enolase andmatrix metalloproteinase 9 signal perioperative silent brain infarctionduring or after transcatheter aortic valve implantation[J]. Am J Cardiol, 2019, 123(3): 434-439. |
| [6] |
HISAMATSU K, NIWA M, KOBAYASHI K, et al. Galectin-3 expression in hippocampal CA2 following transient forebrain ischemia and its inhibition by hypothermia or antiapoptotic agents[J]. Neuroreport, 2016, 27(5): 311-317. |
| [7] |
王翊飞, 张李涛, 褚正民, 等. 前列地尔注射液联合尼莫地平注射液治疗动脉瘤性蛛网膜下腔出血伴脑血管痉挛的临床研究[J]. 中国临床药理学杂志, 2016, 32(21): 1942-1945, 1949. |
| [8] |
MORAN J M, PEDRERA-ZAMORANO J D. Comments on "Efficacy and safety assessment of acupuncture andnimodipineto treat mild cognitive impairment after cerebralinfarction:a randomized controlled trial"[J]. BMC Complement Altern Med, 2017, 17(1): 119-120. |
| [9] |
刘天易. 芍药苷对大鼠脑缺血再灌注损伤细胞凋亡的影响及其作用机制[J]. 西部中医药, 2016, 29(5): 8-11. DOI:10.3969/j.issn.1004-6852.2016.05.003 |
| [10] |
张文芳, 王东, 崔景晶. 最佳线栓头端直径建立对小鼠脑缺血再灌注模型成功率的影响[J]. 中国康复医学杂志, 2019, 34(4): 386-391. DOI:10.3969/j.issn.1001-1242.2019.04.004 |
| [11] |
秦彦强, 孙忠人, 张亚娟, 等. 针刺预处理对脑梗死大鼠胆碱能抗炎通路的影响研究[J]. 实用心脑肺血管病杂志, 2015, 23(3): 29-33. DOI:10.3969/j.issn.1008-5971.2015.03.009 |
| [12] |
姜炎, 连亚军. 鼠神经生长因子对急性脑梗死大鼠炎性因子与神经功能的影响[J]. 中华实验外科杂志, 2016, 33(7): 1819-1821. DOI:10.3760/cma.j.issn.1001-9030.2016.07.034 |
| [13] |
MEDVEDEVA E A, BEREZIN I I, SHCHUKIN Y V. Galectin-3, markers of oxidative stress and renal dysfunction in patients with chronic heart failure[J]. Kardiologiia, 2017, 57(3): 46-50. |
| [14] |
刘浪. 急性脑梗死患者颈动脉硬化程度与血清Galectin-3表达水平的关系及阿托伐他汀钙的干预作用[J]. 卒中与神经疾病, 2017, 24(5): 420-422, 426. DOI:10.3969/j.issn.1007-0478.2017.05.009 |
| [15] |
FAN F, YANG J, XU Y, et al. MiR-539 targetsMMP-9 to regulate the permeability of blood-brainbarrier in ischemia/reperfusion injury of brain[J]. Neurochem Res, 2018, 43(12): 2260-2267. DOI:10.1007/s11064-018-2646-0 |
| [16] |
SARAMI FOROSHANI M, SOBHANI Z S, et al. Fullerenol nanoparticles decrease blood-brain barrier interruption and brainedema during cerebral ischemia-reperfusion injury probably by reduction of interleukin-6 and matrix metalloproteinase-9 transcription[J]. J Stroke Cerebrovasc Dis, 2018, 27(11): 3053-3065. DOI:10.1016/j.jstrokecerebrovasdis.2018.06.042 |
| [17] |
CHEN L, YANG Q, DING R, et al. Carotid thickness and atherosclerotic plaque stability, serum inflammation, serum MMP-2 and MMP-9 were associated with acute cerebral infarction[J]. Exp Ther Med, 2018, 16(6): 5253-5257. |
| [18] |
KAJITANI K, YANAGIMOTO K, NAKABEPPU Y. Serum galectin-3, but not galectin-1, levels are elevated in schizophrenia:implications for the role of inflammation[J]. Psychopharmacology (Berl), 2017, 234(19): 2919-2927. DOI:10.1007/s00213-017-4683-9 |
| [19] |
仲琳, 梁平平, 龚磊, 等. 半乳糖凝集素3对内皮细胞生长、迁移及炎症反应的影响[J]. 中国病理生理杂志, 2017, 33(6): 1065-1072. DOI:10.3969/j.issn.1000-4718.2017.06.018 |
| [20] |
车楠, 李莉, 李良昌, 等. 桦褐孔菌多糖通过PI3K/Akt/NF-κB/MMP-9抑制哮喘小鼠气道重构[J]. 中国免疫学杂志, 2018, 34(11): 1654-1657. DOI:10.3969/j.issn.1000-484X.2018.11.011 |
| [21] |
解晓燕, 李旭, 宋江庆, 等. 依达拉奉联合尼莫地平对颅脑损伤患者氧化应激、炎症因子的影响[J]. 海南医学院学报, 2016, 22(21): 2527-2529. |
| [22] |
TANG Y D, ZHENG X S, YING T T, et al. Nimodipine-mediated re-myelination after facial nerve crush injury in rats[J]. J Clin Neurosci, 2015, 22(10): 1661-1668. DOI:10.1016/j.jocn.2015.03.048 |
 2020, Vol. 46
2020, Vol. 46


