扩展功能
文章信息
- 杜静海, 陈春悠, 郭欣, 张静
- DU Jinghai, CHEN Chunyou, GUO Xin, ZHANG Jing
- 沉默赖氨酸乙酰基转移酶基因对人甲状腺乳头状癌细胞增殖和凋亡的影响
- Effects of silencing Kat5 gene on proliferation and apoptosis of thyroid papillary carcinoma cells
- 吉林大学学报(医学版), 2020, 46(03): 543-550
- Journal of Jilin University (Medicine Edition), 2020, 46(03): 543-550
- 10.13481/j.1671-587x.20200319
-
文章历史
- 收稿日期: 2019-07-08
多数腺乳头状癌患者可被治愈并长期存活[1]。但也有部分甲状腺乳头状癌恶性程度高,治疗后容易出现复发、远处转移和淋巴结转移等,预后较差[2]。因此探讨甲状腺乳头状癌的发病机制对抑制肿瘤进展和寻找新的治疗靶点具有重要意义。磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)/丝氨酸/苏氨酸激酶(serine/threonine kinase,AKT)信号通路为甲状腺癌细胞增殖和凋亡的主要信号通路,该信号通路的激活可促进甲状腺癌细胞增殖并抑制细胞凋亡[3]。赖氨酸乙酰基转移酶(lysine acetyltransferase,Kat5)在细胞增殖、细胞周期、细胞凋亡、胚胎发育、DNA损伤修复和基因转录调控等过程中发挥非常重要的作用[4-6]。结直肠癌组织中Kat5蛋白表达下调可作为预测结直肠癌预后和化疗效果的生物学指标[7],减少Kat5表达可促进前列腺癌转移[8],Kat5为恶性胸膜间皮瘤的治疗靶点[9],抑制Kat5介导的SMAD3乙酰化和转录活性可抑制黑素瘤进展[10],Kat5通过调节DNA修复促进乳腺癌发生[11]。WEN等[12]对Kat5在甲状腺未分化癌组织和细胞中表达的研究显示:甲状腺未分化癌组织和细胞中Kat5表达水平升高,上调Kat5表达水平可促进甲状腺未分化癌的增殖和侵袭,因此认为Kat5可能为甲状腺未分化癌的新生物标记物和治疗靶标,Kat5在甲状腺乳头状癌细胞中的表达及其作用机制尚未明确,本文作者对甲状腺乳头状癌细胞中Kat5表达水平及沉默Kat5基因对甲状腺乳头状癌细胞增殖、凋亡和PI3K/AKT信号通路的影响进行研究,探讨Kat5在甲状腺乳头状癌发生发展中的作用及其可能机制。
1 材料与方法 1.1 细胞、主要试剂和仪器人甲状腺乳头状癌BHP10-3、TPC-1和K1细胞和甲状腺上皮Nthy-ori3-1细胞(美国ATCC细胞库)。Kat5 siRNA及其阴性对照siRNA(美国OriGene公司),RPMI 1640培养基、胎牛血清和二喹啉甲酸(BCA)(美国Hycloneo公司),CCK-8试剂盒、膜联蛋白Ⅴ-异硫氰酸荧光素(Annexin Ⅴ-FITC)/碘化丙啶(PI)细胞凋亡试剂盒、反转录(RT)试剂盒、荧光定量聚合酶连反应(PCR)试剂盒(美国Sigma公司),兔抗人Kat5单克隆抗体、兔抗人周期蛋白依赖性激酶2(CDK2)单克隆抗体、兔抗人P21单克隆抗体、兔抗人P53单克隆抗体、兔抗人活化的含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved caspase-3)单克隆抗体、兔抗人PI3K单克隆抗体、兔抗人磷酸化PI3K(p-PI3K)单克隆抗体、兔抗人AKT单克隆抗体和兔抗人p-AKT单克隆抗体(美国Abcam公司)。ProFlex PCR仪(美国Life Technologics公司),CLARIOstar酶标仪(德国BMG Labtech公司)。
1.2 细胞培养将细胞置于含胎牛血清和青霉素-链霉素双抗的RPMI1640培养基中,常规培养,细胞生长至80%以上融合时采用胰蛋白酶消化,并传代培养,取第3代细胞进行后续研究。
1.3 荧光定量RT-PCR法检测甲状腺乳头状癌BHP10-3、TPC-1和K1细胞和甲状腺上皮Nthy-ori3-1细胞中Kat5 mRNA表达水平采用TRIzol提取甲状腺乳头状癌BHP10-3、TPC-1、K1细胞和甲状腺上皮Nthy-ori3-1细胞中总RNA,反转录cDNA(按照试剂盒说明书进行),RT-PCR法检测各种细胞中Kat5 mRNA表达水平。Kat5上游引物:5′-AATGTGGCCTGCATCCTAAC-3′,下游引物:5′-TGTTTTCCCTTCCACTTTGG-3′。PCR反应条件:95 ℃、20 s;95 ℃、15 s,56 ℃、30 s,72 ℃、30 s,共42个循环。每组设7个复孔,以β-actin为内参照。采用2-ΔΔCt法计算细胞中Kat5 mRNA水平。
1.4 Western blotting法检测甲状腺乳头状癌BHP10-3、TPC-1和K1细胞和甲状腺上皮Nthy-ori3-1细胞中Kat5蛋白表达水平甲状腺乳头状癌BHP10-3、TPC-1和K1细胞和甲状腺上皮Nthy-ori3-1细胞中加入RIPA裂解液,充分裂解30 min,16 000 g离心10 min,提取细胞总蛋白,BCA测定细胞蛋白浓度,采用SDS-PAGE分离蛋白,半干法转膜,脱脂牛奶封闭2 h,加入兔抗人Kat5单克隆抗体过夜孵育(一抗稀释比例1:300),加入二抗孵育1 h(二抗稀释比例1:5 000),加入显色液,暗室中曝光显影,以β-actin为内参照,每组设7个复孔。凝胶成像系统获得各种细胞中蛋白条带图片,Image J软件分析细胞中Kat5蛋白表达水平。Kat5蛋白表达水平=Kat5蛋白条带灰度值/β-actin蛋白条带灰度值。
1.5 细胞分组和各组甲状腺乳头状癌TPC-1细胞中Kat mRNA和蛋白表达水平将甲状腺乳头状癌TPC-1细胞分为空白对照组、阴性对照组和沉默Kat5组(si-Kat5组)。取各组对数生长期TPC-1细胞接种至6孔板中,每孔接种2×105个细胞,每组设7个复孔,培养至细胞达85%融合时进行转染。空白对照组甲状腺乳头状癌TPC-1细胞不转染,阴性对照组甲状腺乳头状癌TPC-1细胞转染阴性对照siRNA,si-Kat5组甲状腺乳头状癌TPC-1细胞转染Kat5 siRNA,转染步骤严格按照LipofectamineTM 2000试剂盒说明书进行。按照1.3和1.4中方法检测各组TPC-1细胞中Kat5 mRNA和蛋白表达水平。
1.6 CCK-8法检测各组甲状腺乳头状癌TPC-1细胞增殖活性转染48 h后取各组TPC-1细胞接种至96孔板中,每孔5×105个细胞,每组设7个复孔。分别在培养1、3和5 d时各孔加入10 μL CCK-8试剂,继续培养2 h,酶标仪测定波长490 nm处各孔细胞吸光度(A)值。以A值代表细胞增殖活性。
1.7 克隆形成实验检测各组甲状腺乳头状癌TPC-1细胞克隆形成率转染48 h后取各组TPC-1细胞,胰蛋白酶消化,制备成单细胞悬液,接种至6孔板中,每孔接种100 μL细胞悬液(细胞密度为2×103mL-1,即每孔200个细胞),每组设7个复孔。置于培养箱中培养,观察克隆形成情况,当肉眼可见克隆出现时终止培养,去除培养基,加入多聚甲醛固定10 min,去除固定液,加入结晶紫染色10 min,显微镜下计数克隆形成数,含有多于50个细胞的细胞集落为1个克隆,计算克隆形成率。克隆形成率=克隆形成数/接种细胞数×100%。
1.8 流式细胞术检测各组甲状腺乳头状癌TPC-1细胞凋亡率转染48 h后取各组TPC-1细胞,制备成密度为1×106mL-1单细胞悬液,采用流式细胞术检测各组甲状腺乳头状癌TPC-1细胞凋亡率,操作严格按照Annexin Ⅴ-FITC/PI细胞凋亡试剂盒说明书进行。每组重复实验7次。细胞凋亡率=凋亡细胞数/细胞总数×100%。
1.9 Western blotting法检测各组甲状腺乳头状癌TPC-1细胞中CDK2、P21、P53、cleaved caspase-3、PI3K、p-PI3K、AKT和p-AKT蛋白表达水平取转染48 h后各组TPC-1细胞,按照1.3中方法检测各种蛋白表达水平。
1.10 统计学分析采用SPSS20.0统计软件进行统计学分析。甲状腺乳头状癌BHP10-3、TPC-1和K1细胞及甲状腺上皮Nthy-ori3-1细胞中Kat5 mRNA和蛋白表达水平、细胞增殖活性、细胞克隆形成率、细胞凋亡率以及细胞中CDK2、P21、P53、cleaved caspase-3、PI3K、p-PI3K、AKT和p-AKT蛋白表达水平符合正态分布,以x±s表示,多组间样本均数比较采用方差分析,组间样本均数两两比较采用LSD-t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 甲状腺乳头状癌BHP10-3、TPC-1和K1细胞和甲状腺上皮Nthy-ori3-1细胞中Kat5mRNA和蛋白表达水平甲状腺乳头状癌BHP10-3、TPC-1和K1细胞中Kat5mRNA和蛋白表达水平均高于甲状腺上皮Nthy-ori3-1细胞(P < 0.05)。见图 1和表 1。因此选择Kat5mRNA和蛋白表达水平最高的TPC-1细胞进行后续研究。
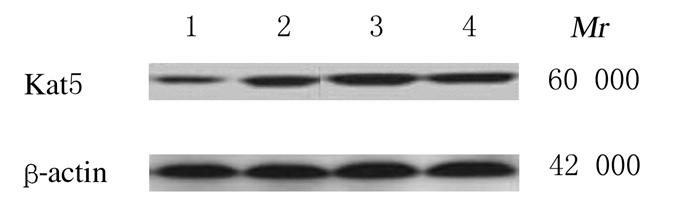
|
| Lane 1:Nthy-ori3-1 cells; Lane 2:BHP10-3 cells; Lane 3:TPC-1 cells; Lane 4:K1 cells. 图 1 Western blotting法检测甲状腺乳头状癌BHP10-3、TPC-1和K1细胞和甲状腺上皮Nthy-ori3-1细胞中Kat5蛋白表达电泳图 Fig. 1 Electrophoregram of expressions of Kat5 protein in thyroid papillary carcinoma BHP10-3, TPC-1, and K1 cells and thyroid epithelial Nthy-ori3-1 cells detected by Western blotting method |
|
|
| (n=7, x±s) | |||||||||||||||||||||||||||||
| Group | Kat5 mRNA | Kat5 protein | |||||||||||||||||||||||||||
| Nthy-ori3-1 cells | 1.00±0.11 | 0.14±0.03 | |||||||||||||||||||||||||||
| BHP10-3 cells | 1.89±0.13* | 0.68±0.11* | |||||||||||||||||||||||||||
| TPC-1 cells | 2.18±0.14* | 0.76±0.12* | |||||||||||||||||||||||||||
| K1 cells | 1.95±0.12* | 0.73±0.12* | |||||||||||||||||||||||||||
| F | 119.541 | 57.714 | |||||||||||||||||||||||||||
| P | 0.000 | 0.000 | |||||||||||||||||||||||||||
| *P < 0.05 vs Nthy-ori3-1 cells. | |||||||||||||||||||||||||||||
与空白对照组和阴性对照组比较,si-Kat5组甲状腺乳头状癌TPC-1细胞中Kat5mRNA和蛋白表达水平降低(P < 0.05);空白对照组和阴性对照组甲状腺乳头状癌TPC-1细胞中Kat5 mRNA和蛋白表达水平比较差异无统计学意义(P>0.05)。见图 2和表 2。
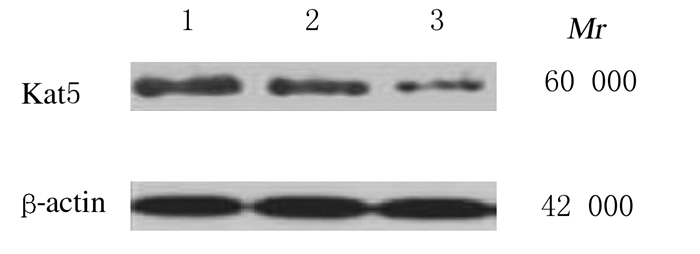
|
| Lane 1:Blank control group; Lane 2:Negative control group; Lane 3:si-Kat5 group. 图 2 Western blotting法检测各组甲状腺乳头状癌TPC-1细胞中Kat5蛋白表达电泳图 Fig. 2 Electrophoregram of expressions of Kat5 protein in thyroid papillary carcinoma TPC-1 cells in various groups detected by Western blotting method |
|
|
| (n=7, x±s) | |||||||||||||||||||||||||||||
| Group | Kat5 mRNA | Kat5 protein | |||||||||||||||||||||||||||
| Blank control | 1.00±0.08 | 0.74±0.13 | |||||||||||||||||||||||||||
| Negative control | 0.97±0.07 | 0.69±0.10 | |||||||||||||||||||||||||||
| si-Kat5 | 0.32±0.04*△ | 0.16±0.07*△ | |||||||||||||||||||||||||||
| F | 240.333 | 68.217 | |||||||||||||||||||||||||||
| P | 0.000 | 0.000 | |||||||||||||||||||||||||||
| *P < 0.05 vs blank control group;△P < 0.05 vs negative control group. | |||||||||||||||||||||||||||||
与空白对照组和阴性对照组比较,si-Kat5组甲状腺乳头状癌TPC-1细胞增殖活性降低(P < 0.05);空白对照组和阴性对照组甲状腺乳头状癌TPC-1细胞增殖活性比较差异无统计学意义(P>0.05)。见表 3。
| (n=7, x±s) | |||||||||||||||||||||||||||||
| Group | Proliferation activity | ||||||||||||||||||||||||||||
| (t/d) 1 | 3 | 5 | |||||||||||||||||||||||||||
| Blank control | 0.98±0.09 | 1.95±0.32 | 2.78±0.41 | ||||||||||||||||||||||||||
| Negative control | 0.96±0.11 | 1.89±0.28 | 2.75±0.38 | ||||||||||||||||||||||||||
| si-Kat5 | 0.85±0.07*△ | 1.43±0.21*△ | 1.84±0.31*△ | ||||||||||||||||||||||||||
| F | 4.100 | 7.557 | 14.670 | ||||||||||||||||||||||||||
| P | 0.034 | 0.004 | 0.000 | ||||||||||||||||||||||||||
| *P < 0.05 vs blank control group;△P < 0.05 vs negative control group. | |||||||||||||||||||||||||||||
与空白对照组和阴性对照组比较,si-Kat5组甲状腺乳头状癌TPC-1细胞克隆形成率降低(P < 0.05);空白对照组和阴性对照组甲状腺乳头状癌TPC-1细胞克隆形成率比较差异无统计学意义(P>0.05)。见图 3(插页六)和表 4。
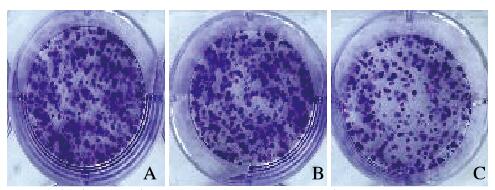
|
| A:Blank control group; B: Negative control; C:si-Kat5 group. 图 3 克隆形成实验检测各组甲状腺乳头状癌TPC-1细胞克隆形成情况 Fig. 3 Formation of clones of thyroid papillary carcinoma TPC-1 cells in various groups determined by clonal formation assay |
|
|
与空白对照组和阴性对照组比较,si-Kat5组甲状腺乳头状癌TPC-1细胞凋亡率升高(P < 0.05);空白对照组和阴性对照组甲状腺乳头状癌TPC-1细胞凋亡率比较差异无统计学意义(P>0.05)。见图 4和表 4。
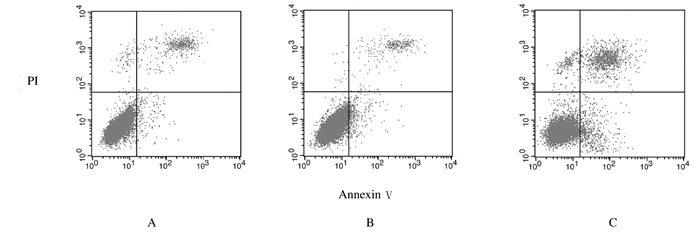
|
| A:Blank control group; B: Negative controlgroup; C:si-Kat5 group. 图 4 流式细胞术检测各组甲状腺乳头状癌TPC-1细胞凋亡率 Fig. 4 Apoptotic rates of thyroid papillary carcinoma TPC-1 cells in various groups detected by flow cytometry |
|
|
| (n=7, x±s, η/%) | |||||||||||||||||||||||||||||
| Group | Clone formation rate | Apoptotic rate | |||||||||||||||||||||||||||
| Blank control | 55.64±5.72 | 5.64±1.23 | |||||||||||||||||||||||||||
| Negative control | 54.73±5.64 | 6.12±1.31 | |||||||||||||||||||||||||||
| si-Kat5 | 28.49±4.83*△ | 19.64±1.42*△ | |||||||||||||||||||||||||||
| F | 56.828 | 252.902 | |||||||||||||||||||||||||||
| P | 0.000 | 0.000 | |||||||||||||||||||||||||||
| *P < 0.05 vs blank control group;△P < 0.05 vs negative control group. | |||||||||||||||||||||||||||||
与空白对照组和阴性对照组比较,si-Kat5组甲状腺乳头状癌TPC-1细胞中CDK2蛋白表达水平降低(P < 0.05),P21、P53和cleaved caspase-3蛋白表达水平升高(P < 0.05);空白对照组和阴性对照组甲状腺乳头状癌TPC-1细胞中CDK2、P21、P53和cleaved caspase-3蛋白表达水平比较差异无统计学意义(P>0.05)。见图 5和表 5。

|
| Lane 1:Blank control group; Lane2:Negative control group; Lane 3:si-Kat5 group. 图 5 Western blotting法检测各组甲状腺乳头状癌TPC-1细胞中CDK2、P21、P53和cleaved caspase-3蛋白表达电泳图 Fig. 5 Electrophoregram of expressions of CDK2, P21, P53, and cleaved caspase-3 proteins in thyroid papillary carcinoma TPC-1 cells in various groups detected by Western blotting method |
|
|
| (n=7, x±s) | |||||||||||||||||||||||||||||
| Group | CDK2 | P21 | P53 | Cleaved caspase-3 | |||||||||||||||||||||||||
| Blank control | 0.28±0.05 | 0.16±0.04 | 0.13±0.04 | 0.21±0.05 | |||||||||||||||||||||||||
| Negative control | 0.26±0.04 | 0.17±0.03 | 0.11±0.02 | 0.19±0.03 | |||||||||||||||||||||||||
| si-Kat5 | 0.12±0.02*△ | 0.93±0.12*△ | 0.94±0.15*△ | 0.87±0.13*△ | |||||||||||||||||||||||||
| F | 35.467 | 342.432 | 192.200 | 154.897 | |||||||||||||||||||||||||
| P | 0.000 | 0.000 | 0.000 | 0.000 | |||||||||||||||||||||||||
| *P<0.05 vs blank control group;△P<0.05 vs negative control group | |||||||||||||||||||||||||||||
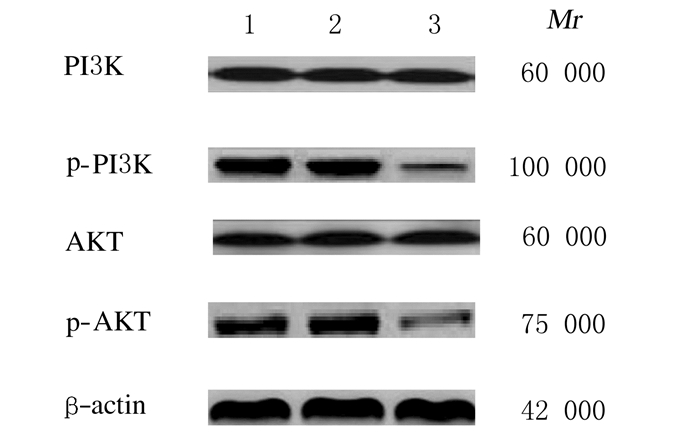
p-AKT蛋白表达水平各组甲状腺乳头状癌TPC-1细胞中PI3K和AKT蛋白表达水平比较差异无统计学意义(P>0.05);与空白对照组和阴性对照组比较,si-Kat5组甲状腺乳头状癌TPC-1细胞中p-PI3K和p-AKT蛋白表达水平降低(P < 0.05);空白对照组和阴性对照组甲状腺乳头状癌TPC-1细胞中p-PI3K和p-AKT蛋白表达水平比较差异无统计学意义(P>0.05)。见图 6和表 6。
|
| Lane 1:Blank control group; Lane 2:Negative control group; Lane 3:si-Kat5 group. 图 6 Western blotting检测各组甲状腺乳头状癌TPC-1细胞中PI3K、p-PI3K、AKT和p-AKT蛋白表达电泳图 Fig. 6 Electrophoregram of expressions of PI3K, p-PI3K, AKT and p-AKT proteins in thyroid papillary carcinoma TPC-1 cells in various groups detected by Western blotting method |
|
|
| (n=7, x±s) | |||||||||||||||||||||||||||||
| Group | PI3K | p-PI3K | AKT | p-AKT | |||||||||||||||||||||||||
| Blank control | 0.71±0.15 | 0.79±0.11 | 0.46±0.08 | 0.57±0.11 | |||||||||||||||||||||||||
| Negative control | 0.69±0.14 | 0.78±0.12 | 0.47±0.09 | 0.59±0.08 | |||||||||||||||||||||||||
| si-Kat5 | 0.70±0.13 | 0.09±0.03*△ | 0.48±0.07 | 0.12±0.04*△ | |||||||||||||||||||||||||
| F | 0.036 | 123.420 | 0.108 | 73.796 | |||||||||||||||||||||||||
| P | 0.965 | 0.000 | 0.898 | 0.000 | |||||||||||||||||||||||||
| *P < 0.05 vs blank control group;△P < 0.05 vs negative control group | |||||||||||||||||||||||||||||
本研究结果显示:甲状腺乳头状癌细胞中Kat5水平升高,沉默(下调)甲状腺乳头状癌细胞中Kat5表达水平可抑制甲状腺乳头状癌TPC-1细胞增殖、促进细胞凋亡,降低细胞中CDK2蛋白表达水平,升高细胞中P21、P53、cleaved caspase-3蛋白表达水平。CDK2是丝氨酸/苏氨酸蛋白激酶,为细胞周期蛋白依赖性激酶家族成员,在细胞从G1期向S期过渡过程中发挥重要作用,CDK2功能和活性在调节细胞周期运转中发挥关键性作用,与细胞周期调控关系非常密切[13]。P21为CKI基因,CKI可抑制CDK2复合物活性;P21参与细胞分化、增殖、凋亡和衰老等过程的调节;P21为P53的下游调控因子,其启动子上有P53结合位点;P21参与P53介导的细胞周期停止过.程[14]。P53在细胞周期阻滞和抑制肿瘤发生中发挥重要作用[15]。细胞凋亡有多条通路参与,caspase途径在细胞凋亡中发挥重要作用,caspase-3为caspase级联反应下游蛋白酶,在调节细胞凋亡中发挥主导作用,被活化的cleaved caspase-3可使细胞凋亡进入不可逆阶段,因此cleaved caspase-3可作为检测细胞凋亡的主要指标[16]。细胞中CDK2蛋白表达水平降低,P21、P53和cleaved caspase-3蛋白表达水平升高表明:细胞增殖受到抑制,细胞凋亡得到促进。本研究结果表明:沉默Kat5基因水平可抑制甲状腺乳头状癌TCP-1细胞增殖并促进其凋亡。
PI3K/AKT信号通路为一条重要的信号转导通路[17],在甲状腺癌发生发展中发挥重要作用,甲状腺癌中PI3K/AKT信号通路处于激活状态,可促进甲状腺癌发生发展,抑制PI3K/AKT信号通路可抑制甲状腺癌的发生发展[18-19]。PI3K通路下游有多种效应底物,AKT是PI3K/AKT信号转导通路下游的直接底物,p-AKT可参与恶性肿瘤细胞的增殖和凋亡过程,增加恶性肿瘤细胞的运动能力[20-21]。Kat5通过多种信号通路发挥作用,研究[22-23]显示:Kat5可通过PI3K/AKT信号通路调节前列腺癌细胞的增殖过程。因为甲状腺癌中PI3K/AKT信号通路激活,Kat5可通过PI3K/AKT信号通路影响恶性肿瘤细胞的增殖,推测Kat5可能通过PI3K/AKT信号通路影响甲状腺癌细胞增殖和凋亡。本文作者发现:沉默甲状腺乳头状癌细胞中Kat5基因可降低细胞中p-PI3K和p-AKT蛋白表达水平,因此Kat5可能通过抑制PI3K/AKT信号通路抑制甲状腺乳头状癌细胞的增殖并促进其凋亡。
综上所述,甲状腺乳头状癌细胞中Kat5表达水平升高,下调Kat5表达水平可能通过抑制PI3K/AKT信号通路抑制甲状腺乳头状癌发生发展。
| [1] |
NATH M C, ERICKSON L A. Aggressive variants of papillary thyroid carcinoma:hobnail, tall cell, columnar, and solid[J]. Adv Anat Pathol, 2018, 25(3): 172-179. DOI:10.1097/PAP.0000000000000184 |
| [2] |
HAJEER M H, AWAD H A, ABDULLAH N I, et al. The rising trend in papillary thyroid carcinoma. True increase or over diagnosis?[J]. Saudi Med J, 2018, 39(2): 147-153. DOI:10.15537/smj.2018.2.21211 |
| [3] |
YE K, LI J, LI X, et al. Ang1/Tie2 induces cell proliferation and migration in human papillary thyroid carcinoma via the PI3K/AKT pathway[J]. Oncol Lett, 2018, 15(1): 1313-1318. |
| [4] |
ADAMOWICZ M, VERMEZOVIC J, D'ADDA DI FAGAGNA F. NOTCH1 inhibits activation of ATM by impairing the formation of an ATM-FOXO3a-Kat5/Tip60 complex[J]. Cell Rep, 2016, 16(8): 2068-2076. DOI:10.1016/j.celrep.2016.07.038 |
| [5] |
刘江, 朱君玲, 张亚历, 等. FAM135B与赖氨酸乙酰转移酶在维吾尔族食管鳞状细胞癌中的表达[J]. 南方医科大学学报, 2018, 38(2): 224-228. DOI:10.3969/j.issn.1673-4254.2018.02.17 |
| [6] |
ACHAYA D, HAINER S J, YOON Y, et al. KAT-independent gene regulation by Tip60 promotes ESC self-renewal but not pluripotency[J]. Cell Rep, 2017, 19(4): 671-679. DOI:10.1016/j.celrep.2017.04.001 |
| [7] |
亓飞. 结直肠癌组织中Tip60蛋白的表达变化及意义[J]. 山东医药, 2017, 57(25): 56-58. DOI:10.3969/j.issn.1002-266X.2017.25.018 |
| [8] |
LIN C Y, JAN Y J, KUO L K, et al. Elevation of androgen receptor promotes prostate cancer metastasis by induction of epithelial-mesenchymal transition and reduction of KAT5[J]. Cancer Sci, 2018, 109(11): 3564-3574. DOI:10.1111/cas.13776 |
| [9] |
CREGAN S, MCDONAGH L, GAO Y, et al. KAT5(Tip60) is a potential therapeutic target in malignant pleural mesothelioma[J]. Int J Oncol, 2016, 48(3): 1290-1296. DOI:10.3892/ijo.2016.3335 |
| [10] |
LI K, ZHANG T T, WANG F, et al. Metformin suppresses melanoma progression by inhibiting KAT5-mediated SMAD3 acetylation, transcriptional activity and TRIB3 expression[J]. Oncogene, 2018, 37(22): 2967-2981. DOI:10.1038/s41388-018-0172-9 |
| [11] |
BASSI C, LI Y T, KHU K, et al. The acetyltransferase Tip60 contributes to mammary tumorigenesis by modulating DNA repair[J]. Cell Death Differ, 2016, 23(7): 1198-1208. DOI:10.1038/cdd.2015.173 |
| [12] |
WEI X, CAI S, BOOHAKER R J, et al. KAT5 promotes invasion and metastasis through C-MYC stabilization in ATC[J]. Endocr Relat Cancer, 2019, 26(1): 141-151. |
| [13] |
LIU Z Y, LIU H, YUAN X, et al. Downregulation of Pim-2 induces cell cycle arrest in the G0/G1 phase via the p53-non-dependent p21 signaling pathway[J]. Oncol Lett, 2018, 15(4): 4079-4086. |
| [14] |
HUANG X C, QIAO Y L, ZHOU Y X, et al. Ureaplasma spp. lipid-associated membrane proteins induce human monocyte U937 cell cycle arrest through p53-independent p21 pathway[J]. Int J Med Microbiol, 2018, 308(7): 819-828. DOI:10.1016/j.ijmm.2018.07.005 |
| [15] |
LIN C P, LIN C S, LIN H H, et al. Bergapten induces G1 arrest and pro-apoptotic cascade in colorectal cancer cells associating with p53/p21/PTEN axis[J]. Environ Toxicol, 2019, 34(3): 303-311. |
| [16] |
RUAN J, GAO S, YANG J, et al. WT1 protein is cleaved by caspase-3 in apoptotic leukemic cells[J]. Leuk Lymphoma, 2018, 59(1): 162-170. |
| [17] |
江泽友, 徐灿, 葛一漫, 等. shRNA干扰IRS-1基因通过PI3K/AKT通路对人乳头状甲状腺癌细胞TPC-1增殖和转移能力的调控作用[J]. 中国免疫学杂志, 2018, 34(11): 1674-1678. DOI:10.3969/j.issn.1000-484X.2018.11.015 |
| [18] |
ZHENG Z, ZHOU X, CAI Y, et al. TEKT4 promotes papillary thyroid cancer cell proliferation, colony formation, and metastasis through activating PI3K/Akt pathway[J]. Endocr Pathol, 2018, 29(4): 310-316. DOI:10.1007/s12022-018-9549-0 |
| [19] |
LIU C, FENG Z, CHEN T, et al. Downregulation of NEAT1 reverses the radioactive iodine resistance of papillary thyroid carcinoma cell via miR-101-3p/FN1/PI3K-AKTsignaling pathway[J]. Cell Cycle, 2019, 18(2): 167-203. |
| [20] |
LIANG W, SUN F. Identification of key genes of papillary thyroid cancer using integrated bioinformatics analysis[J]. J Endocrinol Invest, 2018, 41(10): 1237-1245. DOI:10.1007/s40618-018-0859-3 |
| [21] |
ZHANG J, DU Y, ZHANG X, et al. Downregulation of BANCR promotes aggressiveness in papillary thyroid cancer via the MAPK and PI3K pathways[J]. J Cancer, 2018, 9(7): 1318-1328. DOI:10.7150/jca.20150 |
| [22] |
HE W, ZHANG M G, WANG X J, et al. Kat5 and KAT6B are in positive regulation on cell proliferation of prostate cancer through PI3K-AKTsignaling[J]. Int J Clin Exp Pathol, 2013, 6(12): 2864-2871. |
| [23] |
张丽平, 刘婷婷, 滕卫平. 基于GEO数据库对甲状腺乳头状癌的靶基因分析研究[J]. 中国实用内科杂志, 2020, 40(3): 237-241. |
 2020, Vol. 46
2020, Vol. 46


