扩展功能
文章信息
- 刘东宁, 杨明锡, 刘歆婵, 李艳, 武洲, 于维先
- LIU Dongning, YANG Mingxi, LIU Xinchan, LI Yan, WU Zhou, YU Weixian
- 锌掺杂碳点联合蓝光照射对金黄色葡萄球菌生长及其生物膜形成的抑制作用
- Inhibitory effects of zinc-doped carbon dots combined with blue light radiation on growth and biofilm formation of Staphylococcus aureus
- 吉林大学学报(医学版), 2020, 46(03): 515-522
- Journal of Jilin University (Medicine Edition), 2020, 46(03): 515-522
- 10.13481/j.1671-587x.20200315
-
文章历史
- 收稿日期: 2019-08-04
2. 吉林大学超分子结构与材料国家重点实验室, 吉林 长春 130012;
3. 吉林大学口腔医院老年口腔科, 吉林 长春 130021;
4. 日本九州大学大学院齿学研究院, 日本 福冈 812-8581;
5. 吉林省牙发育及颌骨重塑与再生重点实验室, 吉林 长春 130021
2. State Key Laboratory of Supramolecular Structure and Materials, Jilin University, Changchun 130012, China;
3. Department of Geriatric Dentistry, Stomatology Hospital, Jilin University, Changchun 130021, China;
4. Deparment of Dental Medicine, Graduated School, Kyushu University, Fukuoka 812-8581, Japan;
5. Jilin Provincial Key Laboratory of Tooth Development and Jaw Bone Remodeling and Regeneration, Changchun 130021, China
细菌感染常导致许多严重疾病的发生,其中金黄色葡萄球菌是常见的致病菌之一,给社会带来了巨大的公共卫生负担。而病原菌对抗生素耐药性的增加,使金黄色葡萄球菌的有效防治更加困难。细菌生物膜的形成及其难以清除是导致细菌耐药和引起持续性感染的主要原因之一,这推动了对抗菌策略的探索,如纳米技术、光动力抗菌疗法(antimicrobial photodynamic therapy, APDT)和微电技术等[1]。光动力疗法(photodynamic therapy, PDT)是治疗癌症特别是皮肤癌的手段之一。近年来,PDT被应用于治疗包括细菌在内的多种感染性疾病,并被命名为APDT [2]。研究[3-4]显示:APDT机制为激光激发光敏剂产生的活性氧作用于细胞膜,从而破坏生物膜结构及其他功能单位引起微生物死亡或凋亡,这种抗菌机制使细菌不易产生耐药性。
研究[5]显示:碳点(carbon dots, CDs)又称碳纳米点,是一种类量子点状纳米材料,其光学性质及光催化功能类似于传统纳米半导体[6-7],CDs不仅可产生荧光发射[8-9],还可以驱动各种催化过程,具有较强光动力效应[10],这些特性使CDs作为APDT光敏剂具有较好的应用前景。LIU等[11]以甲硝唑为前体合成荧光CDs,明确了其对牙龈卟啉单胞菌具有选择性抗菌活性。KUMARI等[12]合成了由CDs、原卟啉Ⅸ(PpⅨ)和DNA组成的杂交水凝胶,发现CDs能量转移对革兰阳性菌(金黄色葡萄球菌)有杀伤作用;KOVÁCOVÁ等[13]合成CDs复合材料发现:蓝光照射时间达到60 min时其对金黄色葡萄球菌和大肠杆菌的生长有抑制作用。上述研究虽明确了CDs的抗菌性能但同时体现出其不足,例如细胞毒性大、制备方法复杂、原材料不易获得和光照时间过长等。本实验以柠檬酸、乙二胺和醋酸锌为碳源通过简单、绿色的水热法制备了水溶性好、无毒及光稳定性好的锌掺杂CDs,在蓝光激发CDs的条件下,明确其对金黄色葡萄球菌及其生物膜形成的抑制作用,并初步探讨相关机制,以期为锌掺杂CDs在该领域的应用提供理论依据。
1 材料与方法 1.1 细胞、主要试剂和仪器小鼠成纤维细胞系L929和小鼠前成骨细胞系MC3T3-E1(中科院细胞库)。H-DMEM培养基、胎牛血清和青-链霉素双抗(美国Gibco公司),细胞增殖-毒性检测试剂盒CCK-8(日本Dojindo公司),LB培养基(青岛科技园海博生物公司),金黄色葡萄球菌ATCC25923为吉林大学口腔医院实验室保存菌株,结晶紫染料(珠海迪尔生物工程有限公司),N-乙酰半胱氨酸(N-acetylcysteine, NAC)(上海碧云天生物技术有限公司),醋酸锌(北京化学试剂)。LED蓝光灯(波长400~500 nm, 15 W, 中山市迈能照明科技有限公司),CO2恒温细胞培养箱(日本SANYO公司),台式高速离心机(德国Eppendorf公司),马弗炉(型号JKKZ4-10, 济南精密科学仪器仪表有限公司),透射电子显微镜(TEM)(型号JEM-2100F, 日本电子株式会社),傅立叶红外光谱仪(FT-IR)(型号AVATAR360, 美国Nicolet Instrument公司),荧光光谱仪(型号RF-5301PC, 日本岛津公司),酶标检测仪(美国Bio-TEK公司)。
1.2 CDs的制备取5 mmol·L-1柠檬酸、5 mmol·L-1乙二胺和2 mmol·L-1醋酸锌,溶解于10 mL去离子水中, 搅拌均匀后, 移入10 mL反应釜中,在200℃条件下于马弗炉中反应6 h,待反应釜冷却至室温后,将反应釜中液体用0.22 μm滤器过滤,经PBS渗析48 h,渗析液每6 h更换1次,获得CDs样本待后续实验。
1.3 CDs的表征 1.3.1 TEM检测CDs形态、粒径和分布取1 mL CDs溶液,采用9 mL去离子水稀释后,取10 μL滴加在直径为3 mm的V3超薄碳网上,待晾干后,观察CDs形态,采用Nano Measurer软件计算CDs粒径大小和分布。
1.3.2 CDs荧光光谱仪检测取0.5 mLCDs溶液于石英比色皿中,稀释至有效测定浓度,荧光发射光谱的扫描范围设置为220 ~750 nm,狭缝宽度为5 nm,扫描速度为2 000 nm·min-1,扫描获得CDs的荧光光谱。
1.3.3 FT-IR检测取适量溴化钾粉末于玛瑙研钵中,加入1滴CDs溶液,待烘干后快速研磨成粉末,采用模具加压形成均匀透明薄片,进行红外光谱测试(400~4 000 cm-1波段),通过傅立叶变换获得CDs的FT-IR光谱。
1.4 各组细胞增殖率检测采用CCK-8法检测CDs的细胞毒性,实验分为空白对照组和CDs组,分别取对数生长期L929和MC3T3-E1细胞,以每孔1×104个细胞的密度接种至96孔板,于37 ℃、5%CO2孵育箱中培养24 h,然后换更为含有不同浓度(50、75和100 mg·L-1)CDs的培养液,空白对照组仅加入细胞培养液,继续培养24 h。采用PBS洗涤各孔,加入含有10 μ L CCK-8的培养液100 μL,孵育2 h,酶标仪检测450 nm波长处各孔的吸光度(A)值,计算细胞增殖率。细胞增殖率=(实验组A值/空白对照组A值)×100%。
1.5 各组菌液浓度检测采菌液制备:采用灭菌环挑取金黄色葡萄球菌单个菌落,接种于LB培养液,37 ℃孵育18~24 h后,将上述菌液于600 nm波长处测定A值,使A(600)=0.5时,相应菌种浓度为1×108 CFU·mL-1, 按1:100稀释后待用。实验分为空白对照组、单独CDs溶液组、单独蓝光照射组和CDs+蓝光照射组。单独CDs溶液组:CDs溶液用LB培养液稀释至100、150和200 mg·L-1待用, 取100 μL实验菌液于96孔板中,分别加入100 μL(50、75和100 mg·L-1)CDs溶液,摇匀;单独蓝光照射组:照射时间为10、20和40 min。取100 μL实验菌液于96孔板,每孔再加入100 μL LB培养液,摇匀,采用蓝光进行照射,为使样本光照均匀,灯与样本间距离为50 cm;CDs+蓝光照射组:取100 μL实验菌液于96孔板,分别加入100 μL上述CDs溶液,摇匀,蓝光分别照射10、20和40 min;空白对照组:取100 μL实验菌液于96孔板,仅加入100 μL培养液,摇匀。以上各组菌液避光培养24 h, 于波长600 nm处测得A值,以A(600)值代表菌液浓度。
1.6 各组金黄色葡萄球菌生物膜形成量检测采用96孔板结晶紫染色法,分组同1.5。将培养24 h的成熟生物膜采用PBS洗涤2次,加入甲醇固定,而后加入0.1%结晶紫溶液染色15 min, 弃去染色液,PBS洗涤3次,干燥,最后加入95%乙醇溶解,于波长590 nm处测定A值,以A(590)值代表各组金黄色葡萄球菌生物膜形成量。
1.7 加入NAC后各组菌液浓度、金黄色葡萄球菌生物膜形成量检测和菌落计数观察加入活性氧清除剂NAC和蓝光照射40 min后,100 mg·L-1 CDs溶液中金黄色葡萄球菌生长情况及生物膜形成量。实验采用快速分光光度法、平板菌落计数法和结晶紫染色法检测。快速分光光度法:实验分为对照组、100 mg·L-1 CDs组、0.5 mmol·L-1 NAC组和0.5 mmol·L-1 NAC + 100 mg·L-1 CDs组,实验步骤同1.5。平板法:取无菌试管4支,分别加入实验菌液0.5 mL,第1管加入0.5 mL培养液,第2管加入0.5 mL上述CDs溶液,第3管加入0.5 mLCDs溶液后加入0.5 mmol·L-1 NAC,第4管加入0.5 mL培养液后加入0.5 mmol·L-1 NAC,混匀,蓝光照射40 min,避光培养。24 h后在各试管中取出0.3 mL按1:100稀释后取20 μL均匀涂布于固体LB培养平板并标记,培养24 h,观察菌落生长情况,记录菌落计数。结晶紫染色法:分组同上,实验步骤同1.6。
1.8 统计学分析采用SPSS16.0统计软件对数据进行统计学分析。各组细胞增殖率、细菌菌液浓度、金黄色葡萄球菌生物膜形成量和菌落计数符合正态分布,以x ±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
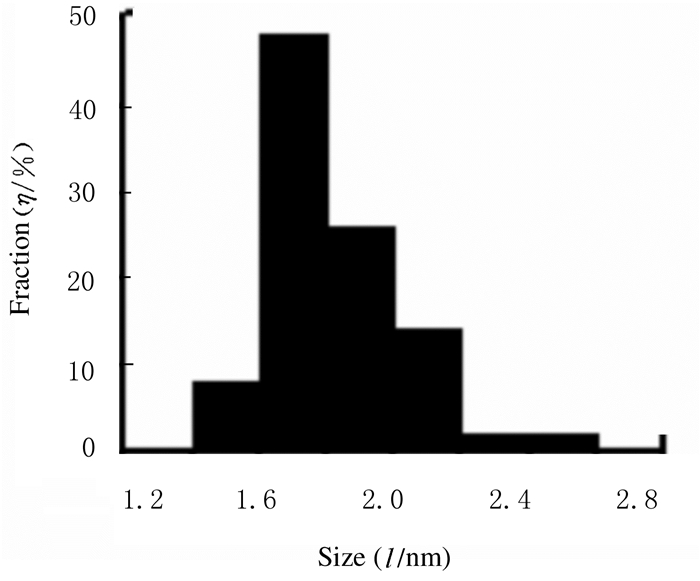
2 结果 2.1 CDs形态、粒径和分布在TEM下制备的CDs为均匀分布的球形纳米颗粒,在高分辨TEM (HRTEM)下CDs不具有明显的晶格结构,为无定型状态, 见图 1。Nano Measurer软件统计50个CDs粒径显示:CDs粒径为1.4~2.6 nm,平均粒径为1.8 nm,CDs粒径及分布见图 2。

|
| 图 1 TEM(A)和HRTEM(B)下CDs形态表现(Bar=60 nm) Fig. 1 Morphology of CDs under TEM( A) and HRTEM (B)(Bar=50 nm) |
|
|
|
| 图 2 CDs粒径和分布 Fig. 2 Particle sizes and distribution of CDs |
|
|
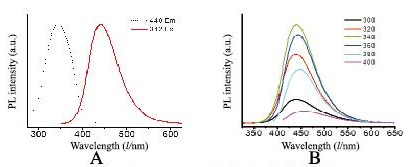
最佳激发波长为342 nm,最佳发射波长为440 nm,此外CDs具有随激发波长而改变发射波长的性质,即激发依赖性。CDs荧光光谱见图 3(插页六)。
|
| 图 3 CDs的荧光光谱结果 Fig. 3 Fluorescence spectra of CDs |
|
|
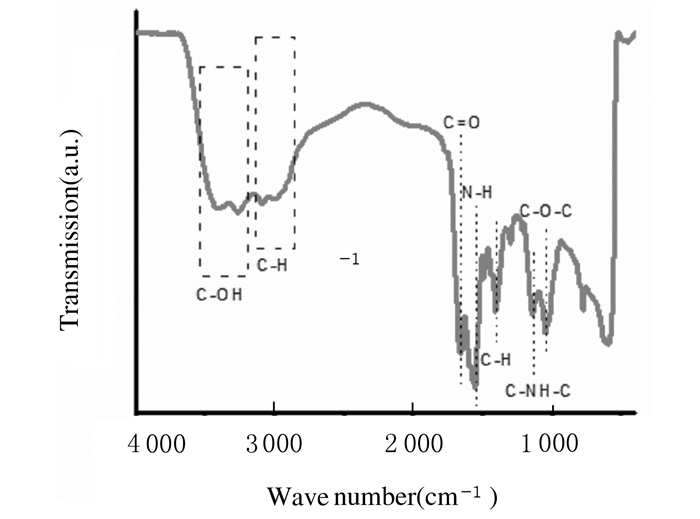
CDs表面具有羟基、羧基、氨基和环氧基团等官能团,3 500 cm-1附近的宽峰为缔合OH的伸缩振动吸收峰,1 700 cm-1附近为C=O双键伸缩振动峰, 1 500 cm-1附近为N-H伸缩振动峰,3 000 cm-1附近和1 400 cm-1附近为C-H伸缩振动吸收峰,1 200 cm-1附近为C-NH-C伸缩振动吸收峰,1 000 cm-1附近为C-O-C的对称伸缩振动峰,这些基团赋予了CDs良好的稳定性和水溶性。CDs的FT-IR光谱见图 4。
|
| 图 4 CDs的FT-IR光谱 Fig. 4 FT-IR spectrum of CDs |
|
|
当CDs与细胞共培养24 h后,随着CDs浓度增加,细胞增殖率相应减少;100 mg·L-1 CDs组L929和MC3T3-E1细胞增殖率与空白对照组比较差异有统计学意义(P < 0.05或P < 0.01),L929细胞和MC3T3-E1细胞增殖率均达80%,表明CDs对细胞活性影响较小。见表 1。
| (n=3, x ±s, η/%) | |||||||||||||||||||||||||||||
| Group | Proliferation rate | ||||||||||||||||||||||||||||
| L929 cells | MC3T3-E1 cells | ||||||||||||||||||||||||||||
| Blank control | 100.001±0.368 | 100.000±4.211 | |||||||||||||||||||||||||||
| CDs(mg·L-1) | |||||||||||||||||||||||||||||
| 50 | 100.717±2.411 | 104.125±6.142 | |||||||||||||||||||||||||||
| 75 | 97.197±1.151 | 88.806±5.260△ | |||||||||||||||||||||||||||
| 100 | 80.052±1.155** | 80.253±1.449* | |||||||||||||||||||||||||||
| * P < 0.05, * * P < 0.01 compared with blank control group. | |||||||||||||||||||||||||||||
单独CDs溶液组菌液浓度与空白对照组比较差异无统计学意义(P>0.05)。蓝光照射20和40 min后,单独蓝光照射组菌液浓度与空白对照组比较差异有统计学意义(P < 0.01),表明蓝光照射20 min以上具有一定的抗菌效果。当蓝光照时10 min时,CDs+蓝光照射组菌液浓度明显低于单独蓝光照射组(P < 0.01)。当蓝光照射40 min时,菌液浓度具有浓度依赖性,随着CDs浓度的增加,菌液浓度降低,即抗菌效果更加明显。当CDs浓度为100 mg·L-1时,抗菌效果具有光照时间依赖性,即随着光照时间的增加,菌液浓度明显降低。见表 2。
| (n=3, x ±s) | |||||||||||||||||||||||||||||
| Group | Concentration of S.aureus | ||||||||||||||||||||||||||||
| Blue light (0 min) | Blue light (10 min) | Blue light (20 min) | Blue light (40 min) | ||||||||||||||||||||||||||
| Blank control | 0.700±0.026 | 0.636±0.043 | 0.541±0.035* | 0.454±0.018** | |||||||||||||||||||||||||
| CDs(mg·L-1) | |||||||||||||||||||||||||||||
| 50 | 0.684±0.029 | 0.309±0.007# | 0.262±0.027△ | 0.241±0.022○ | |||||||||||||||||||||||||
| 75 | 0.682±0.050 | 0.232±0.074△ | 0.226±0.019# | 0.164±0.020○ | |||||||||||||||||||||||||
| 100 | 0.609±0.024 | 0.226±0.004△ | 0.171±0.014# | 0.018±0.003○ | |||||||||||||||||||||||||
| * P < 0.05, * * P < 0.01 compared with blank control group; △ P < 0.01 compared with blue light(10 min) group; # P < 0.01 compared with blue light (20 min) group; ○ P < 0.01 compared with blue ligth(40 min) group. | |||||||||||||||||||||||||||||
单独CDs溶液组金黄色葡萄球菌的生物膜形成量与空白对照组比较差异无统计学意义(P>0.05), CDs对金黄色葡萄球菌生物膜形成量无影响。与空白对照组比较,随着蓝光照射时间的增加, 单独蓝光照射组金黄色葡萄球菌生物膜形成量相应减少,但蓝光照射10和20 min时对金黄色葡萄球菌生物膜形成的抑制作用较弱,组间比较差异无统计学意义(P>0.05)。当蓝光照射40 min时,与空白对照组比较,金黄色葡萄球菌生物膜形成量减少(P < 0.01)。当光照10、20和40 min时,与单独蓝光照射组比较,CDs+蓝光照射组金黄色葡萄球菌生物膜形成量减少(P < 0.01)。见表 3。
| (n=3, x ±s) | |||||||||||||||||||||||||||||
| Group | Biofilm formation amount of S.aureus | ||||||||||||||||||||||||||||
| Blue light (0 min) | Blue light (10 min) | Blue light (20 min) | Blue light (40 min) | ||||||||||||||||||||||||||
| Blank control | 2.990±0.087 | 2.644±0.241 | 2.403±0.092 | 2.043±0.288* | |||||||||||||||||||||||||
| CDs(mg·L-1) | |||||||||||||||||||||||||||||
| 50 | 2.737±0.604 | 1.300±0.367△ | 0.956±0.111# | 0.685±0.029△○ | |||||||||||||||||||||||||
| 75 | 3.106±0.049 | 0.716±0.038△ | 0.783±0.034△# | 0.651±0.053△○ | |||||||||||||||||||||||||
| 100 | 2.623±0.245 | 0.802±0.096△ | 0.534±0.024△# | 0.227±0.024△○ | |||||||||||||||||||||||||
| * P < 0.01 compared with blank control group; △ P < 0.01 compared with blue light (10 min)group; # P < 0.01 compared with blue light (20 min) group; ○ P < 0.01 compared with blue ligth(40 min) group. 1:Control group; 2:100 mg·L-1 CDs group; 3:0.5 mmol·L-1 NAC+100 mg·L-1 CDs group; 4:0.5 mmol·L-1 NAC group.*P < 0.01 compared with 100 mg·L-1 CDs group. | |||||||||||||||||||||||||||||
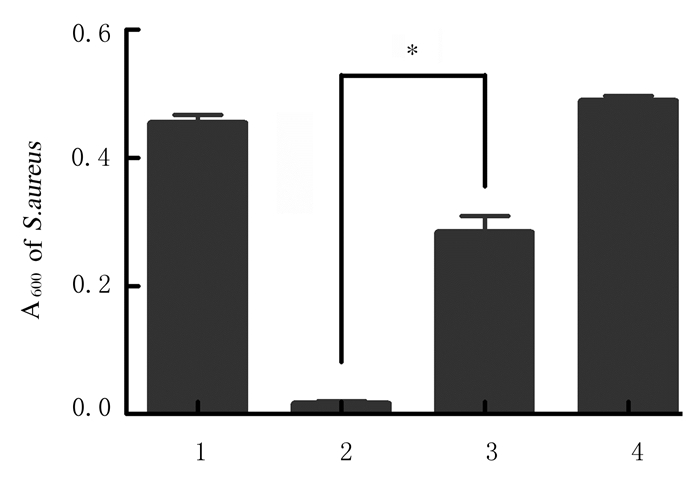
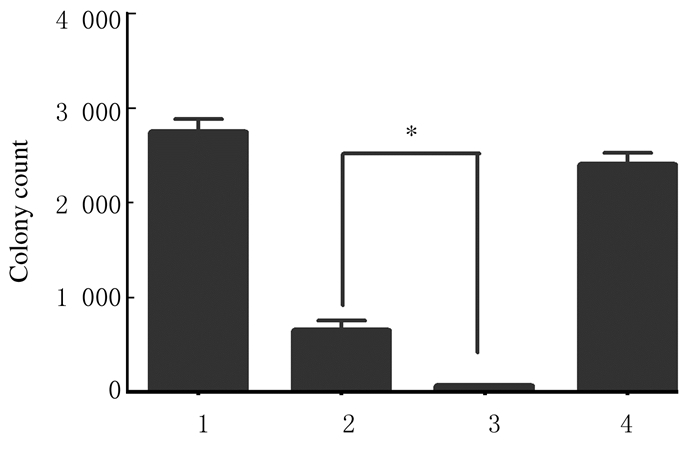
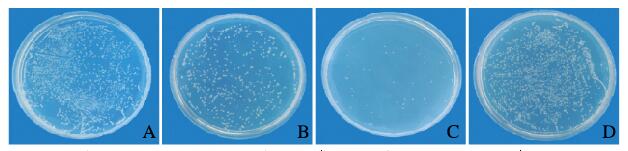
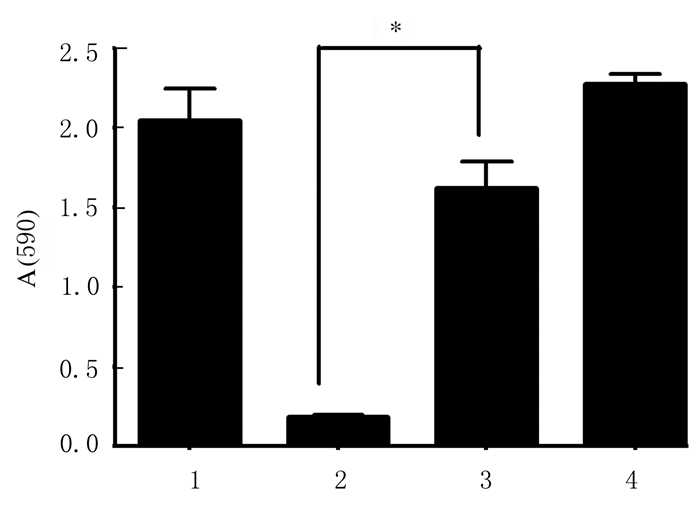
0.5 mmol·L-1 NAC + 100 mg·L-1 CDs组金黄色葡萄球菌菌液浓度明显高于100mg·L-1 CDs组(P < 0.01),见图 5。平板菌落计数法检测结果显示:0.5 mmol·L-1 NAC + 100 mg·L-1 CDs组菌落计数高于100 mg·L-1 CDs组(P < 0.05),见图 6和图 7(插页六)。结晶紫染色结果显示:0.5 mmol·L-1 NAC + 100 mg·L-1 CDs组金黄色葡萄球菌生物膜形成量明显低于100 mg·L-1 CDs组(P < 0.01)。见图 8。
|
| 1:Control group;2:100 mg·L-1 CDs group;3:0.5 mmol·L-1 NAC+100 mg·L-1 CDs group;4:0.5 mmol·L-1 NAC group.*P<0.01 compared with 100 mg·L-1 CDs group. 图 5 加入NAC后各组金黄色葡萄球菌菌液浓度 Fig. 5 Concentrations of S. aureus in various groups after treated with NAC |
|
|
|
| 1:Control group;2:0.5 mmol·L-1 NAC+100 mg·L-1 CDs group;3:100 mg·L-1 CDs group;4:0.5 mmol·L-1 NAC group.*P<0.05 compared with 100 mg·L-1 CDs group. 图 6 加入NAC后各组金黄色葡萄球菌菌落计数 Fig. 6 Colony counts of S. aureus in various groups after treated with NAC |
|
|
|
| A: Control group; B: 0.5 mmol·L-1NAC + 100 mg·L-1 CDs group; C: 100 mg·L-1 CDs group; D: 0.5 mmol·L-1 NAC group. 图 7 各组金黄色葡萄球菌菌落生长情况 Fig. 7 Growth of S. aureus colonies in various groups |
|
|
|
| 1:Control group;2:100 mg·L-1 CDs group;3:0.5 mmol·L-1 NAC+100 mg·L-1 CDs group;4:0.5 mmol·L-1 NAC group.*P<0.01 compared with 100 mg·L-1 CDs group. 图 8 加入NAC后各组金黄色葡萄球菌生物膜形成量 Fig. 8 Biofilm formation amounts of S.aureus in various groups after treated with NAC |
|
|
近年来,随着耐药菌的不断出现,越来越多的细菌感染性疾病治疗效果不佳,而细菌感染性疾病的发生发展常与生物膜的形成有密切关联, 这是由于生物膜形成后,细菌具有极强的耐药性并能干扰宿主免疫系统的识别和杀伤机制,因此成为临床治疗的重大挑战[14]。金黄色葡萄球菌是革兰阳性需氧球菌,常见于各种口腔术后急性感染。因其具有较强的成膜作用可为其他致病菌提供保护,最终协同致病,故应对金黄色葡萄球菌感染性疾病的预防和控制给予高度重视。APDT是针对细菌感染性疾病的有效治疗和预防而迅速发展起来的一个领域,因与传统抗生素和消毒药物抗菌机制不同,APDT可明显降低细菌耐药性的产生[15]。DÖRTBUDAK等[16]发现:APDT能减少种植体周围炎的牙周病原菌数量,而且对种植体表面无损伤,因此APDT为口腔疾病的防治提供了新思路。
光敏剂在APDT中是最重要的影响因素之一,但由于其反应过程相对较复杂,涉及许多方面,目前光敏剂较少应用于临床。因此光敏剂开发非常重要。卟啉类化合物因具有相对较高的活性氧产量,是常用的光敏剂之一。研究[17]显示:5-氨基酮戊酸(5-aminoketovalerate, ALA)作为一个典型的卟啉类光敏剂,可介导APDT使其具有广谱的抗微生物效应,因此临床上可将ALA介导的APDT应用于皮肤病治疗,如细菌及真菌感染。但由于ALA介导APDT光照时具有强烈的疼痛感限制了其广泛应用。TSAI等[18]发现:血卟啉或亚甲蓝介导的APDT在照射30 min时可抑制金黄色葡萄球菌生长。NEDA等[19]研究表明:甲苯胺蓝在LED照射条件下能有效杀死变异链球菌,但具有一定暗毒性,且在未经光照情况下,对变异链球菌也有一定的抗菌能力。尽管在上述研究中光敏剂表现出良好的抗病原微生物的作用,但其存在暗毒性较大、单纯光动力治疗效率低、光激发时间长和不良反应多等诸多问题,因此还需开发更加安全、有效的抗微生物光敏剂。纳米半导体材料因其光诱导氧化还原特性和抗菌功能而成为光敏剂热门选择,例如目前已被用作抗菌和一般消毒用途的二氧化钛(TiO2)半导体光催化剂[20]。然而,TiO2需要紫外光(UV)进行激发,UV只占据入射太阳光谱的4%且对生物体有害。此外TiO2带隙较宽, 这些不足制约其在光催化方面的实际应用。
CDs是近年来备受学者关注的新型纳米材料, 其合成方法简单多样,原材料丰富,自然界中含碳材料均能够提供碳源,同时CDs还具有高化学稳定性、较高溶解度、高光致发光性、抗光漂白性和毒性小的优点[21],具有良好的光诱导电子转移能力和光吸收能力。与传统纳米半导体比较, 其可见光谱区域更加广泛且对有机体温和,有潜力成为理想光敏剂。故本课题组以柠檬酸、乙二胺和醋酸锌为碳源通过水热法合成粒径约1.8 nm CDs并对其进行表征,荧光光谱仪检测结果表明:激发波长为300 ~400 nm,当激发波长为342 nm时CDs具有最佳发射效果,最佳发射波长为440 nm;FT-IR检测结果表明:CDs具有多个官能基团,如羟基和羧基等,说明锌掺杂CDs有较好的水溶性和稳定性。采用CCK-8法检测锌掺杂CDs的细胞毒性结果表明:与低浓度CDs共培养后,L929和MC3T3-E1细胞活性无明显变化,说明锌掺杂CDs细胞毒性较低。本研究结果表明:CDs单独应用无抗菌作用,单独蓝光照射20 min时其对金黄色葡萄球菌有抑制作用,CDs和蓝光照射联合应用时抗菌作用明显增强,蓝光照射10 min即可抑制金黄色葡萄球菌生长和生物膜形成;当CDs浓度为100 mg·L-1、蓝光照射时间为40 min时,抑制效果最佳。NAC作为强有效的抗氧化物质能够干扰活性氧的生成、清除已生成的活性氧。因此,本实验选取NAC对光动力抗菌效果最佳组进行处理,探讨CDs能否在蓝光激发下产生活性氧,结果显示:加入NAC后细菌数量及生物膜形成量明显增加,故推测在该条件下可通过光催化反应产生活性氧,从而对金黄色葡萄球菌产生不可逆伤害。此外,本实验中采用的蓝光波长为400~500 nm,与CDs的最佳激发波长(342 nm)不完全匹配,这可能对CDs光动力效应存在一定影响。在今后的研究中,本课题组将采用更宽谱的光源以期寻找到最佳激发波长从而获得更好的光动力抗菌效果。
综上所述,成功制备的锌掺杂CDs具有粒径小、水溶性高、荧光性能优异和低毒性特点,且在蓝光激发下通过光催化作用能有效抑制金黄色葡萄球菌的生长和生物膜形成。
| [1] |
SINGH V V, JURADO-SANCHEZ B, SATTAYASAMITSATHIT S, et al. Multifunctional silver-exchanged zeolite micromotors for catalytic detoxification of chemical and biological threats[J]. Adv Funct Mater, 2015, 25(14): 2147-2155. DOI:10.1002/adfm.201500033 |
| [2] |
YAMAMOTO M, SHITOMI K, MIYATA S, et al. Bovine serum albumin-capped gold nanoclusters conjugating with methylene blue for efficient 1O2 generation via energy transfer[J]. J Colloid Interface Sci, 2018, 510: 221-227. DOI:10.1016/j.jcis.2017.09.011 |
| [3] |
KHAN S, MOHAMMED RAYIS P, RIZVI A, et al. ROS mediated antibacterial activity of photoilluminated riboflavin:A photodynamic mechanism against nosocomial infections[J]. Toxicol Rep, 2019, 6: 136-142. DOI:10.1016/j.toxrep.2019.01.003 |
| [4] |
FUMES A C, ROMUALDO P C, MONTEIRO R M, et al. Influence of pre-irradiation time employed in antimicrobial photodynamic therapy with diode laser[J]. Lasers Med Sci, 2018, 33(1): 67-73. DOI:10.1007/s10103-017-2336-1 |
| [5] |
JALEEL J A, PRAMOD K. Artful and multifaceted applications of carbon dot in biomedicine[J]. J Control Release, 2018, 269: 302-321. DOI:10.1016/j.jconrel.2017.11.027 |
| [6] |
LIM S Y, SHEN W, GAO Z. Carbon quantum dots and their applications[J]. Chem Soc Rev, 2015, 44(1): 362-381. DOI:10.1039/C4CS00269E |
| [7] |
MIAO P, HAN K, TANG Y G, et al. Recent advances in carbon nanodots:synthesis, properties and biomedical applications[J]. Nanoscale, 2015, 7(5): 1586-1595. DOI:10.1039/C4NR05712K |
| [8] |
MIAO X, YAN X, QU D, et al. Red emissive sulfur, nitrogen codoped carbon dots and their application in ion detection and theraonostics[J]. Acs Appl Mater Inter, 2017, 9(22): 18549-18556. DOI:10.1021/acsami.7b04514 |
| [9] |
FERNANDO K A, SAHU S, LIU Y M, et al. Carbon quantum dots and applications in photocatalytic energy conversion[J]. ACS Appl Mater Interfaces, 2015, 7(16): 8363-8376. DOI:10.1021/acsami.5b00448 |
| [10] |
MAISCH T. Resistance in antimicrobial photodynamic inactivation of bacteria[J]. Photochem Photobiol Sci, 2015, 14(8): 1518-1526. DOI:10.1039/C5PP00037H |
| [11] |
LIU J J, LU S Y, TANG Q L, et al. One-step hydrothermal synthesis of photoluminescent carbon nanodots with selective antibacterial activity against Porphyromonas gingivalis[J]. Nanoscale, 2017, 9(21): 7135-7142. DOI:10.1039/C7NR02128C |
| [12] |
KUMARI S, RAJIT PRASAD S, MANDAL D, et al. Carbon dot-DNA-protoporphyrin hybrid hydrogel for sustained photoinduced antimicrobial activity[J]. J Colloid Interface Sci, 2019, 553: 228-238. DOI:10.1016/j.jcis.2019.06.034 |
| [13] |
KOVÁCOVÁ M, MARKOVIC ZM, HUMPOLICEK P, et al. Carbon quantum dots modified polyurethane nanocomposite as effective photocatalytic and antibacterial agents[J]. Acs Biomater, 2018, 4(12): 3983-3993. DOI:10.1021/acsbiomaterials.8b00582 |
| [14] |
HØIBY N. A short history of microbial biofilms and biofilm infections[J]. APMIS, 2017, 125(4): 272-275. DOI:10.1111/apm.12686 |
| [15] |
HU X Q, HUANG YY, WANG Y G, et al. Antimicrobial photodynamic therapy to control clinically relevant biofilm infections[J]. Front Microbiol, 2018, 9: 1299. DOI:10.3389/fmicb.2018.01299 |
| [16] |
DÖRTBUDAK O, HAAS R, BERNHART T, et al. Lethal photosensitization for decontamination of implant surfaces in the treatment of peri-implantitis[J]. Clin Oral Implants Res, 2001, 12(2): 104-108. DOI:10.1034/j.1600-0501.2001.012002104.x |
| [17] |
HARRIS F, PIERPOINT L. Photodynamic therapy based on 5-aminolevulinic acid and its use as an antimicrobial agent[J]. Med Res Rev, 2012, 32(6): 1292-1327. DOI:10.1002/med.20251 |
| [18] |
TSAI T, CHIEN H F, WANG T H, et al. Chitosan augments photodynamic inactivation of gram-positive and gram-negative bacteria[J]. Antimicrob Agents Chemother, 2011, 55(5): 1883-1890. DOI:10.1128/AAC.00550-10 |
| [19] |
HAKIMIHA N, KHOEI F, BAHADOR A, et al. The susceptibility of streptococcus mutans to antibacterial photodynamic therapy:A comparison of two different photosensitizers and light sources[J]. J Appl Oral Sci, 2014, 22(2): 80-84. DOI:10.1590/1678-775720130038 |
| [20] |
LIOU J W, CHANG H H. Bactericidal effects and mechanisms of visible light-responsive titanium dioxide photocatalysts on pathogenic bacteria[J]. Arch Immunol Ther Exp(Warsz), 2012, 60(4): 267-275. DOI:10.1007/s00005-012-0178-x |
| [21] |
JOVANOVIC S P, SYRGIANNIS Z, MARKOVIC Z M, et al. Modification of structural and luminescence properties of graphene quantum dots by gamma irradiation and their application in a photodynamic therapy[J]. ACS Appl Mater Interaces, 2015, 7(46): 25865-25874. DOI:10.1021/acsami.5b08226 |
 2020, Vol. 46
2020, Vol. 46


