扩展功能
文章信息
- 孔维健, 方红娟, 潘肃, 杨利丽, 郑爽, 齐治平, 付川, 钟磊
- KONG Weijian, FANG Hongjuan, PAN Su, YANG Lili, ZHENG Shuang, QI Zhiping, FU Chuan, ZHONG Lei
- 搭载紫杉醇脂质体的聚乳酸-羟基乙酸共聚物静电纺丝膜对神经干细胞增殖分化的影响
- Effect of PLGA electrospinning membrane carrying paclitaxel-liposomes on proliferation and differentiation of neural stem cells
- 吉林大学学报(医学版), 2020, 46(03): 509-514
- Journal of Jilin University (Medicine Edition), 2020, 46(03): 509-514
- 10.13481/j.1671-587x.20200314
-
文章历史
- 收稿日期: 2019-09-06
2. 吉林省一汽总医院电诊科, 吉林 长春 130011
2. Department of Electrical Diagnosis, General Hospital, Jilin FAW, Changchun 130011, China
近年来,如何促进脊髓损伤后肢体运动和感觉功能的恢复受到了较为广泛的关注。正常脊髓中含有大量功能神经元、神经支持细胞和具有分化潜能的神经干细胞,脊髓损伤后,损伤部位及其下方部位神经元大量坏死及萎缩,瘢痕细胞及炎症细胞大量增生[1]。脊髓损伤后损伤部位的局部炎性微环境不利于神经干细胞(neural stem cells,NSCs)向神经元分化,大多数NSCs均在炎性微环境诱导下分化为星形胶质细胞和其他支持细胞[2],替代了正常的脊髓组织,阻碍了神经信号通路的重建。因此诱导NSCs向神经元分化在脊髓损伤恢复研究中具有重要意义。紫杉醇是一种临床一线抗肿瘤药物,广泛应用于乳腺癌和卵巢癌等疾病的治疗。高浓度紫杉醇能够诱导和促进细胞中微管蛋白聚合,稳定微管,进而抑制细胞分裂和增殖,从而发挥抗肿瘤作用[3]。目前有研究[4-5]显示:紫杉醇和紫杉醇类似物如埃坡霉素D对于神经退行性病变如阿尔兹海默症有一定的神经保护作用,其作用机制可能是低浓度紫杉醇能够阻止轴突回缩球的形成,刺激神经突延伸。生物可降解材料在组织工程学中具有广泛应用。聚乳酸-羟基乙酸共聚物(polylactic-co-glycolic acid,PLGA)作为一种高分子生物材料,具有降解速率可调和细胞毒性低等优点,在组织工程学研究中具有很大的应用潜力[6]。但PLGA材料的疏水表面不利于细胞在其表面黏附生长[7]。利用静电纺丝技术可以使PLGA材料表面呈纤维样交错分布,有利于细胞在其表面黏附生长[8]。
目前关于紫杉醇脂质体的研究主要集中在其对肿瘤细胞的抗肿瘤效果方面,尚无关于紫杉醇脂质体对NSCs增殖和分化直接影响的研究。PLGA作为一种具有良好应用前景的高分子材料,已经广泛用于表皮、脊髓和骨组织等组织工程修复研究[9-11]。本研究将紫杉醇和PLGA混合,利用静电纺丝技术制成静电纺丝膜,将NSCs在不同种类静电纺丝膜上进行培养,观察不同浓度紫杉醇脂质体对NSCs增殖和分化的影响,为脊髓损伤的治疗提供依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器2只孕14 d雌性SD大鼠购自辽宁长生生物技术股份有限公司,体质量350~400 g,动物使用许可证号:SCXK(辽)2015-0001。PLGA(相对分子质量为40000,长春圣博玛生物材料有限公司),紫杉醇脂质体(南京绿叶思科药业有限公司),六氟异丙醇(德国Merck公司),免疫荧光染色一抗Nestin(美国Abcam公司),Fluor 488绿色荧光二抗(A0428,上海碧云天生物技术有限公司),DMEM/F12培养基(海克隆公司),碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和表皮细胞生长因子(epidermal growth factor,EGF)(美国Peprotech公司),MTT试剂盒(型号C0009,上海碧云天生物技术有限公司),TaKaRa逆转录试剂盒(大连宝生物工程有限公司)。电压调节直流电源(型号DW-P203-1ACFD,天津东文公司),扫描电镜(SEM,荷兰Philips公司),激光共聚焦显微镜(型号FV3000,日本Olympus公司)。
1.2 搭载紫杉醇脂质体PLGA静电纺丝膜的制备静电纺丝膜的制备方法参照文献[12]。将100 mg PLGA溶于5 mL六氟异丙醇中,向溶液中加入10 μL不同浓度紫杉醇脂质体,以达到相应药物浓度(1、5和10 μg·L-1), 即为1、5和10 μg·L-1紫杉醇脂质体PLGA静电纺丝膜组。将所得混合溶液移至10 mL注射器中,静电纺丝膜的制备采用电压调节直流电源,施加电压为20 kV,进给速率为1mL·h-1,发射板和收集板之间距离为10 cm。从收集板上获得含有不同浓度紫杉醇脂质体的PLGA静电纺丝膜。采用相同方法制备不含药物的纯PLGA静电纺丝膜,作为纯PLGA静电纺丝膜组。
1.3 紫杉醇脂质体PLGA静电纺丝膜纤维直径测定利用SEM对所制得的静电纺丝膜进行检测,观察所制得材料的微观结构和纤维直径,并测量各组静电纺丝膜的纤维直径。
1.4 NSCs分离培养和鉴定从孕14 d雌性SD大鼠腹中胎鼠的大脑皮层中分离出NSCs,在T25培养瓶中以50 000cm-3的密度进行分离和纯化,并在37℃、5% CO2环境中培养。生长培养基中含有5%胎牛血清、2% B27、20 μg·L-1 EGF、20 μg·L-1 bFGF和100 μg·L-1青霉素-链霉素双抗。培养的原代NSCs每4 d传代1次,培养基每2 d更换1次。传代次数在第2~5代NSCs被用于后续的实验研究。采用免疫荧光染色对所分离得到的细胞进行鉴定。将培养在细胞板中的NSCs采用PBS洗涤3次,每次5 min。向培养板中加入4%多聚甲醛固定30 min,PBS洗涤后吸去上清加入10%血清,室温下封闭1 h。吸去上清后向每孔中分别加入50 μL一抗,37℃孵育1 h。PBS洗涤后吸去上清液,向孔中加入50 μL荧光二抗(Fluor488),室温下孵育1 h后吸去上清,PBS洗涤后滴加DAPI,吸去染剂并经PBS洗涤后封片。利用激光共聚焦显微镜观察细胞在不同抗体标记下的染色结果。
1.5 MTT法检测各组NSCs增殖活性将细胞密度为30 000cm-3的NSCs分别加入铺有不同静电纺丝膜的细胞板中(1、5和10 μg·L-1紫杉醇脂质体PLGA静电纺丝膜和纯PLGA静电纺丝膜),在培养第1、4和7天采用MTT法检测各组细胞增殖水平。具体实验步骤按MTT试剂盒说明书进行操作,向每孔中加入50 μLMTT溶液,37℃下孵育4 h。将培养液吸出后离心吸去上清液,各孔中加入100 μLDMSO溶液,低速振荡10 min后使结晶物充分溶解。将样品在酶联免疫检测仪上于540 nm波长处测量各样本吸光度(A)值。以A值代表各组NSCs增殖水平。
1.6 RT-PCR法检测各组NSCs中Tuj-1和GFAP mRNA表达水平将在各组静电纺丝膜上生长的NSCs培养7 d后,利用PrimeScriptTM试剂盒对NSCs中RNA进行分离和纯化。Tuj-1和GFAP分别代表神经元和星形胶质细胞,GADPH作为内参校正基因。各组NSCs中Tuj-1和GFAP mRNA表达水平采用2-ΔΔCt法计算,ΔCt值=目的基因Ct值-管家基因Ct值;ΔΔCt=材料组(目的基因Ct值-管家基因Ct值)-对照组(目的基因Ct值-管家基因Ct值)。RT-PCR扩增引物见表 1。
| Gene | Forward primer(5′-3′) | Reverse primer(5′-3′) | Length(bp) |
| Tuj-1 | GATCGGAGCCAAGTTCTG | GTCCATCGTCCCAGGTTC | 107 |
| GFAP | GCAGACCTTCTCCAACCTG | ACTCCTTAATGACCTCTCCATC | 125 |
| GAPDH | TCGCCAGCCGAGCCA | CCTTGACGGTGCCATGGAAT | 157 |
采用SPSS 22.0统计软件进行统计学分析。各组静电纺丝膜纤维直径、各组NSCs增殖活性、各组NSCs中Tuj-1和GFAP mRNA表达水平以x ±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果 2.1 紫杉醇脂质体PLGA静电纺丝膜纤维直径紫杉醇脂质体PLGA静电纺丝膜呈白色,质地柔软,表面呈网格状,紫杉醇脂质体PLGA静电纺丝膜形态见图 1。SEM结果显示:微观水平下各组静电纺丝膜均呈纤维状相互交错,纯PLGA静电纺丝膜组静电纺丝膜平均纤维直径为1 087 nm,混有紫杉醇脂质体的PLGA静电纺丝膜纤维直径与纯PLGA静电纺丝膜比较略有减小。1、5和10 μg·L-1紫杉醇脂质体PLGA静电纺丝膜组静电纺丝膜纤维直径分别为1 015、990和917 nm,各组纤维直径比较差异均无统计学意义(P>0.05)。SEM下紫杉醇脂质体PLGA静电纺丝膜的超微结构见图 2。
|
| 图 1 紫杉醇脂质体PLGA静电纺丝膜形态表现 Fig. 1 Morphology of paclitaxel-liposome PLGA electrospinning membrane |
|
|

|
| 图 2 SEM下紫杉醇脂质体PLGA静电纺丝膜的超微结构(Bar=10 μm) Fig. 2 Ultrastructure of paclitaxel-liposome PLGA electrospinning membrane under SEM(Bar=10 μm) |
|
|
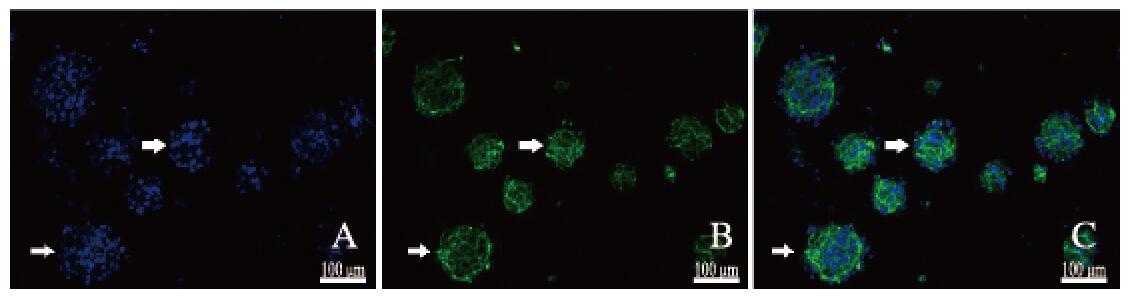
免疫荧光染色结果显示:蓝色为细胞核,绿色为Nestin蛋白表达。培养得到的NSCs呈球状聚集,且多数细胞球中均有Nestin表达,说明通过分离纯化得到的细胞均为NSCs,能够满足后续的实验需求。见图 3(插页六)。
|
| A:Nucleus;B:Nestin protein;C:Merge; Arrows:Clusters of NSCs 图 3 免疫荧光染色鉴定NSCs形态表现(Bar=100 μm) Fig. 3 Morphology of NSCs identificated by immunofluorescence staining(Bar=100 μm) |
|
|
第1天各组NSCs增殖活性比较差异无统计学意义(P>0.05)。第4天和第7天1、5和10 μg·L-1紫杉醇脂质体PLGA静电纺丝膜组NSCs增殖活性与第1天比较有所升高,且高于对应天数的纯PLGA组, 但组间比较差异无统计学意义(P>0.05)。第4天5 μg·L-1紫杉醇脂质体PLGA静电纺丝膜组NSCs增殖活性高于其他3组(P < 0.05)。第7天各组NSCs增殖活性较第4天均有升高,5 μg·L-1紫杉醇脂质体PLGA静电纺丝膜组NSCs增殖活性在所有组中仍最高,高于纯PLGA静电纺丝膜组(P < 0.05),但与1和10 μg·L-1紫杉醇脂质体PLGA静电纺丝膜组NSCs增殖活性的差距有所减小。见表 2。
| (x ±s) | |||||||||||||||||||||||||||||
| Group | Proliferation level of NSCs (A value) | ||||||||||||||||||||||||||||
| (t/d) 1 | 4 | 7 | |||||||||||||||||||||||||||
| PLGA electrospinning membrane | 0.246 7±0.020 8 | 0.760 5±0.134 5 | 1.403 3±0.181 5 | ||||||||||||||||||||||||||
| PLGA electrospinning membrane carrying 1 μg·L-1 paclitaxel-liposomes | 0.260 0±0.062 4 | 0.956 6±0.145 7 | 1.733 3±0.187 4 | ||||||||||||||||||||||||||
| PLGA electrospinning membrane carrying 5 μg·L-1 paclitaxel-liposomes | 0.270 1±0.045 8 | 1.580 2±0.124 9*△ | 2.180 0±0.108 2* | ||||||||||||||||||||||||||
| PLGA electrospinning membrane carrying 10 μg·L-1 paclitaxel-liposomes | 0.256 7±0.061 1 | 0.901 5±0.174 4# | 1.506 7±0.132 0 | ||||||||||||||||||||||||||
| * P<0.05 vs PLGA electrospinning membrane group; △ P<0.05 vs PLGA electrospinning membrane carrying 1 μg·L-1 paclitaxel-liposomes group; # P<0.05 vs PLGA electrospinning membrane carrying 5 μg·L-1 paclitaxel-liposomes group. | |||||||||||||||||||||||||||||
与纯PLGA静电纺丝膜组比较,1、5和10 μg·L-1紫杉醇脂质体PLGA静电纺丝膜组NSCs中Tuj-1 mRNA表达水平升高。1和10 μg·L-1紫杉醇脂质体PLGA静电纺丝膜组NSCs中Tuj-1和GFAP mRNA表达水平与纯PLGA静电纺丝膜组比较差异均无统计学意义(P>0.05),5 μg·L-1紫杉醇脂质体PLGA静电纺丝膜组NSCs中Tuj-1mRNA表达水平高于其他3组(P<0.05)。随着静电纺丝膜中紫杉醇脂质体浓度的增加,NSCs中GFAP mRNA表达水平逐渐减小,纯PLGA静电纺丝膜组NSCs中GFAP mRNA表达水平最高,10 μg·L-1紫杉醇脂质体PLGA静电纺丝膜组NSCs中GFAP mRNA表达水平最低。见表 3。
| (x ±s) | |||||||||||||||||||||||||||||
| Group | Tuj-1 mRNA | GFAP mRNA | |||||||||||||||||||||||||||
| PLGA electrospinning membrane | 1.000±0.000 | 1.000±0.000 | |||||||||||||||||||||||||||
| PLGA electrospinning membrane carrying 1 μg·L-1 paclitaxel-liposomes | 1.148±0.127 | 0.935±0.170 | |||||||||||||||||||||||||||
| PLGA electrospinning membrane carrying 5 μg·L-1 paclitaxel-liposomes | 1.764±0.189*△ | 0.677±0.131* | |||||||||||||||||||||||||||
| PLGA electrospinning membrane carrying 10 μg·L-1 paclitaxel-liposomes | 1.228±0.176# | 0.403±0.123*△# | |||||||||||||||||||||||||||
| * P<0.05 compared with PLGA electrospinning membrane group; △ P<0.05 vs PLGA electrospinning membrane carrying 1 μg·L-1 paclitaxel-liposomes; # P<0.05 vs PLGA electrospinning membrane carrying 5 μg·L-1 paclitaxel-liposomes. | |||||||||||||||||||||||||||||
NSCs在脊髓损伤和神经损伤后再生中具有重要作用,NSCs具有分化为功能性神经元和重建受损神经传导通路的潜能。但神经损伤后受损部位纤维瘢痕组织增生,形成物理屏障阻碍了损伤部位两端神经的重新连接[13]。生物材料为结构性损伤中神经细胞的生长和迁移提供了结构基础,对损伤后神经功能恢复具有积极影响[14]。此外,损伤后局部炎性微环境促进NSCs向星形胶质细胞分化,而不是分化为神经元[15]。星形胶质细胞能够形成胶质瘢痕,进一步阻碍了损伤部位两端的功能重建[16]。因此,促进NSCs增殖并向神经元分化对神经损伤后功能恢复具有积极意义。有研究[4]显示:低浓度紫杉醇能够阻止轴突回缩球的形成,刺激神经突延伸,对神经系统具有一定的保护作用,但其对NSCs的影响仍不明确。本研究通过构建含有不同浓度紫杉醇脂质体PLGA的静电纺丝膜,将NSCs在其表面培养,并对上述问题进行了探讨。
静电纺丝技术制备的材料表面呈网格状,SEM结果显示静电纺丝膜表面PLGA纤维相互交错,有研究[17]显示:这一粗糙结构有利于细胞在静电纺丝膜表面黏附生长。与口服或静脉给药方式比较,通过生物工程技术制备载有紫杉醇的静电纺丝膜能够更好地对药物浓度加以控制,使药物以较低剂量直接作用于损伤部位,避免了全身用药带来的不良反应。本研究利用免疫荧光染色技术对从胎鼠脑组织中提取出的细胞进行鉴定,结果发现大多数细胞中均有NSCs所特有的Nestin蛋白表达,说明所提取的用于后续细胞实验的细胞基本均为NSCs,为后续实验的顺利进行奠定了基础。
本研究结果显示:随着培养时间的延长,各组NSCs增殖活性均提高。随着药物浓度的增加,5 μg·L-1紫杉醇脂质体PLGA静电纺丝膜组NSCs增殖活性明显高于1 μg·L-1紫杉醇脂质体PLGA静电纺丝膜组,说明在较低浓度范围内,紫杉醇脂质体对NSCs的增殖具有促进作用;10 μg·L-1紫杉醇脂质体PLGA静电纺丝膜组中NSCs增殖活性低于5 μg·L-1紫杉醇脂质体PLGA静电纺丝膜组,有研究[18]推测:这可能是由于较高浓度紫杉醇对细胞分裂具有抑制作用。
本研究结果显示:在5 μg·L-1紫杉醇脂质体PLGA静电纺丝膜组NSCs中,代表神经元生长情况的Tuj-1 mRNA表达水平最高,这说明5 μg·L-1紫杉醇能够促进NSCs分化为神经元;而10 μg·L-1紫杉醇脂质体PLGA静电纺丝膜组NSCs中Tuj-1 mRNA表达水平较5 μg·L-1紫杉醇脂质体PLGA静电纺丝膜组有所减少,这可能是由于较高浓度紫杉醇抑制了NSCs增殖。GFAP代表星形胶质细胞中相关基因的表达。随着药物浓度的增加,GFAPmRNA表达水平逐渐减少,10 μg·L-1紫杉醇脂质体组NSCs中GFAP mRNA表达水平最低,并且明显低于1和5 μg·L-1紫杉醇脂质体PLGA静电纺丝膜组。这可能是因为10 μg·L-1紫杉醇脂质体不仅抑制了NSCs向星形胶质细胞分化,还抑制了NSCs的增殖,使得能够分化为星形胶质细胞的NSCs数量进一步减少。上述结果说明:中等浓度紫杉醇对于NSCs增殖具有明显促进作用,并且能够诱导NSCs向神经元分化,抑制NSCs向星形胶质细胞分化。
神经元再生是脊髓损伤中神经功能恢复的基础,新生神经元可以进一步分化为运动神经元或感觉神经元,替代受损的神经细胞,在一定程度上恢复原有的神经功能[19]。星形胶质细胞是神经系统中一种常见的支持细胞,在正常组织中的星形胶质细胞包裹在神经元周围,对神经细胞具有保护作用[20]。但在损伤后,损伤区域的炎性微环境刺激星形胶质细胞过度生长形成屏障,阻碍神经元重建神经信号通路,对神经功能的恢复产生不利影响[21]。因此,促进神经元形成并抑制星形胶质细胞生长有利于神经功能的恢复。
本研究利用静电纺丝技术构建了载有紫杉醇脂质体的PLGA静电纺丝膜,将从动物体内提取的NSCs培养在含有不同浓度药物的静电纺丝膜上,并对其增殖分化情况进行了检测。本研究结果表明:5 μg·L-1紫杉醇能够促进NSCs增殖,并诱导NSCs向有利于神经功能恢复的方向进行分化,应用中等浓度紫杉醇治疗脊髓损伤具有一定可行性,搭载中等浓度紫杉醇脂质体的PLGA静电纺丝膜在治疗脊髓损伤中具有潜在的应用前景。
| [1] |
BAPTISTE D C, FEHLINGS M G. Update on the treatment of spinal cord injury[J]. Prog Brain Res, 2007, 161: 217-233. DOI:10.1016/S0079-6123(06)61015-7 |
| [2] |
COVACU R, BRUNDIN L. Effects of neuroinflammation on neural stem cells[J]. Neuroscientist, 2017, 23(1): 27-39. DOI:10.1177/1073858415616559 |
| [3] |
LI XR, FAN C X, XIAO Z F, et al. A collagen microchannel scaffold carrying paclitaxel-liposomes induces neuronal differentiation of neural stem cells through Wnt/β-catenin signaling for spinal cord injury repair[J]. Biomaterials, 2018, 183: 114-127. DOI:10.1016/j.biomaterials.2018.08.037 |
| [4] |
SENGOTTUVEL V, LEIBINGER M, PFREIMER M, et al. Taxol facilitates axon regeneration in the mature CNS[J]. J Neurosci, 2011, 31(7): 2688-2699. DOI:10.1523/JNEUROSCI.4885-10.2011 |
| [5] |
XIE J W, WANG C H. Electrospun micro- and nanofibers for sustained delivery of paclitaxel to treat C6 glioma in vitro[J]. Pharm Res, 2006, 23(8): 1817-1826. DOI:10.1007/s11095-006-9036-z |
| [6] |
BIENEK D R, HOFFMAN K M, TUTAK W. Blow-spun chitosan/PEG/PLGA nanofibers as a novel tissue engineering scaffold with antibacterial properties[J]. J Mater Sci Mater Med, 2016, 27(9): 146. DOI:10.1007/s10856-016-5757-7 |
| [7] |
LIU C, HUANG Y, PANG M, et al. Tissue-engineered regeneration of completely transected spinal cord using induced neural stem cells and gelatin-electrospun poly (lactide-co-glycolide)/polyethylene glycol scaffolds[J]. PLoS One, 2015, 10(3): e0117709. DOI:10.1371/journal.pone.0117709 |
| [8] |
WALI A, ZHANG Y C, SENGUPTA P, et al. Electrospinning of non-ionic cellulose ethers/polyvinyl alcohol nanofibers:Characterization and applications[J]. Carbohydr Polym, 2018, 181: 175-182. DOI:10.1016/j.carbpol.2017.10.070 |
| [9] |
杨光.共载纳米银及bFGF的PLGA/PCL壳核结构微球制备及促进创面修复的实验研究[D].长春: 吉林大学, 2018.
|
| [10] |
XIA P, WANG S, QI Z P, et al. BMP-2-releasing gelatin microspheres/PLGA scaffolds for bone repairment of X-ray-radiated rabbit radius defects[J]. Artif Cell Nanomed Biotechnol, 2019, 47(1): 1662-1673. DOI:10.1080/21691401.2019.1594852 |
| [11] |
PAN S, QI Z P, LI QJ, et al. Graphene oxide-PLGA hybrid nanofibres for the local delivery of IGF-1 and BDNF in spinal cord repair[J]. Artif Cells Nanomed Biotechnol, 2019, 47(1): 651-664. |
| [12] |
ZHAO W, LI J J, JIN K X, et al. Fabrication of functional PLGA-based electrospun scaffolds and their applications in biomedical engineering[J]. Mater Sci Eng C Mater Biol Appl, 2016, 59: 1181-1194. DOI:10.1016/j.msec.2015.11.026 |
| [13] |
MOTHE A J, TATOR C H. Review of transplantation of neural stem/progenitor cells for spinal cord injury[J]. Int J Dev Neurosci, 2013, 31(7): 701-713. DOI:10.1016/j.ijdevneu.2013.07.004 |
| [14] |
LIU S, XIE Y Y, WANG B, et al. Role and prospects of regenerative biomaterials in the repair of spinal cord injury[J]. Neural Regen Res, 2019, 14(8): 1352-1363. DOI:10.4103/1673-5374.253512 |
| [15] |
FAN BY, WEI ZJ, YAO X, et al. Microenvironment imbalance of spinal cord injury[J]. Cell Transplant, 2018, 27(6): 853-866. DOI:10.1177/0963689718755778 |
| [16] |
WANG B, XIAO Z F, CHEN B, et al. Nogo-66 promotes the differentiation of neural progenitors into astroglial lineage cells through mTOR-STAT3 pathway[J]. PLoS One, 2008, 3(3): e1856. DOI:10.1371/journal.pone.0001856 |
| [17] |
XUE J J, XIE J W, LIU W Y, et al. Electrospun nanofibers:new concepts, materials, and applications[J]. Acc Chem Res, 2017, 50(8): 1976-1987. DOI:10.1021/acs.accounts.7b00218 |
| [18] |
ZHANG B, CARROLL J, TROJANOWSKI J Q, et al. The microtubule-stabilizing agent, epothilone D, reduces axonal dysfunction, neurotoxicity, cognitive deficits, and Alzheimer-like pathology in an interventional study with aged tau transgenic mice[J]. J Neurosci, 2012, 32(11): 3601-3611. DOI:10.1523/JNEUROSCI.4922-11.2012 |
| [19] |
SABELSTROM H, STENUDD M, FRISEN J. Neural stem cells in the adult spinal cord[J]. Exp Neurol, 2014, 260: 44-49. DOI:10.1016/j.expneurol.2013.01.026 |
| [20] |
WANG J J, WANG J Q, LU P, et al. Local delivery of FTY720 in PCL membrane improves SCI functional recovery by reducing reactive astrogliosis[J]. Biomaterials, 2015, 62: 76-87. DOI:10.1016/j.biomaterials.2015.04.060 |
| [21] |
LU P, KADOYA K, TUSZYNSKI M H. Axonal growth and connectivity from neural stem cell grafts in models of spinal cord injury[J]. Curr Opin Neurobiol, 2014, 27: 103-109. DOI:10.1016/j.conb.2014.03.010 |
 2020, Vol. 46
2020, Vol. 46


