扩展功能
文章信息
- 潘永生, 邝融, 孙铎, 毛天娇, 姜可新, 李江
- PAN Yongsheng, KUANG Rong, SUN Duo, MAO Tianjiao, JIANG Kexin, LI Jiang
- 美学区切牙拔牙创大鼠模型的建立和改良微创拔牙手术的效果评价
- Establishment of incisor extraction wound ratmodels in aesthetic area and evaluation on effectiveness of modified minimally invasive tooth extraction surgery
- 吉林大学学报(医学版), 2020, 46(03): 504-508
- Journal of Jilin University (Medicine Edition), 2020, 46(03): 504-508
- 10.13481/j.1671-587x.20200313
-
文章历史
- 收稿日期: 2019-10-20
2. 吉林大学口腔医院口腔修复科, 吉林 长春 130021
2. Department of Prosthodontics, Stomatology Hospital, Jilin University, Changchun 130021, China
在美学区,由于各种因素导致的拔牙手术常会引起拔牙部位牙槽骨持续吸收、降低和牙周软组织塌陷,不利于后期美学修复治疗[1]。因此建立美学区拔牙创模型并探讨拔牙创在自然状态下愈合或人为因素干预下牙槽骨和软组织的修复及愈合机制有重大临床意义[2]。啮齿类动物发育迅速,因此常作为骨再生研究的实验对象,且其切牙区域的牙龈和牙槽骨结构类似于人类美学区牙周组织结构而受到广泛关注[3-4]。
大鼠切牙拔牙创模型已广泛应用于大鼠牙囊干细胞提取和拔牙创植入材料促进成骨等方面的研究[5-6]。然而由于大鼠切牙长而细,并且切牙组织在大鼠整个生命过程中持续不断地生长,但未形成典型的根部,而是连接于牙槽窝内的牙囊组织[7],故在拔牙过程中容易出现牙冠碎裂、断根或牙囊粘连牙根组织等情况而导致拔牙手术失败。大鼠切牙近中的动脉血管位于龈缘下方,缺乏专业拔牙器械易导致术中大出血而引起大鼠窒息死亡[8]。常规的手术器械不仅会造成拔牙创大面积牙龈组织撕裂,还会导致牙槽骨骨折,从而影响大鼠前牙美学区的愈合程度[9]。因此采用合适的手术方式建立大鼠下颌切牙拔牙创模型对后期实验研究至关重要[1]。但是国内外有关在美学区域有效地建立大鼠拔牙创模型的相关报道较少,有关采用优化微创手术进行建模并维持拔牙窝软、硬组织的研究少见报道,因而探讨一种方便、实用且高效的微创手术建模方式具有重要研究意义[10]。
本文作者设计并完善了一种新型微创拔牙手术方式,通过改良既往拔牙实验技术和优化临床器械,不仅增加了大鼠切牙完整拔除的效果,降低了大鼠术中失血量,而且促进了大鼠拔牙创周围牙龈愈合及牙槽骨恢复程度。本研究为美学区拔牙创的建模提供了一种完整的微创手术方式,该技术为将临床技巧与工具结合创新性地局部应用于动物实验,不仅可以提高建模效果,还可以为研究美学区软、硬组织愈合程度提供新方法。
1 材料与方法 1.1 动物、主要试剂和仪器24只健康雄性SD大鼠,动物使用许可证号:SCXK(吉)2016-0011,由吉林大学基础实验室提供,体质量约为220 g,随机分为实验组和对照组,每组12只。水合氯醛(成都创龙化工有限公司)。阿替卡因肾上腺素注射液及专用注射器(法国必兰公司),光敏雕刻刀、牙龈分离器图和止血钳(弯钳和直钳)(西安英诺维机电科技有限公司),可拆卸式直手机(成都创龙化工有限公司)一次性口腔器械盘等。
1.2 手术方法 1.2.1 对照组大鼠常规手术拔牙步骤术前准备:术前第9、6和3天使用可拆卸式直手机沿大鼠切牙牙龈处切断牙齿(图 1A,见插页六),为预防感染,常规用棉签碘伏消毒。大鼠麻醉及牙齿拔除:在建模的第10天,采用10%水合氯醛(0.3 mL·100 g-1)腹腔注射全身麻醉。碘伏棉签消毒后,在拔除切牙的唇、舌侧及近、远中使用口腔专用注射器行必兰麻局部浸润麻醉(图 1B, 见插页六)。使用探针在切牙的唇、舌侧及近、远中分别分离牙龈组织(图 1C, 见插页六),然后使用止血钳沿着牙根生长方向拔除牙齿(图 1D,见插页六)。
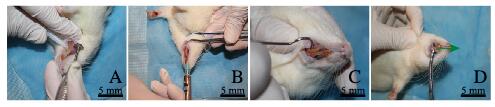
|
| A:Severed crown; B: Anesthetic injection; C: Gingival separation; D: Tooth extraction (Green arrow: Direction of force application). 图 1 对照组大鼠常规手术拔牙步骤 Fig. 1 Extraction procedure of routine operation of rats in control group |
|
|
术前准备:在术前第9、6和3天,分别使用光敏雕刻刀及牙龈分离器将牙龈向牙根方向分离,并且分别在切牙的唇、舌侧及近、远中部位利用杠杆原理对牙根施力,然后利用可拆卸式直手机沿着大鼠切牙的牙龈处切断牙齿。大鼠麻醉:在建模的第10天,局部麻醉和全身麻醉方法同上,在局部注射麻醉过程中,注意在切牙近中勿将注射器针头探入过深以防刺破血管引发全身反应。牙齿拔除:将适量棉花塞入大鼠口腔,以防止血液和唾液误吸。该手术采用的手术器械均通过高温高压灭菌。使用光敏雕刻刀(图 2A,见插页六)和牙龈分离器(图 2B,见插页六)沿着牙根方向分离牙龈, 并在近、远中部位使用杠杆力撬动牙根。然后在止血钳(图 2C,见插页六,绿色箭头指示施力方向)上缠上棉花,以防止牙齿的牙冠部分被夹碎,并使用相对恒定的力量沿着牙根生长方向拔除牙齿。牙齿拔除过程中不能使用任何旋转和摇晃力量,术中及时止血。牙齿拔出后,及时利用缠有棉花的探针注入拔牙窝中止血,5~10 min后取出,然后使用5-0缝线缝合伤口(图 2D,见插页六)。术中采用四手操作:术者在操作时由助手配合保持大鼠的开口度并保证大鼠呼吸顺畅, 及时清除手术区域的唾液与血液, 密切观察大鼠生命体征。
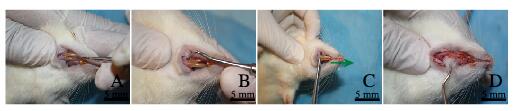
|
| A: Gingival separation (Carving knife); B: Gingival separation (Splitter); C: Tooth extraction; D: Hemostasis (Green arrow: Direction of force application). 图 2 实验组大鼠微创手术拔牙步骤 Fig. 2 Extraction procedure of minimally invasive operation of rats in experiment group |
|
|
手术后将2组大鼠放置于干净卫生和通风良好的鼠笼中饲养, 并维持笼内温度约为25℃。大鼠苏醒后采用软食饲养24 h,于术后第1周和第4周观察2组大鼠拔牙伤口的愈合情况。
1.4 2组大鼠存活率记录术中和术后存活大鼠数,计算大鼠存活率, 同时记录2组大鼠死亡数。大鼠存活率=存活大鼠数/大鼠总数×100%。
1.5 2组大鼠体质量检测分别记录2组大鼠在围手术期(包括术前第9、6和3天)和手术时体质量及术后第7和14天体质量。
1.6 2组大鼠切牙完整拔除率切牙完整拔除定义为牙冠和牙根完全拔除,并伴有或未伴有牙囊组织。记录每组大鼠完整拔除切牙数,计算切牙完整拔除率。切牙完整拔除率=完整拔除切牙数/大鼠牙齿总数×100%。
1.7 2组大鼠拔牙创周围软组织和牙槽骨愈合情况术后1周观察对照组与实验组大鼠拔牙创周围软组织愈合情况;术后4周观察对照组与实验组大鼠牙槽骨愈合情况。
1.8 统计学分析采用SPSS 25.0统计软件进行统计学分析。2组大鼠切牙完整拔除率比较采用四格表χ2检验;2组大鼠各时间点体质量以x ±s表示,采用Shapiro-wilk法对资料进行正态性检验(W检验),以P>0.05为资料符合正态分布,采用Levene法对资料进行方差齐性检验(F检验),以P>0.05为资料符合方差齐性,如方差齐则组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果 2.1 2组大鼠存活率对照组:术中大鼠死亡2只(麻醉过量死亡1只,血液误吸死亡1只); 术后第14天,大鼠死亡1只(涨气死亡), 存活率为75%。实验组:术后大鼠死亡1只(涨气死亡),存活率为92%。实验组大鼠存活率高于对照组(P < 0.05)。
2.2 2组大鼠体质量术后各时间点实验组大鼠体质量高于对照组(P < 0.05),微创手术对大鼠刺激较小,实验组大鼠在术后可以较快生长,见图 3。
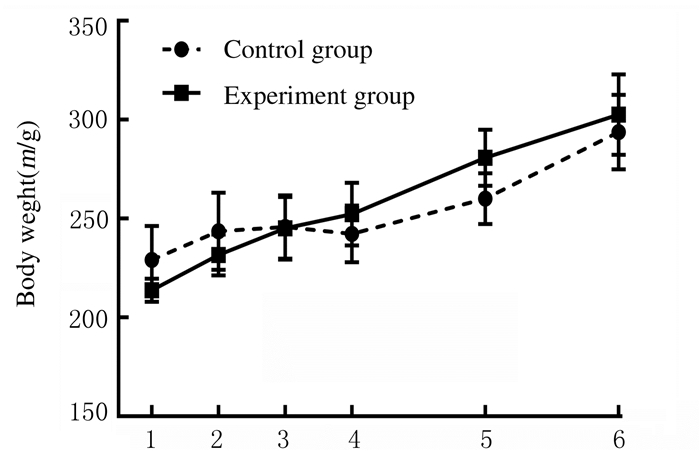
|
| 1:9 d before surgery; 2:6 d before surgery; 3:3 d before surgery; 4:During surgery; 5:7 d after surgery; 6:14 d after surgery. 图 3 不同时间2组大鼠体质量 Fig. 3 Body weights of rats in two groups at different time points |
|
|
实验组大鼠可见拔除的切牙完整连续(图 4A,见插页六),牙根底部伴有牙囊组织,切牙拔牙创未见明显的牙龈和牙槽骨损伤(图 4B,见插页六)。实验组大鼠完整拔除11颗切牙, 切牙完整拔除率为92% (图 4C,见插页六);对照组完整拔除5颗, 切牙完整拔除率仅为42% (图 4D,见插页六);实验组大鼠切牙完整拔除率高于对照组(χ2=6.75,P < 0.05)。
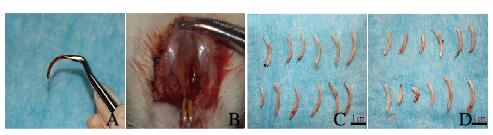
|
| A: Extraction of incisors; B: Extraction socket; C: Experiment group; D: Control group. 图 4 2组大鼠切牙拔除效果图 Fig. 4 Diagram of extraction of incisors of rats in two groups |
|
|
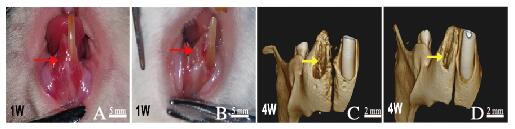
软组织愈合:对照组大鼠在术后第1天可见牙龈撕裂伤,术后第7天后可见拔牙创周围软组织红肿(图 5A, 见插页六)。实验组大鼠术后第1天均见拔牙创周围软组织轻微红肿, 未见明显损伤; 术后第7天拔牙创愈合均良好(图 5B,见插页六)。
|
| A, B: 1 week after operation; C, D: 4 weeks after operation; Red arrow:Soft tissue healing; Yellow arrow: Alveolar bone repair. 图 5 2组大鼠软组织和牙槽骨愈合情况 Fig. 5 Healing conditions of soft tissue and alveolar bone of rats in two groups |
|
|
牙槽骨愈合:术后1个月通过Micro-CT分析大鼠拔牙创牙槽骨愈合情况。对照组大鼠拔牙窝(图 5C,见插页六)愈合不佳,再生的骨小梁结构紊乱,牙槽骨的牙槽脊顶处未形成良好的骨闭合;实验组大鼠拔牙窝(图 5D,见插页六)愈合良好,新生骨组织位于拔牙窝内,新生骨与宿主骨之间过度自然,且牙槽脊顶处形成良好的骨闭合作用。
3 讨论大鼠切牙的拔牙创模型是研究美学区拔牙窝骨愈合的一个经典模型,并且其愈合过程可以分为3个不同阶段:①凝结物的形成和细胞增殖; ②结缔组织的形成和愈合;③在术后第28天时完成了骨改建和骨再生过程,相当于人类术后第64天的愈合结果[8]。因此,成功建立大鼠美学区切牙拔牙创模型对于探讨拔牙创软、硬组织的修复过程具有重要临床意义。但是大鼠切牙牙齿细长而脆,牙根位于磨牙下方并连接牙囊组织,更重要的是切牙组织伴有一定弧度[11-12],故常规手术方式很难完整拔除切牙并保留牙周组织,一旦牙根在体内折断,缺乏专业器械进行处理,不仅影响大鼠拔牙创模型制作,还会进一步影响美学区软、硬组织的恢复[13],因此有必要研究一种适用于美学区的微创拔牙方式,以提高大鼠切牙完整拔除率。
改良微创拔牙手术是通过对既往实验研究技术的改良和常规临床器械的优化应用,在不添加复杂手术器械的条件下完成整个手术,该微创手术方法适于临床推广应用。在拔牙手术前,在对应的时间点分别采用分离器分离牙龈并沿着平龈缘方向磨除大鼠的切牙牙冠,大鼠的切牙在3 d后可以恢复到原有牙齿长度的2/3。这是由于大鼠切牙具有独特的牙囊组织,其可以促进牙齿在切牙水平上不断生长[14]。牙囊组织受到局部刺激可以促进牙冠爆发性生长,切牙周围的牙龈组织受到外界分离器械的影响, 进一步促进牙周组织水肿[5]。使用牙龈分离器械和光敏雕刻刀切除牙冠附着的牙周韧带,不仅进一步减少切牙冠方的阻力,而且保留了美学区牙龈组织,为后期软组织修复提供了基础。术后适当的止血措施进一步降低了大鼠牙龈组织的损伤[15]。本研究结果显示:采用改良方式操作的大鼠存活率提高、拔除牙齿完整数增加、拔牙创软组织损伤减少并且愈合快且好。
传统手术方式采用探针分离牙龈、挺松牙齿,改良微创手术则是利用临床上常规的牙龈分离器及光敏雕刻刀作为牙龈分离器和牙挺。牙龈分离器和光敏雕刻刀具有更为细小的组织分离功能和强大的支撑作用, 在分离牙龈及挺松牙齿过程中操作更加便利[16]。虽探针可应用于大鼠的拔牙过程,但探针具有较小的尖端,很大程度上会造成牙周组织的损伤,并且由于探针颈部较粗,分离和挺松大鼠的磨牙相对容易,但由于切牙的牙龈组织更为密合且坚韧,使用探针分离容易造成牙龈组织分离不彻底且伴有较大的损伤[12, 17]。光敏雕刻刀有薄且锋利的刀刃,更容易插入牙周间隙切断附着的胶原纤维,伴有一定的弧度可以形成良好的杠杆作用[18]。止血钳上缠绕棉卷不仅降低切牙牙冠碎裂的风险,而且增强了对切牙牙冠的摩擦力, 避免了因支点受力不均匀而导致的牙根折断,同时也避免了止血钳误将牙龈组织卷入而造成牙龈撕脱。本文作者严格遵守牙挺和牙钳的使用原理和操作步骤,提高了切牙完整拔除率[19]。
前牙美学区拔牙创的恢复不仅需要良好的骨组织支撑,还应具有良好的形态和外观[20]。拔牙窝的及时止血对术后的拔牙创愈合及抑制牙槽骨吸收具有极大影响[21]。拔牙手术不可避免地会造成软组织和牙槽骨的损伤并进一步诱导牙槽脊吸收,不利于后期牙槽脊软、硬组织的恢复和治疗[22]。在本文作者设计的微创拔牙手术方案中,利用四手操作在牙齿拔除后迅速采用缠绕棉卷的探针插入拔牙窝中,从而有效地抑制了大鼠拔牙窝出血。在牙齿拔除后将牙龈组织恢复至原有形状和位置,从而在术后维持了原有软组织的尺寸及丰满度,满足美学区对牙齿拔牙手术的要求[23]。微创手术更加符合动物福利及3R原则:reduction(减少)、replacement(替代)和refinement(优化)[24],减少实验操作对动物造成的刺激、痛苦及恐惧,降低手术失败率,并节省了该环节中造成的人力和物力浪费。
本研究结果表明:改良的微创拔牙方法可以明显提升美学区牙齿的拔除效果,并且最大程度地保留了原有牙槽骨软、硬组织尺寸,从而为后期软、硬组织修复奠定了基础。本实验结果为在美学区建立拔牙创模型提供了思路和方法,同时微创拔牙方式也可为构建美学区牙槽脊保存实验动物模型提供了新策略。
| [1] |
JUNG R E, IOANNIDIS A, HAMMERLE C H F, et al. Alveolar ridge preservation in the esthetic zone[J]. Periodontol2000, 2018, 77(1): 165-175. DOI:10.1111/prd.12209 |
| [2] |
NAENNI N, BIENZ S P, MUNOZ F, et al. Volumetric changes following ridge preservation or spontaneous healing and early implant placement with simultaneous guided bone regeneration[J]. J Clin Periodontol, 2018, 45(4): 484-494. DOI:10.1111/jcpe.12860 |
| [3] |
OHSHIMA H, NAKASONE N, HASHIMOTO E, et al. The eternal tooth germ is formed at the apical end of continuously growing teeth[J]. Arch Oral Biol, 2005, 50(2): 153-157. DOI:10.1016/j.archoralbio.2004.09.008 |
| [4] |
CHEN C H, PEI X, TULU U S, et al. A comparative assessment of implant site viability in humans and rats[J]. J Dent Res, 2018, 97(4): 451-459. DOI:10.1177/0022034517742631 |
| [5] |
LI C, SHI C, KIM J, et al. Erythropoietin promotes bone formation through EphrinB2/EphB4 signaling[J]. J Dent Res, 2015, 94(3): 455-463. DOI:10.1177/0022034514566431 |
| [6] |
CHEN X C, YANG B, TIAN J, et al. Dental follicle stem cells ameliorate lipopolysaccharide-induced inflammation by secreting TGF-β 3 and TSP-1 to elicit macrophage M2 polarization[J]. Cell Physiol Biochem, 2018, 51(5): 2290-2308. DOI:10.1159/000495873 |
| [7] |
RAKHMATIA Y D, AYUKAWA Y, FURUHASHI A, et al. Carbonate apatite containing statin enhances bone formation in healing incisal extraction sockets in rats[J]. Materials (Basel), 2018, 11(7): E1201. DOI:10.3390/ma11071201 |
| [8] |
HASSUMI J S, MULINARI-SANTOS G, FABRIS A L DS, et al. Alveolar bone healing in rats:micro-CT, immunohistochemical and molecular analysis[J]. J Appl Oral Sci, 2018, 26: e20170326. |
| [9] |
ZHOUX, YANG J, WU L, et al. Evaluation of the effect of implants placed in preserved sockets versus fresh sockets on tissue preservation and esthetics:a meta-analysis and systematic review[J]. J Evid-Based Dent Pract, 2019, 19(4): 101336. DOI:10.1016/j.jebdp.2019.05.015 |
| [10] |
KUROSHIMA S, SASAKI M, MURATA H, et al. Medication-related osteonecrosis of the jaw-like lesions in rodents:A comprehensive systematic review and meta-analysis[J]. Gerodontology, 2019, 36(4): 313-324. DOI:10.1111/ger.12416 |
| [11] |
KHOSWANTO C. A new technique for research on wound healing through extraction of mandibular lower incisors in wistar rats[J]. J Dent, 2019, 13(2): 235-237. |
| [12] |
HO S P, YU B, YUN W, et al. Structure, chemical composition and mechanical properties of human and rat cementum and its interface with root dentin[J]. Acta Biomater, 2009, 5(2): 707-718. DOI:10.1016/j.actbio.2008.08.013 |
| [13] |
TORUL D, KURT S, KAMBEROGLU K. Apical surgery failures:extraction or re-surgery report of five cases[J]. J Dent Res Dent Clin Dent Prospects, 2018, 12(2): 116-119. DOI:10.15171/joddd.2018.018 |
| [14] |
TUMMERS M, THESLEFF I. Root or crown:a developmental choice orchestrated by the differential regulation of the epithelial stem cell niche in the tooth of two rodent species[J]. Development, 2003, 130(6): 1049-1057. DOI:10.1242/dev.00332 |
| [15] |
CHOI A Y, REDDY C M, MCGARY R T, et al. Adjunctive nd:yag laser irradiation for ridge preservation and immediate implant procedures:a consecutive case series[J]. Clin Adv Periodont, 2019, 9(3): 125-134. DOI:10.1002/cap.10059 |
| [16] |
GUNAY A, ARPAG O F, ATILGAN S, et al. Effects of caffeic acid phenethyl ester on palatal mucosal defects and tooth extraction sockets[J]. Drug Des Dev Ther, 2014, 8: 2069-2074. |
| [17] |
NIE L, ZHANG H, REN A, et al. Nano-hydroxyapatite mineralized silk fibroin porous scaffold for tooth extraction site preservation[J]. Dent Mater, 2019, 35(10): 1397-1407. DOI:10.1016/j.dental.2019.07.024 |
| [18] |
YUAN X, PEI X, ZHAO Y, et al. Biomechanics of immediate postextraction implant osseointegration[J]. J Dent Res, 2018, 97(9): 987-994. DOI:10.1177/0022034518765757 |
| [19] |
EL-KENAWY M H, AHMED W M S. Comparison between physics and conventional forces in simple dental extraction[J]. J Maxillofac Oral Surg, 2015, 14(4): 949-955. DOI:10.1007/s12663-015-0765-6 |
| [20] |
CHAPPUIS V, ARAUJO M G, BUSER D. Clinical relevance of dimensional bone and soft tissue alterations post-extraction in esthetic sites[J]. Periodontol 2000, 2017, 73(1): 73-83. DOI:10.1111/prd.12167 |
| [21] |
POLIMENI G, XIROPAIDIS A V, WIKESJO U M. Biology and principles of periodontal wound healing/regeneration[J]. Periodontol 2000, 2006, 41(1): 30-47. DOI:10.1111/j.1600-0757.2006.00157.x |
| [22] |
SCHROPP L, WENZEL A, KOSTOPOULOS L, et al. Bone healing and soft tissue contour changes following single-tooth extraction:a clinical and radiographic 12-month prospective study[J]. Int J Periodont Restorative Dent, 2003, 23(4): 313-323. |
| [23] |
CHAPPUIS V, ENGEL O, REYES M, et al. Ridge alterations post-extraction in the esthetic zone:a 3d analysis with CBCT[J]. J Dent Res, 2013, 92(12 Suppl): 195-201. |
| [24] |
SNEDDON L U, HALSEY L G, BURY N R. Considering aspects of the 3Rs principles within experimental animal biology[J]. J Exp Biol, 2017, 220(Pt17): 3007-3016. |
 2020, Vol. 46
2020, Vol. 46


