扩展功能
文章信息
- 林久涵, 田琳, 张娜娜, 董营, 吕航, 王丹, 曲萌, 张勇, 孙连坤, 于春艳, 刘希
- LIN Jiuhan, TIAN Lin, ZHANG Nana, DONG Ying, LYU Hang, WANG Dan, QU Meng, ZHANG Yong, SUN Liankun, YU Chunyan, LIU Xi
- 线粒体动力学改变对APP/PS1小鼠移植黑色素瘤生长的抑制作用
- Inhibitory effect of mitochondrial dynamics changes on growth of transplanted melanoma in APP/PS1 mice
- 吉林大学学报(医学版), 2020, 46(03): 476-481
- Journal of Jilin University (Medicine Edition), 2020, 46(03): 476-481
- 10.13481/j.1671-587x.20200308
-
文章历史
- 收稿日期: 2019-12-04
2. 北华大学医学院临床医学系, 吉林 吉林 132013;
3. 北华大学医学院分子生物教研室, 吉林 吉林 132013;
4. 吉林大学基础医学院病理生理学系, 吉林 长春 130021;
5. 北华大学医学院细胞生物教研室, 吉林 吉林 132013
2. Department of Clinical Medicine, College of Medical Sciences, Beihua University, Jilin 132013, China;
3. Department of Molecular Biology, School of Medical Sciences, Beihua University, Jilin 132013, China;
4. Department of Pathophysiology, School of Basic Medical Sciences, Jilin University, Changchun 130021, China;
5. Department of Cell Biology, College of Medical Sciences, Beihua University, Jilin 132013, China
阿尔茨海默病(Alzheimer disease, AD)和恶性肿瘤是威胁人类健康的两大疾病。线粒体功能障碍是神经系统疾病和肿瘤病理生理过程的关键因素[1-2]。线粒体功能与线粒体动力学相协调,线粒体动力学包括线粒体融合和分裂及线粒体自噬等[3-4]。线粒体本身处于一种动态变化状态,在融合和分裂之间变化;线粒体自噬与线粒体分裂融合过程关系密切,当线粒体分裂融合失衡时,线粒体自噬便被启动,清除受损的线粒体[5-8]。线粒体动力学在细胞器水平上监测着线粒体结构和功能的完整性。在同一例老年患者中鲜有同时发生AD和恶性肿瘤的情况[9-10],但其机制尚未见相关报道。本研究采用APP/PS1双转基因小鼠,移植黑色素瘤B16细胞,复制同时患AD和恶性肿瘤的动物模型,探讨线粒体分裂和融合及线粒体自噬的变化对移植瘤生长的影响及其作用机制。
1 材料与方法 1.1 实验动物、细胞、主要试剂和仪器7只健康C57BL/6J小鼠和7只APP/PS1小鼠,体质量16~20 g,雄性,购自北京华阜康股份有限公司,SPF级,动物使用许可证号:SCXK(京)2014-0004。所有小鼠饲养于通风和安静环境中,定时喂食,饮水不限。黑色素瘤B16细胞为吉林大学基础医学院病理生理学系提供。线粒体融合蛋白2(mitofusin 2,Mfn2)、动力相关蛋白1(dynamin related protein,Drp1)、线粒体分裂蛋白1(mitochondrial fission 1,Fis1)、泛素化及多泛素化蛋白(ubiquitin and polyubiquitin)、PTEN诱导假定激酶1(PTEN induced putative kinase 1,PINK1)、Parkin和β-actin抗体购自美国Santa Cruz公司,LC3抗体购自美国Abcam公司。蛋白浓度分析仪、蛋白质电泳装置、转移系统和凝胶成像系统购自美国Bio-Rad公司。
1.2 C57BL/6J和APP/PS1小鼠黑色素瘤模型的建立取7只C57BL/6J小鼠(C57移植瘤组)和7只APP/PS1转基因小鼠(APP/PS1移植瘤组)建立移植瘤模型。培养B16细胞,取处于对数生长期B16细胞,采用不含EDTA的0.25%胰酶消化收集细胞。采用无菌PBS洗涤2次,再采用PBS重悬,细胞浓度为1×107mL-1,采用无菌注射器将100 μL细胞悬液接种到小鼠背部右侧皮下[11]。小鼠饲养在22 ℃~24 ℃、湿度为40%~60%动物房中,每天观察小鼠状态和肿瘤生长状况,并每2 d用游标卡尺测量和记录肿瘤直径和体积,观察肿瘤成瘤时间、成瘤率和生长时间,计算肿瘤体积。肿瘤体积=长×宽×高×π/6。
1.3 光学显微镜下观察2组小鼠移植瘤组织形态表现采用10%水合氯醛麻醉小鼠,将胸廓剪开,暴露心脏,把灌注针头经左心室刺入至主动脉,用止血钳加以固定,然后剪开右心房,先用生理盐水对其进行快速灌注冲洗直至脏器变白,然后以4%多聚甲醛磷酸盐缓冲液(pH=7.4)对其进行灌注固定,最后将小鼠处死,取出完整皮下移植瘤组织,置于4%多聚甲醛中固定24 h。采用常规方法经过脱水、透明、包埋和切片制作石蜡切片,HE染色,封片,Olympus光学显微镜下观察并摄片。
1.4 Western blotting法检测2组小鼠肿瘤组织中Mfn2、Drp1、Fis1、泛素化及多泛素化蛋白、LC3-Ⅱ、PINK1和Parkin蛋白表达水平按1 mL·100 mg-1的量加入RIPA组织裂解液,提取总蛋白。采用Bio-Rad法测定蛋白浓度,配制12%聚丙烯酰胺凝胶,以β-actin作为等量蛋白质上样对照,取30 μg蛋白质样品进行SDS-PAGE电泳,并采用恒压(100 V)将蛋白转至PVDF膜,之后用10%脱脂奶粉室温封闭1h转至硝酸纤维素膜上;5%奶粉室温封闭2 h后,采用含0.01% Tween20的TBS缓冲液(TBST)漂洗3次,每次10 min;加入相应的抗体Mfn2(1:200)、Fis1(1:200)、Drp1(1:200)、泛素化及多聚泛素化蛋白(1:200)、LC3-Ⅱ(1:1 000)、PINK1(1:200)、Parkin (1:200)和β-actin (1:200),4℃孵育过夜,TBST漂洗3次后加入相应的辣根过氧化物酶标记的二抗(1:2 000),37℃摇床温育2 h;TBST漂洗3次,每次10 min;DAB显色,凝胶图像分析系统拍照,同时以β-actin作为内参照,进行蛋白表达分析,各个条带蛋白表达水平采用吸光度(A)值表示,计算2组小鼠移植瘤组织中Mfn2、Fis1、Drp1、泛素化和多聚泛素化蛋白、LC3-Ⅱ、PINK1和Parkin蛋白表达水平。目的蛋白表达水平=目的蛋白条带A值/β-actin条带A值。
1.5 统计学分析采用SPSS 20.0统计软件进行统计学分析。2组小鼠肿瘤体积,移植瘤组织中Mfn2、Fis1、Drp1、泛素化及多泛素化蛋白、LC3-Ⅱ、PINK1和Parkin蛋白表达水平以x±s表示,组间样本均数比较采用t检验。以P < 0.05为差异有统计学意义。
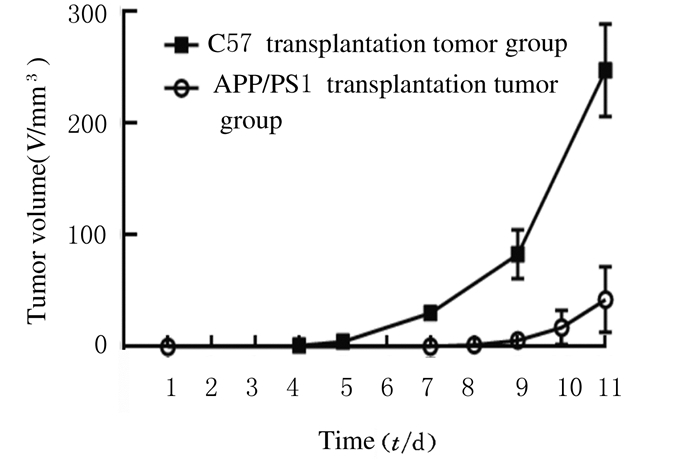
2 结果 2.1 移植黑色素瘤后2组小鼠肿瘤体积C57移植瘤组小鼠接种黑素瘤B16细胞第4天开始出现肿瘤,第5天全部出现肿瘤,第11天肿瘤体积为(94.5±12.1)mm3。APP/PS1移植瘤组小鼠第7天开始出现肿瘤,第9天全部出现肿瘤,第11天肿瘤体积为(19.1±8.9)mm3,2组小鼠肿瘤生成曲线见图 1。与C57移植瘤组比较,APP/PS1移植瘤组出现肿瘤时间晚,肿瘤体积小(P < 0.05)。
|
| *P < 0.05 compared with C57 transplantation tumor group. 图 1 2组小鼠肿瘤生长曲线 Fig. 1 Tumor growth curves of mice in two groups |
|
|
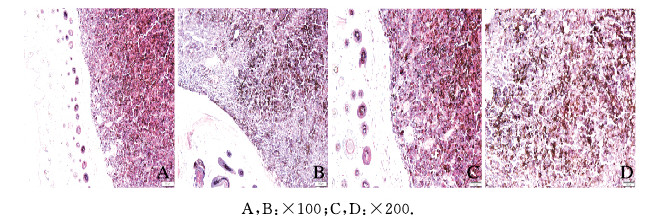
C57移植瘤组和APP/PS1移植瘤组小鼠皮下可见黑色素瘤组织,呈现实体瘤形态,肿瘤组织中含有黑色素颗粒,与C57移植瘤组比较,APP/PS1移植瘤组小鼠肿瘤组织黑色素颗粒数量减少,颜色淡染。见图 2(插页四)。
|
| 图 2 HE染色观察C57移植瘤组(A, C)和APP/PS1移植瘤组(B, D)小鼠肿瘤组织形态表现 Fig. 2 Morphology of tumor tissue of mice in C57 transplantation tumor group(A, C) and APP/PS1 transplantation tumor group(B, D) observed by HE staining |
|
|
与C57移植瘤组比较,APP/PS1移植瘤组小鼠肿瘤组织中表达水平降低(P<0.05),Drp1及Fis1表达水平升高(P<0.05),见图 3。

|
| Lane 1: C57 transplantation tumor group; Lane 2: APP/PS1 transplantation tumor group. n=3, * P < 0.05 compared with C57 transplantation tumor group. 图 3 2组小鼠肿瘤组织中Mfn2、Drp1和Fis1蛋白表达电泳图(A)和直条图(B) Fig. 3 Electrophoregram (A) and histogram (B) of expressions of Mfn2, Drp1 and Fis1 proteins in tumor tissue of mice in two groups |
|
|
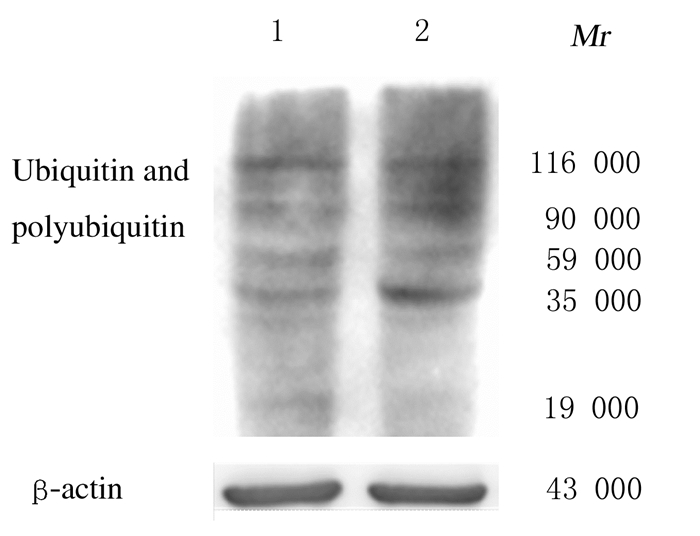
泛素化及多泛素化蛋白表达检测结果显示:与C57移植瘤组比较,APP/PS1移植瘤组小鼠肿瘤组织中泛素化及多泛素化蛋白表达水平升高。见图 4。
|
| Lane 1: C57 transplantation tumor group; Lane 2: APP/PS1 transplantation tumor group. n=3, *P < 0.05 compared with C57 transplantation tumor group. 图 4 2组小鼠肿瘤肿瘤组织中泛素化及多泛素化蛋白表达电泳图 Fig. 4 Electrophoregram of expressions of ubiquitin and polyubiquitin protein in tumor tissue of mice in two groups |
|
|
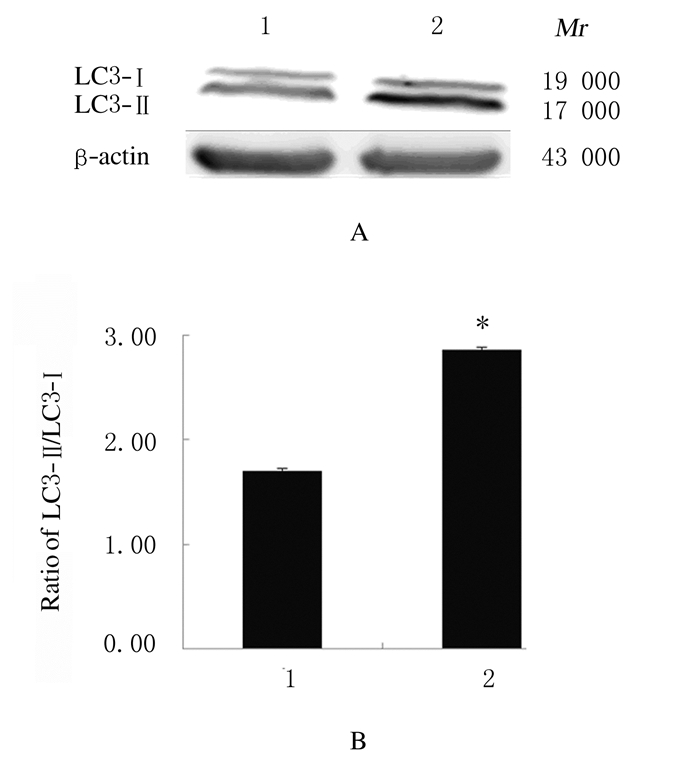
与C57移植瘤组比较,APP/PS1移植瘤组小鼠肿瘤组织中LC3-Ⅱ蛋白表达水平升高(P<0.05),LC3-Ⅱ/LC3-Ⅰ蛋白表达水平升高(P<0.05)。见图 5。
|
| Lane 1: C57 transplantation tumor group; Lane 2: APP/PS1 transplantation tumor group. 1:C57 transplantation tumor group; 2:APP/PS1 transplantation tumor group.n=3, *P < 0.05 compared with C57 transplantation tumor group. 图 5 2组小鼠肿瘤组织中LC3-Ⅱ蛋白表达电泳图(A)和直条图(B) Fig. 5 Electrophoregram (A) and histogram (B) of LC3-Ⅱ protein in tumor tissue of mice in two groups |
|
|
与C57移植瘤组比较,APP/PS1移植瘤组小鼠肿瘤组织中PINK1和Parkin蛋白表达水平均升高(P<0.05)。见图 6。
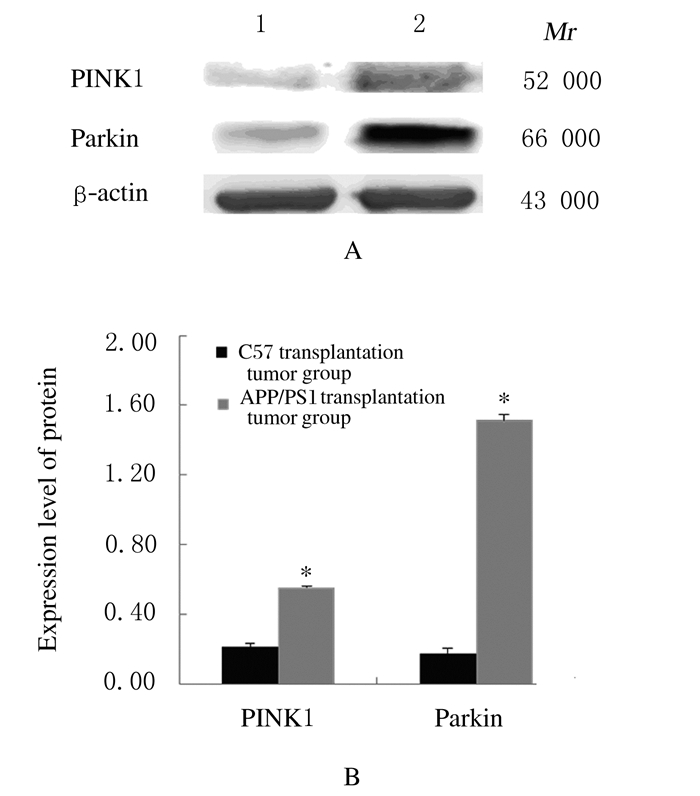
|
| Lane 1: C57 transplantation tumor group; Lane 2: APP/PS1 transplantation tumor group. n=3, *P < 0.05 compared with C57 transplantation tumor group. 图 6 2组小鼠肿瘤肿瘤组织中PINK1和Parkin蛋白表达电泳图(A)和直条图(B) Fig. 6 Electrophoregram (A) and histogram (B) of PINK1 and Parkin proteins in tumor tissue of mice in two groups |
|
|
本研究基于同时患有AD和恶性肿瘤的动物模型,从线粒体动力学平衡角度,探讨移植瘤小鼠肿瘤生长情况的差异及可能的作用。有研究[12]显示:在APP转基因小鼠模型的脑皮质中,免疫沉淀和免疫荧光实验发现:β-淀粉样蛋白(Aβ)与Drp1相互作用,诱导线粒体分裂,抑制线粒体融合。Mfn2功能失调与AD之间有关联。AD患者额叶皮质中Mfn2水平降低,患者尸检结果[13]显示:海马神经元中Mfn2水平也降低。Mfn2 mRNA和蛋白表达水平在不同类型的恶性肿瘤中均降低,使肿瘤细胞停滞于G0/G1期,抑制肿瘤细胞增殖[14],提示线粒体融合/分裂平衡的变化不仅与AD病变的线粒体功能障碍有关,而且还与肿瘤的发生发展有关。本研究结果显示:APP/PS1移植瘤组小鼠肿瘤组织中Mfn2蛋白表达水平降低,Drp1及Fis1蛋白表达水平均升高,提示APP/PS1小鼠移植瘤组织中线粒体融合和分裂发生紊乱,表现为线粒体融合不足及过度线粒体分裂,致使线粒体结构和功能发生改变,可能累及肿瘤组织细胞的增殖,这可能是APP/PS1移植瘤组织生长缓慢的原因。
有研究[15]显示:在饥饿时线粒体缺乏Mfn2,线粒体融合减少,发生自噬降解。沉默Drp1后可以降低鱼藤酮诱导SH-SY5Y细胞的线粒体自噬以及细胞凋亡,Drp1参与鱼藤酮诱导帕金森病细胞模型发生线粒体自噬[16]。可见当线粒体融合和分裂发生变化时,线粒体自噬便被启动[17]。线粒体自噬紊乱在AD和肿瘤中已有许多报道[8, 14]。在APP/PS1转基因小鼠海马组织中可见线粒体嵴受损伤以及线粒体碎片,还可见自噬蛋白LC3-Ⅱ蛋白表达水平升高。尽管有研究[18]显示:AD患者大脑中存在大量未降解的线粒体自噬体,但Aβ注入小鼠海马CA区诱导AD模型可见线粒体自噬标志物水平显著升高,同时检测到PINK1和Parkin蛋白表达水平均升高[19],提示线粒体自噬在AD发病时期增强。线粒体自噬能很好地起到控制肿瘤细胞质量的作用。在肺癌、神经胶质瘤和结肠癌等各种肿瘤组织中常检测到Parkin突变[20]。在肿瘤生长初期,线粒体自噬可通过减少细胞的应激反应和基因组损伤,以保证细胞代谢的正常,防止肿瘤细胞的进一步发展;在肿瘤生长的后期,线粒体自噬会在肿瘤细胞中增强,肿瘤细胞增殖会随着线粒体自噬水平的升高受到限制。本研究结果显示:APP/PS1移植瘤组织中PINK1和Parkin蛋白表达水平均升高。已经有研究[21]显示:Parkin基因与人类结直肠癌的腺瘤性息肉病呈显著相关性,Parkin过度表达抑制了结肠癌细胞的增殖,提示PINK1/Parkin信号途径作为自噬和线粒体异常消除的关键因素之一,参与APP/PS1移植瘤组织的线粒体自噬调节,并影响肿瘤细胞增殖,这可能与APP/PS1荷瘤组肿瘤组织生长缓慢有关。
线粒体功能与线粒体动力学活动相协调。线粒体动力学由其融合与裂变的平衡以及线粒体自噬等严格调控。当APP进入线粒体后可以与线粒体内膜上的线粒体呼吸链复合物Ⅳ结合影响线粒体ATP活性[22]。3月龄APP转基因小鼠的线粒体膜电位和ATP水平降低。能量代谢障碍被认为是AD早期发病和疾病进展的共性环节,研究[23]表明:能量代谢障碍会促进氧化应激和AD病理产物累积。人肝癌组织中Drp1与Mfn2比值明显升高,比值越大预后越不佳[24],线粒体的动力学状态变化也影响细胞的能量代谢状态[25-26]。Mfn2缺失抑制线粒体呼吸链复合体Ⅰ、Ⅱ、Ⅲ和Ⅴ等某些亚基表达,从而导致其酶活性降低。在能量供应不足的情况下,自噬清除受损伤线粒体又增加了机体对能量的需求,致使能量供应与需求的极度不平衡,说明细胞命运与细胞的代谢状态存在内在联系。本研究从细胞器水平将线粒体质量控制与生物能量联系起来,突出了线粒体分裂和融合的平衡及线粒体自噬在同时患有AD和肿瘤的动物模型体内的关键作用,使得线粒体动力学成为评价肿瘤和AD内在联系的分子标志。本研究结果为临床治疗AD提供理论依据。
| [1] |
GARCIA-ESCUDERO V, MARTIN-MAESTRO P, PERRY G, et al. Deconstructing mitochondrial dysfunction in Alzheimer disease[J]. Oxid Med Cell Longev, 2013, 2013: 162152. |
| [2] |
张泽, 董琼珠, 钦伦秀. 线粒体动力学与肿瘤的研究进展[J]. 复旦学报(医学版), 2019, 46(1): 128-132. DOI:10.3969/j.issn.1672-8467.2019.01.023 |
| [3] |
牟连伟, 顾博雅, 李岩, 等. 有氧运动改善AD模型APP/PS1双转基因小鼠中枢神经元线粒体融合分裂动态平衡[J]. 中国生物化学与分子生物学报, 2019, 35(2): 171-178. |
| [4] |
胡斐, 武丹阳, 牛亚丹, 等. 线粒体自噬在肿瘤发生发展中的双重作用[J]. 生命的化学, 2019, 39(4): 766-771. |
| [5] |
ASHRAFI G, SCHWARZ T L. The pathways of mitophagy for quality control and clearance of mitochondria[J]. Cell Death Differ, 2013, 20(1): 31-42. DOI:10.1038/cdd.2012.81 |
| [6] |
彭鑫, 樊攀, 吴小涛, 等. 线粒体形态改变及pink1/parkin通路参与线粒体自噬的研究进展[J]. 现代医学, 2019, 47(4): 483-487. |
| [7] |
李瑞萌, 赵进, 刘岩. PINK1/Parkin介导的线粒体自噬[J]. 中国生物化学与分子生物学报, 2019, 35(10): 1072-1079. |
| [8] |
SANTOS R X, CORREIA S C, WANG X L, et al. A synergistic dysfunction of mitochondrial fission/fusion dynamics and mitophagy in Alzheimer's disease[J]. J Alzheimers Dis, 2010, 20(Suppl 2): S401-S412. |
| [9] |
石海滨.阿尔茨海默病与恶性肿瘤发病风险的Meta分析[D].重庆: 重庆医科大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10631-1014409516.htm
|
| [10] |
MUSICCO M, ADORNI F, DI SANTO S, et al. Inverse occurrence of cancer and Alzheimer disease:a population-based incidence study[J]. Neurology, 2013, 81(4): 322-328. DOI:10.1212/WNL.0b013e31829c5ec1 |
| [11] |
牟霞, 陆洪光, 吴承龙, 等. B16小鼠皮肤恶性黑素瘤模型的建立[J]. 中华皮肤科杂志, 2004, 37(10): 613. DOI:10.3760/j.issn:0412-4030.2004.10.023 |
| [12] |
徐琳琳.阿尔茨海默病模型APPsw/PS1dE9双转基因小鼠中线粒体动力学的动态变化[D].济南: 山东大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10422-1017267720.htm
|
| [13] |
ZHAO N, ZHANG Y, LIU Q, et al. Mfn 2 affects embryo development via mitochondrial dysfunction and apoptosis[J]. PLoS One, 2012, 10(5): e0125680. |
| [14] |
刘瑶, 贺兴波, 郑弘毅, 等. 线粒体质量控制失调与恶性肿瘤发生和发展相关性的研究进展[J]. 生物化学与生物物理进展, 2018, 45(5): 501-511. |
| [15] |
RAMBOLD A S, KOSTELECKY B, LIPPINCOTTSCHWARTZ J. Together we are stronger:fusion protects mitochondria from autophagosomal degradation[J]. Autophagy, 2011, 7(12): 1568-1569. DOI:10.4161/auto.7.12.17992 |
| [16] |
周鸿雁, 张德元, 申存周, 等. siRNA沉默Drp1对鱼藤酮诱导的自噬和凋亡的影响[J]. 临床和实验医学杂志, 2018, 17(11): 1121-1125. DOI:10.3969/j.issn.1671-4695.2018.11.001 |
| [17] |
BAKER M J, TATSUTA T, LANGER T. Quality control of mitochondrial proteostasis[J]. Cold Spring Harb Perspect Biol, 2011, 3(7): a007559. |
| [18] |
MOREIRA P I, SIEDLAK S L, WANG X, et al. Autophagocytosis of mitochondria is prominent in Alzheimer disease[J]. J Neuropathol Exp Neurol, 2007, 66(6): 525-532. DOI:10.1097/01.jnen.0000240476.73532.b0 |
| [19] |
WANG X, ZHAO X L, XU L L, et al. Mitophagy in APPsw/PS1dE9 transgenic mice and APPsw stably expressing in HEK293 cells[J]. Eur Rev Med Pharmacol Sci, 2015, 19(23): 4595-4602. |
| [20] |
O'FLANAGAN C H, MORAIS V A, WURST W, et al. The Parkinson's gene PINK1 regulates cell cycle progression and promotes cancer-associated phenotypes[J]. Oncogene, 2015, 34(11): 1363-1374. DOI:10.1038/onc.2014.81 |
| [21] |
POULOGIANNIS G, MCLNTYRE R E, DIMITRIADI M, et al. PARK2 deletions occur frequently in sporadic colorectal cancer and accelerate adenoma development in Apc mutant mice[J]. Proc Natl Acad Sci U S A, 2010, 107(34): 15145-15150. DOI:10.1073/pnas.1009941107 |
| [22] |
SCHMIDT C, LEPSVERDIZE E, CHI S L, et al. Amyloid precursor protein and Amyloid-peptide bind to ATP synthase and regulate its activity at the surface of neural cells[J]. Mol Psychiatry, 2007, 13(10): 953-969. |
| [23] |
ESTELA A G, AD DE G, EDUARDO B, et al. A key role for MAM in mediating mitochondrial dysfunction in Alzheimer disease[J]. Cell Death Dis, 2018, 9(3): 335. DOI:10.1038/s41419-017-0215-0 |
| [24] |
SENFT D, RONAI Z A. Regulatiors of mitochondrial dynamics in cancer[J]. Curr Opin Cell Biol, 2016, 39: 43-52. DOI:10.1016/j.ceb.2016.02.001 |
| [25] |
SHIEDS L Y, KIM H, ZHU L, et al. Dynamin-related protein 1 is required for normal mitochondrial bioenergetic and synaptic function in CA1 hippocampal neurons[J]. Cell Death Dis, 2015, 6(4): e1725. DOI:10.1038/cddis.2015.94 |
| [26] |
李学涵, 刘学良, 王平, 等. OGD动态处理后大鼠海马神经元线粒体裂解及凋亡相关蛋白的变化[J]. 西安交通大学学报(医学版), 2018, 39(6): 793-797. |
 2020, Vol. 46
2020, Vol. 46


